Romidepszin
| |||

| |||
| Romidepszin | |||
| IUPAC-név | |||
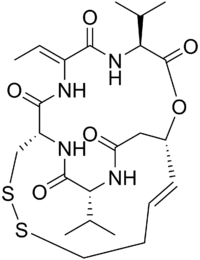
| (1S,4S,7Z,10S,16E,21R)-7-etilidén-4,21-diizopropil-2-oxa-12,13-ditia-5,8,20,23-tetrazabiciklo[8.7.6]trikoz-16-én-3,6,9,19,22-penton | |||
| Más nevek | FK228; FR901228; Istodax | ||
| Kémiai azonosítók | |||
| CAS-szám | 128517-07-7 | ||
| PubChem | 5352062 | ||
| ChemSpider | 10122002 | ||
| ChEBI | 61080 | ||
| ATC kód | L01XX39 | ||
| |||
| InChIKey | OHRURASPPZQGQM-GCCNXGTGSA-N | ||
| UNII | CX3T89XQBK | ||
| ChEMBL | 1213490 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C24H36N4O6S2 | ||
| Moláris tömeg | 540,695 g/mol | ||
| Farmakokinetikai adatok | |||
| Biohasznosíthatóság | nem értelmezhető (csak intravénás adagolás) | ||
| Metabolizmus | máj (döntően CYP3A4-mediált) | ||
| Biológiai felezési idő |
3 óra | ||
| Fehérjekötés | 92–94% | ||
| Terápiás előírások | |||
| Licenc adat | Romidepsin (USA) | ||
| Jogi státusz | vényköteles | ||
| Terhességi kategória | D (US) | ||
| Alkalmazás | Intravénás infúzió | ||
A romidepszin (más néven: Istodax) rákellenes hatású hatóanyag, amelyet a cutan T-sejtes limfóma (CTCL) és más perifériás T-sejtes limfómák (PTCL) kezelésében használnak. A romidepszin természetes eredetű anyag, amelyet a Chromobacterium violaceum nevű baktériumból nyernek. Hatása a hiszton-deacetiláz enzimek gátlásán, ezáltal az apoptózis indukcióján alapul.[1] Néha depszipeptidnek is nevezik, amely tulajdonképpen a molekulaosztály elnevezése, amelybe a romidepszin tartozik.
Történet
[szerkesztés]A romidepszinről először 1994-ben jelent meg tudományos cikk a Fujisawa Pharmaceutical Company (most Astellas Pharma) kutatóitól, akik egy – a Jamagata prefektúrából származó talajmintában lévő – Chromobacterium violaceum nevű baktériumkultúrából izolálták az anyagot.[2] Antibakteriális hatást nem vagy alig mutattak ki, ugyanakkor erős citotoxikus hatásúnak bizonyult számos humán ráksejtvonal esetében úgy, hogy közben nem befolyásolta az egészséges sejteket. Egerekkel végrehajtott állatkísérletek során in vivo daganatellenes aktivitást is találtak.[2]
A romidepszin első totálszintézisét harvardi kutatók hajtották végre és publikálták 1996-ban.[3] A hatásmechanizmusát 1998-ban derítették fel, amikor a Fujisawa és a Tokiói Egyetem kutatói kimutatták, hogy – a tricosztatin A-hoz hasonló hatással – a hiszton-deacetiláz enzimet gátolja.[4]
Klinikai vizsgálatok
[szerkesztés]A romidepszin 1997-ben kezdődő fázis I vizsgálatai során kezdetben a vegyületet a FK228 és FR901228 kódnevekkel illették.[5] A fázis II és fázis III vizsgálatok során számos indikációban vizsgálták hatásosságát. Jelentős hatásosságot a cutan T-sejtes limfóma (CTCL) és a többi perifériás T-sejtes limfómák (PTCL) esetén mutatták ki.[5]
A romidepszint 2004-ben az FDA gyorsított fejlesztési/engedélyeztetési eljárásra (Fast Track) alkalmasnak találta a cutan T-sejtes limfóma kezelésére. A ritka hatóanyag státuszt az FDA és az Európai Gyógyszerügynökség (EMA) is megadta ugyanezen indikációra.[5]
Az FDA 2009 novemberében engedélyezte CTCL,[6] 2011 júniusában pedig PTCL-ek kezelésére.[7] A gyógyszer forgalmazását az EU-ban nem engedélyezték.[8]
Immunomoduláns hatás
[szerkesztés]A romidepszinnek van immunomoduláns aktivitása,[9] és látens DNS vírus – például Epstein-Barr (EBV), varicella zoster, és hepatitis-B vírus – reaktivációját is okozhatja. Mindazonáltal a vizsgálatok során a hepatitis-B reaktivációjának klinikai jellemzői enyhék voltak és az orális antivirális terápiára reagáltak.[10] Azonban EBV-társított limfómás betegekben a romidepszin az EBV fertőzés számos reaktivációjával és akut hepatitisszel kapcsolatba hozható, amelyek súlyosak, akár végzetesek is lehetnek.[11]
2014-ben a LOS Pathogens c. folyóiratban publikáltak egy tanulmányt, amelyben romidepszint használtak látens HIV vírus újraaktiválására azért, hogy kimerítsék a HIV rezervoárt. A látensen fertőzött T-sejteket romidepszinnel kezelték ki in vitro és ex vivo, ami a kimutatható sejt-asszociált HIV vírus RNS-ének emelkedéséhez vezetett. A vizsgálat során összehasonlították a romidepszin gátló hatását egy másik hiszton-deacetiláz inhibitorral is, a Vorinostattal.[12]
Autizmus vizsgálatok állatmodelleken
[szerkesztés]Egy tanulmány során romidepszin autizmusellenes hatását állatmodellen (egér) tanulmányozták. Kis mennyiségű romidepszin csökkentette a szociális deficitet.[13]
Hatásmechanizmus
[szerkesztés]A romidepszin úgynevezett prodrugként viselkedik, a sejtbe való felvétel után alakul aktív metabolittá azáltal, hogy a benne lévő diszulfid híd redukálódik Zn-kötő tulajdonságú tiolcsoporttá.[2][14][15] A tiolcsoport kötődik a Zn-függő hiszton deacetiláz (HDAC) kötőhelyében lévő cinkionhoz, így gátolja az aktivitását. A HDAC inhibitorok egy része potenciálisan alkalmazható rák kezelésére a tumorszupresszor gének normális expressziójának epigenetikus helyreállítása révén, amely a sejtciklus leállását, differenciálódást és apoptózist eredményezhet.[16]
Mellékhatások
[szerkesztés]A klinikai vizsgálatok során a leggyakoribb mellékhatások a hányinger, a hányás, a fáradtság, a fertőzések, az étvágytalanság, a vérképzési rendellenességek (vérszegénység, thrombocytopenia és leukopenia) voltak. Különböző fertőzésekkel és metabolikus zavarokkal (például rendellenes elektrolitszint), bőrreakciókkal, ízérzékelés és a szív elektromos vezetésének megváltozásával volt kapcsolatba hozható a kezelés.[17]
Források
[szerkesztés]- ↑ NCI Drug Dictionary (angol nyelven). National Cancer Institute, 2011. február 2. (Hozzáférés: 2019. június 24.)
- ↑ a b c Ueda, Hirotsugu, Yasuhiro (1994. január 20.). „FR901228, a novel antitumor bicyclic depsipeptide produced by chromobacterium violaceum No. 968. I. Taxonomy, fermentation, isolation, physico-chemical and biological properties, and antitumor activity.” (angol nyelven). The Journal of Antibiotics 47 (3), 301–310. o. DOI:10.7164/antibiotics.47.301. ISSN 0021-8820.
- ↑ Li, Khan W., Wenning (1996. január 1.). „Total Synthesis of the Antitumor Depsipeptide FR-901,228” (angol nyelven). Journal of the American Chemical Society 118 (30), 7237–7238. o. DOI:10.1021/ja9613724. ISSN 0002-7863.
- ↑ Nakajima, Hidenori, Hiroshi (1998. május 1.). „FR901228, a Potent Antitumor Antibiotic, Is a Novel Histone Deacetylase Inhibitor” (angol nyelven). Experimental Cell Research 241 (1), 126–133. o. DOI:10.1006/excr.1998.4027.
- ↑ a b c Frank Petersen – René Amstutz: Natural Compounds as Drugs. 2008–07–29. ISBN 9783764385958 Hozzáférés: 2019. június 24.
- ↑ Patricia: The ChEMBL-og: New Drug Approvals - Pt. XXII - Romidepsin (Istodax). The ChEMBL-og, 2009. november 27. (Hozzáférés: 2019. június 24.)
- ↑ Drugs@FDA: FDA Approved Drug Products. www.accessdata.fda.gov. (Hozzáférés: 2019. június 24.)
- ↑ Istodax – European Medicines Agency
- ↑ Danaher, Robert J, Marion R (2005. január 1.). „Histone deacetylase inhibitors induce reactivation of herpes simplex virus type 1 in a latency-associated transcript–independent manner in neuronal cells” (angol nyelven). Journal of Neurovirology 11 (3), 306–317. o. DOI:10.1080/13550280590952817. ISSN 1355-0284.
- ↑ Hong, Xupeng, Haitao (2017. december 1.). „Epigenetic regulation of hepatitis B virus covalently closed circular DNA: Implications for epigenetic therapy against chronic hepatitis B: Hong, Kim, and Guo” (angol nyelven). Hepatology 66 (6), 2066–2077. o. DOI:10.1002/hep.29479.
- ↑ Kim, S. J., C. S. (2016. március 1.). „Epstein–Barr virus reactivation in extranodal natural killer/T-cell lymphoma patients: a previously unrecognized serious adverse event in a pilot study with romidepsin” (angol nyelven). Annals of Oncology 27 (3), 508–513. o. DOI:10.1093/annonc/mdv596. ISSN 0923-7534.
- ↑ Wei, Datsen George, Elizabeth (2014. április 10.). „Histone Deacetylase Inhibitor Romidepsin Induces HIV Expression in CD4 T Cells from Patients on Suppressive Antiretroviral Therapy at Concentrations Achieved by Clinical Dosing” (angol nyelven). PLoS Pathogens 10 (4), e1004071. o. DOI:10.1371/journal.ppat.1004071. ISSN 1553-7374.
- ↑ Qin, Luye, Zi-Jun (2018. április 1.). „Social deficits in Shank3-deficient mouse models of autism are rescued by histone deacetylase (HDAC) inhibition” (angol nyelven). Nature Neuroscience 21 (4), 564–575. o. DOI:10.1038/s41593-018-0110-8. ISSN 1097-6256.
- ↑ Shigematsu, Nobuharu, Shigehiro (1994. január 20.). „FR901228, a novel antitumor bicyclic depsipeptide produced by Chromobacterium violaceum No. 968. II. Structure determination.” (angol nyelven). The Journal of Antibiotics 47 (3), 311–314. o. DOI:10.7164/antibiotics.47.311. ISSN 0021-8820.
- ↑ Ueda, Hirotsugu, Sanae (1994. január 20.). „FR901228, a novel antitumor bicyclic depsipeptide produced by Chromobacterium violaceum No. 968. III. Antitumor activities on experimental tumors in mice.” (angol nyelven). The Journal of Antibiotics 47 (3), 315–323. o. DOI:10.7164/antibiotics.47.315. ISSN 0021-8820.
- ↑ Greshock, Thomas J., Yasuo (2008. február 1.). „Improved Total Synthesis of the Potent HDAC Inhibitor FK228 (FR-901228)” (angol nyelven). Organic Letters 10 (4), 613–616. o. DOI:10.1021/ol702957z. ISSN 1523-7060.
- ↑ Charkop, Headquarters 98 Ajanta House; ivili West: August « 2016 « New Drug Approvals (angol nyelven). (Hozzáférés: 2019. június 24.)
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben a Romidepsin című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.