Độc tố tả

Độc tố tả (còn gọi là choleragen và đôi khi được viết tắt là CTX, Ctx hay CT) là phức hợp protein được tiết ra bởi vi khuẩn Vibrio cholerae.[1] CTX gây ra bệnh tiêu chảy, dấu hiệu đặc trưng của bệnh dịch tả.[2]
Lịch sử
[sửa | sửa mã nguồn]Độc tố tả được phát hiện vào năm 1959 bởi Giáo sư Sambhu Nath De tại Kolkata (Ấn Độ).[3]
Cấu trúc
[sửa | sửa mã nguồn]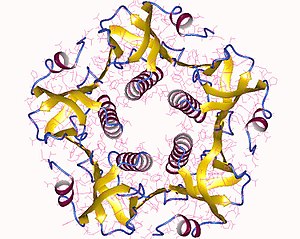
Chất độc cholera là một phức hợp oligomeric gồm sáu đơn vị protein nhỏ: một bản sao đơn của đơn vị nhỏ A (phần A, enzyme), và 5 bản sao của đơn vị nhỏ B (phần B, liên kết thụ thể), được biểu thị là AB5. Đơn vị nhỏ B liên kết trong khi đơn vị nhỏ A kích hoạt protein G kích hoạt cyclase adenylat. Cấu trúc ba chiều của độc tố được xác định bằng cách sử dụng tinh thể tia X của Zhang et al. vào năm 1995.[4]
Năm đơn vị nhỏ B - có trọng lượng 11 kDa cho mỗi đơn vị, tạo thành một vòng tròn năm đơn vị. Đơn vị nhỏ A là 28 kDa, có hai phân đoạn quan trọng. Phần A1 của chuỗi (CTA1) là một tải trọng enzym hình cầu mà các protein ADP-ribosylates G, trong khi chuỗi A2 (CTA2) hình thành một sợi xoắn alpha mở rộng, nằm trong lỗ trung tâm của vòng phân chia B.[5]
Cấu trúc này có hình dạng, cơ chế và trình tự tương tự với enterotoxin, không ổn định nhiệt do một số dòng vi khuẩn Escherichia coli tiết ra.
Bệnh sinh học
[sửa | sửa mã nguồn]Độc tố tả hoạt động theo cơ chế sau: Thứ nhất, vòng phân tử B của Độc tố tả liên kết với gangliosides GM1 trên bề mặt tế bào đích. Đơn vị nhỏ B cũng có thể liên kết với các tế bào thiếu GM1. Chất độc sau đó rất có thể liên kết với các loại glycans khác gắn vào protein thay vì lipid.[6] Sau khi bị ràng buộc, toàn bộ phức hợp độc tố được tiêu hóa bởi tế bào và chuỗi Độc tố tả A1 (CTA1) được giải phóng bằng cách giảm cầu nối disulfide. Endosome được chuyển đến bộ máy Golgi, nơi mà protein A1 được xác nhận bởi lưới tế bào nội bào của chất chaperon, protein isomerase disulfide. Chuỗi A1 sau đó được mở ra và đưa đến màng tế bào, nơi Ero1 kích hoạt việc giải phóng protein A1 bằng cách oxy hóa phức hợp isomerase protein disulfide.[7] Khi protein A1 di chuyển từ ER vào tế bào chất nhờ kênh Sec61, nó sẽ làm lại và tránh làm ngừng hoạt tính như kết quả của sự có mặt ở khắp mọi nơi.
Các độc tố pertussis (cũng là một protein AB5) sản xuất bởi Bordetella gây ra hành vi tương tự, ngoại trừ ADP-ribosylates đơn vị nhỏ Gαi, làm cho nó không hoạt động và không thể ức chế sản xuất xen kẽ adenylyl của cAMP (dẫn đến sản xuất cấu thành).[8]
Nguồn gốc
[sửa | sửa mã nguồn]Gen chuyển mã độc tố cholera được đưa vào V. cholerae theo cơ chế chuyển gen ngang. Các chủng virut ác tính của V. cholerae mang một biến thể của bacteriophage ôn đới gọi là CTXf hoặc CTXφ Bacteriophage.[9]
Ứng dụng
[sửa | sửa mã nguồn]Bởi vì các đơn vị nhỏ B dường như không độc hại, các nhà nghiên cứu đã tìm thấy một số ứng dụng cho nó trong tế bào và sinh học phân tử. Nó thường được sử dụng như là một dấu vết thần kinh.[10]
Điều trị các tế bào gốc thần kinh bị côn trùng có độc tố cholera gây ra sự thay đổi nội bộ hóa của yếu tố sao chép Hes3 và làm tăng số lượng của chúng.[11]
Các gangliosides GM1 được tìm thấy trong các lipid trên bề mặt tế bào. Các phức hợp đơn vị nhỏ B gắn nhãn huỳnh quang hoặc nhắm mục tiêu tới các kháng thể có thể được sử dụng.
Tham khảo
[sửa | sửa mã nguồn]- ^ . ISBN 0-8385-8529-9.
|title=trống hay bị thiếu (trợ giúp) - ^ . doi:10.1002/elps.201700207. Chú thích journal cần
|journal=(trợ giúp);|title=trống hay bị thiếu (trợ giúp) - ^ De, S. N., Sarkar, J. K., Tribedi, B. P. An experimental study of the action of cholera toxin. J. Pathol. Bacteriol. 63: 707–717, 1951.
- ^ . doi:10.1006/jmbi.1995.0456. Chú thích journal cần
|journal=(trợ giúp);|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp) - ^ . doi:10.1080/09687680410001663267. Chú thích journal cần
|journal=(trợ giúp);|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp) - ^ https://elifesciences.org/content/4/e09545.
|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp) - ^ Tsai, Billy, and Tom A. Rapoport. "Unfolded cholera toxin is transferred to the ER membrane and released from protein disulfide isomerase upon oxidation by Ero1." The Journal of cell biology 159.2 (2002): 207-216.
- ^ Boron, W. F., & Boulpaep, E. L. (2009). Medical physiology: a cellular and molecular approach (2nd ed.). Philadelphia, PA: Saunders/Elsevier.
- ^ . doi:10.1016/S1369-5274(02)00005-X. Chú thích journal cần
|journal=(trợ giúp);|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp) - ^ Pierre-Hervé Luppi. “The Discovery of Cholera-Toxin as a Powerful Neuroanatomical Tool”. Truy cập ngày 23 tháng 3 năm 2011. Đã định rõ hơn một tham số trong
|tác giả 1=và|họ 1=(trợ giúp)Đã định rõ hơn một tham số trong|author=và|last=(trợ giúp); Đã định rõ hơn một tham số trong|author=và|last=(trợ giúp) - ^ . doi:10.1371/journal.pone.0010841. Chú thích journal cần
|journal=(trợ giúp);|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp)
Liên kết ngoài
[sửa | sửa mã nguồn] GIẢM
31%
GIẢM
31%
 GIẢM
13%
GIẢM
13%
 GIẢM
26%
GIẢM
26%
 GIẢM
33%
GIẢM
33%
 GIẢM
25%
GIẢM
25%
 GIẢM
50%
GIẢM
50%



