EF-Tu
| Elongation Factor Thermo Unstable | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
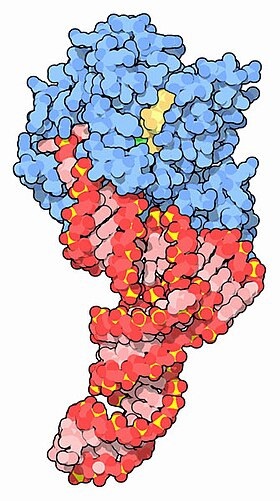
| EF-Tu (xanh) tạo phức với tRNA (đỏ) và GTP (vàng) [1] | |||||||||
| Danh pháp | |||||||||
| Ký hiệu | EF-Tu | ||||||||
| Pfam | GTP_EFTU | ||||||||
| InterPro | IPR004541 | ||||||||
| SCOP | 1ETU | ||||||||
| |||||||||
EF-Tu (elongation factor thermo unstable hay yếu tố kéo dài không bền với nhiệt) là một yếu tố kéo dài ở nhân sơ chịu trách nhiệm xúc tác sự gắn kết của một aminoacyl-tRNA (aa-tRNA) vào ribosome. Nó là một protein G, và tạo điều kiện cho sự lựa chọn và liên kết của aa-tRNA đến vị trí A của ribosome. Như một sự phản ánh vai trò quan trọng của nó trong việc dịch mã, EF-Tu là một trong những protein phổ biến nhất và có tính bảo toàn cao ở các sinh vật nhân sơ.[2][3][4]
Chức năng sinh học
[sửa | sửa mã nguồn]Trong tổng hợp protein
[sửa | sửa mã nguồn]EF-Tu tham gia vào quá trình kéo dài chuỗi polypeptide để tổng hợp protein. Ở nhân sơ, chức năng chính của EF-Tu là vận chuyển aa-tRNA chính xác đến vị trí A của ribosome. Là một protein G, nó sử dụng GTP để tạo điều kiện cho chức năng của mình. Bên ngoài ribosome, EF-Tu tạo phức với GTP (EF-Tu • GTP) và với aa-tRNA để tạo thành một phức hợp bậc ba EF-Tu • GTP • aa-tRNA ổn định.[5] EF-Tu • GTP liên kết tất cả các aa-tRNA với ái lực gần như là giống nhau, ngoại trừ liên kết cho bộ ba mở đầu và amino acid đặc biệt selenocysteine.[6][7] Điều này có thể được thực hiện bởi vì mặc dù phần bên amino acid khác nhau có các chuỗi bên với các tính chất khác nhau, các tRNA kết hợp với các phần bên này cũng có cấu trúc khác nhau để bù đắp cho sự khác biệt trong liên kết với chuỗi bên.[8][9]
Sự gắn kết của aa-tRNA với EF-Tu • GTP cho phép phức hợp bậc ba này được dịch chuyển đến vị trí A của một ribosome hoạt động, trong đó anticodon của tRNA liên kết với codon của mRNA. Nếu anticodon chính xác liên kết với codon mRNA, ribosome thay đổi cấu hình và làm thay đổi cấu hình của miền GTPase của EF-Tu, dẫn đến thủy phân GTP kết hợp với EF-Tu thành GDP và Pi. Như vậy, ribosome hoạt động như một protein kích hoạt GTPase (GAP) cho EF-Tu. Khi thủy phân GTP, cấu tạo của EF-Tu thay đổi mạnh và tách ra khỏi phức hợp aa-tRNA và ribosome.[4][10] Sau đó aa-tRNA hoàn toàn đi vào vị trí A, nơi mà amino acid của nó được đưa đến gần chuỗi polypeptide của vị trí P và ribosome xúc tác sự chuyển liên kết cộng hóa trị của polypeptide đến amino acid.[7]
Trong tế bào chất, các phức EF-Tu • GDP ngừng hoạt động được tác động bởi yếu tố kéo dài nhân sơ khác là EF-Ts, khiến EF-Tu giải phóng liên kết GDP của nó. Khi phân ly EF-Ts, EF-Tu có thể lại tạo phức với GTP do nồng độ GTP cao gấp 5 đến 10 lần so với GDP trong tế bào chất, dẫn đến kích hoạt lại EF-Tu • GTP, sau đó có thể kết hợp với aa-tRNA khác.[6]
Đảm bảo dịch mã chính xác
[sửa | sửa mã nguồn]EF-Tu đóng góp vào độ chính xác của phiên dịch theo ba cách. Trong dịch mã, một vấn đề cơ bản là các anticodon gần-chính xác có ái lực gắn kết tương tự với codon như anticodon chính xác, do đó việc gắn kết codon-anticodon trong ribosome không đủ để duy trì độ chính xác cao. Điều này được giải quyết bởi ribosome sẽ không kích hoạt hoạt động GTPase của EF-Tu nếu tRNA ở miền A trong ribosome không khớp chính xác với codon mRNA, do đó làm tăng khả năng tRNA không chính xác rời khỏi ribosome.[11] Ngoài ra, bất kể kết hợp tRNA, EF-Tu cũng có một khoảng trễ trước khi giải phóng bản thân khỏi aa-tRNA, trước khi aa-tRNA hoàn toàn đi vào miền A (một quá trình được gọi là đặt chỗ). Thời gian trì hoãn này là cơ hội thứ hai cho các aa-tRNA không chính xác di chuyển ra khỏi vị trí A trước khi amino acid không chính xác được bổ sung vào chuỗi polypeptide, amino acid sai này sẽ không thể sửa chữa được..[12][13] Cơ chế thứ ba là chức năng ít được hiểu rõ hơn của EF-Tu. EF-Tu kiểm tra một cách "thô bạo" các phức liên kết aa-tRNA và loại bỏ các phức hợp mà amino acid không gắn vào mã tRNA chính xác cho nó.[8]
Chức năng khác
[sửa | sửa mã nguồn]EF-Tu đã được tìm thấy với số lượng lớn trong các bộ xương tế bào của vi khuẩn, đồng vị trí bên dưới màng tế bào với MreB, một yếu tố tế bào cơ thể duy trì hình dạng tế bào.[14][15] Các khiếm khuyết trong EF-Tu đã được chứng minh là có ảnh hưởng đến hình thái vi khuẩn. Ngoài ra, EF-Tu đã hiển thị một số đặc tính giống như chaperone, với một số bằng chứng thực nghiệm cho thấy rằng nó thúc đẩy sự hồi tính của một số protein biến tính trong ống nghiệm.[16][17] Chú thích
Chú thích
[sửa | sửa mã nguồn]- ^ Bản mẫu:PDB Molecule of the Month
- ^ Weijland A, Harmark K, Cool RH, Anborgh PH, Parmeggiani A (tháng 3 năm 1992). “Elongation factor Tu: a molecular switch in protein biosynthesis”. Molecular Microbiology. 6 (6): 683–8. doi:10.1111/j.1365-2958.1992.tb01516.x. PMID 1573997.
- ^ “TIGR00485: EF-Tu”. National Center for Biotechnology Information. ngày 3 tháng 3 năm 2017.
- ^ a b Yamamoto H, Qin Y, Achenbach J, Li C, Kijek J, Spahn CM, Nierhaus KH (tháng 2 năm 2014). “EF-G and EF4: translocation and back-translocation on the bacterial ribosome”. Nature Reviews. Microbiology. 12 (2): 89–100. doi:10.1038/nrmicro3176. PMID 24362468.
- ^ Krab IM, Parmeggiani A (ngày 1 tháng 1 năm 2002). “Mechanisms of EF-Tu, a pioneer GTPase”. Progress in Nucleic Acid Research and Molecular Biology. 71: 513–51. PMID 12102560.
- ^ a b “Translation elongation factor EFTu/EF1A, bacterial/organelle (IPR004541)”. InterPro.
- ^ a b Diwan, Joyce (2008). “Translation: Protein Synthesis”. Rensselaer Polytechnic Institute. Bản gốc lưu trữ ngày 30 tháng 6 năm 2017.
- ^ a b LaRiviere FJ, Wolfson AD, Uhlenbeck OC (tháng 10 năm 2001). “Uniform binding of aminoacyl-tRNAs to elongation factor Tu by thermodynamic compensation”. Science. 294 (5540): 165–8. doi:10.1126/science.1064242. PMID 11588263.
- ^ Louie A, Ribeiro NS, Reid BR, Jurnak F (tháng 4 năm 1984). “Relative affinities of all Escherichia coli aminoacyl-tRNAs for elongation factor Tu-GTP”. The Journal of Biological Chemistry. 259 (8): 5010–6. PMID 6370998.
- ^ Clark BF, Nyborg J (tháng 2 năm 1997). “The ternary complex of EF-Tu and its role in protein biosynthesis”. Current Opinion in Structural Biology. 7 (1): 110–6. doi:10.1016/s0959-440x(97)80014-0. PMID 9032056.
- ^ Nilsson J, Nissen P (tháng 6 năm 2005). “Elongation factors on the ribosome”. Current Opinion in Structural Biology. 15 (3): 349–54. doi:10.1016/j.sbi.2005.05.004. PMID 15922593.
- ^ Whitford PC, Geggier P, Altman RB, Blanchard SC, Onuchic JN, Sanbonmatsu KY (tháng 6 năm 2010). “Accommodation of aminoacyl-tRNA into the ribosome involves reversible excursions along multiple pathways”. Rna. 16 (6): 1196–204. doi:10.1261/rna.2035410. PMC 2874171. PMID 20427512.
- ^ Noel JK, Whitford PC (tháng 10 năm 2016). “How EF-Tu can contribute to efficient proofreading of aa-tRNA by the ribosome”. Nature Communications. 7: 13314. doi:10.1038/ncomms13314. PMC 5095583. PMID 27796304.
- ^ Defeu Soufo HJ, Reimold C, Linne U, Knust T, Gescher J, Graumann PL (tháng 2 năm 2010). “Bacterial translation elongation factor EF-Tu interacts and colocalizes with actin-like MreB protein”. Proceedings of the National Academy of Sciences of the United States of America. 107 (7): 3163–8. doi:10.1073/pnas.0911979107. PMC 2840354. PMID 20133608.
- ^ Mayer F (ngày 1 tháng 1 năm 2003). “Cytoskeletons in prokaryotes”. Cell Biology International. 27 (5): 429–38. doi:10.1016/s1065-6995(03)00035-0. PMID 12758091.
- ^ Richarme G (tháng 11 năm 1998). “Protein-disulfide isomerase activity of elongation factor EF-Tu”. Biochemical and Biophysical Research Communications. 252 (1): 156–61. doi:10.1006/bbrc.1998.9591. PMID 9813162.
- ^ Kudlicki W, Coffman A, Kramer G, Hardesty B (tháng 12 năm 1997). “Renaturation of rhodanese by translational elongation factor (EF) Tu. Protein refolding by EF-Tu flexing”. The Journal of Biological Chemistry. 272 (51): 32206–10. doi:10.1074/jbc.272.51.32206. PMID 9405422.