Kháng thể đơn dòng
Kháng thể đơn dòng (viết tắt là mAb, theo từ tiếng Anh: monoclonal antibody) là phân tử được sản xuất trong ống nghiệm, có tác dụng như các kháng thể thay thế có thể khôi phục, tăng cường hoặc bắt chước cuộc tấn công của hệ thống miễn dịch đối với các tế bào ung thư hay các loại virus gây bệnh truyền nhiễm.
Kháng thể đơn dòng có ái lực đơn trị, chỉ liên kết với cùng một epitope (phần của kháng nguyên mà kháng thể phát hiện được). Ngược lại, kháng thể đa dòng liên kết với nhiều epitope và thường được tạo ra bởi một số dòng tương bào tiết ra kháng thể khác nhau. Kháng thể đơn dòng đặc hiệu kép là tăng số lượng từ một epitope của kháng thể đơn dòng thành hai epitope.
Kháng thể đơn dòng có khả năng tạo liên kết đặc hiệu với hầu như bất kỳ các chất nào, do đó ứng dụng của kháng thể đơn dòng là phát hiện chất hoặc tinh chế chất đó. Ứng dụng này giúp kháng thể đơn dòng đứng một vị trí quan trọng các công trình nghiên cứu hóa sinh, sinh học phân tử và y học. Kháng thể đơn dòng được sử dụng trong lâm sàng để chẩn đoán và điều trị một số bệnh.[3] Năm 2020, một số quốc gia đã cho phép sử dụng kháng thể đơn dòng để điều trị triệu chứng gây ra do COVID-19.
Lịch sử
[sửa | sửa mã nguồn]Vào đầu những năm 1900, nhà miễn dịch học người Đức Paul Ehrlich đã đề xuất ý tưởng về khái niệm Zauberkugel - "viên đạn ma thuật", được coi là một hợp chất nhắm đích có chọn lọc, chính là chất tác động trực tiếp lên sinh vật gây bệnh và có thể đầu độc sinh vật đó.[4][5][6] Ý tưởng trên củng cố khái niệm về kháng thể đơn dòng và thuốc đơn dòng. Ehrlich và Ilya Ilyich Mechnikov được trao giải Nobel Sinh lý học hoặc Y học năm 1908 vì đã cung cấp cơ sở lý thuyết cho miễn dịch học.[7]
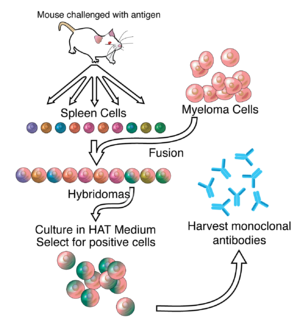
Đến thập niên 1970, lympho bào được phát hiện tạo ra một kháng thể duy nhất trong bệnh cảnh đa u tủy xương (một loại ung thư ảnh hưởng đến tế bào B). Các kháng thể bất thường này được sử dụng để nghiên cứu cấu trúc của các kháng thể, nhưng vẫn chưa thể tạo ra các kháng thể giống hệt nhau đặc hiệu cho một kháng nguyên nhất định.[8]:324 Năm 1973, Jerrold Schwaber mô tả quá trình sản xuất kháng thể đơn dòng sử dụng tế bào lai giữa người và chuột.[9][10] Năm 1975, Georges Köhler và César Milstein thành công trong việc dung hợp dòng tế bào u tủy với tế bào B để tạo ra tế bào lai có khả năng tạo ra các kháng thể, các kháng thể này đặc hiệu với kháng nguyên và tồn tại vĩnh viễn.[11] Nhờ có khám phá này, Georges Köhler, César Milstein và Niels Kaj Jerne cùng được trao giải Nobel về Sinh lý học hoặc Y học năm 1984.[11]
Năm 1988, Gregory Winter và nhóm nghiên cứu đi tiên phong trong các kỹ thuật nhân bản hóa (humanize) các kháng thể đơn dòng,[12] tiến hành loại bỏ các đáp ứng mà nhiều kháng thể đơn dòng gây ra ở một số bệnh nhân. Vào những năm 1990, nghiên cứu đã đạt đến giai đoạn sử dụng kháng thể đơn dòng trong điều trị. Năm 2018, James P. Allison và Tasuku Honjo được trao giải Nobel về Sinh lý học hoặc Y học vì đã khám phá ra liệu pháp điều trị ung thư bằng cách ức chế điều hòa miễn dịch ngược âm tính.[13]
Sản xuất
[sửa | sửa mã nguồn]



Công nghệ phát triển mAb mới
[sửa | sửa mã nguồn]Một số công nghệ kháng thể đơn dòng mới[14] như phương pháp phage display,[6] nuôi cấy tế bào B đơn lẻ,[15] khuếch đại tế bào đơn lẻ từ các quần thể tế bào B khác nhau.[16][17][18][19][20]
Tái tổ hợp
[sửa | sửa mã nguồn]Sản xuất các kháng thể đơn dòng tái tổ hợp cần công nghệ nhân bản vô tính, CRISPR/Cas9 hoặc công nghệ phage display hay yeast display.[21] Kỹ thuật kháng thể tái tổ hợp liên quan đến việc sản xuất kháng thể bằng cách sử dụng đối tượng là virus hoặc nấm men, không phải chuột. Những kỹ thuật này dựa vào việc sao chép nhanh các đoạn gen globulin miễn dịch (Ig) để tạo ra loạt kháng thể có trình tự amino acid hơi khác nhau, từ đó có thể chọn các kháng thể có tính đặc hiệu mong muốn.[22][23] Những kỹ thuật này có thể được sử dụng để nâng cao tính đặc hiệu của kháng thể khi nhận dạng kháng nguyên, tính ổn định trong các điều kiện môi trường khác nhau, hiệu quả điều trị và khả năng phát hiện của háng thể trong các ứng dụng chẩn đoán.[24]
Kháng thể khảm
[sửa | sửa mã nguồn]Mặc dù các kháng thể của chuột và người có cấu trúc tương tự nhau, nhưng sự khác biệt về loài đủ để tạo ra đáp ứng miễn dịch khi tiêm các kháng thể đơn dòng của chuột vào người. Hậu quả, các kháng thể của chuột dễ dàng và nhanh chóng bị loại bỏ khỏi máu, cũng như các tác động đáp ứng viêm hệ thống gây viêm toàn thân và sản xuất kháng thể người chống lại kháng thể chuột (Human anti-mouse antibody, HAMA).
DNA tái tổ hợp được khám phá từ cuối những năm 1980 giúp kéo dài tăng thời gian tồn tại của kháng thể. DNA của chuột mã hóa phần liên kết của kháng thể đơn dòng được hợp nhất với DNA tạo kháng thể của người trong tế bào sống. Sự biểu hiện của DNA "khảm" hay còn gọi là DNA "nhân bản hóa" này thông qua quá trình nuôi cấy tế bào tạo ra các kháng thể nửa chuột, nửa người.[25][26]
Kháng thể người
[sửa | sửa mã nguồn]
Kể từ khi các nhà khoa học phát hiện ra rằng có thể tự tạo ra kháng thể đơn dòng, các nghiên cứu "nhắm đích" được tiến hành để tạo ra sản phẩm hoàn toàn phù hợp cho người để giảm tác dụng phụ của các kháng thể khảm (kháng thể "nhân bản hóa"). Một số phương pháp thành công: chuột biến đổi gen,[27] phương pháp phage display[6] và nhân bản tế bào B đơn lẻ.[14]
Chi phí
[sửa | sửa mã nguồn]Sản xuất các kháng thể đơn dòng đắt hơn so với sản xuất phân tử nhỏ khi sản xuất thuốc do quy trình phức tạp và kích thước các phân tử. Chi phí cao còn do để đưa một thực thể hóa học mới vào cơ thể bệnh nhân (con người)m cần tiến hành vô cùng nhiều nghiên cứu và phát triển các nghiên cứu đó. Kháng thể đơn dòng được định giá để cho phép các nhà sản xuất hoàn vốn đầu tư, do đó giá cả để mua kháng thể đơn dòng rất đắt ở những nơi không có kiểm soát giá (chẳng hạn như Hoa Kỳ). 7 nhà nghiên cứu của Đại học Pittsburgh đã kết luận: "Chi phí hàng năm của các liệu pháp mAb trong điều trị ung thư và huyết học cao hơn khoảng 100.000 đô la so với thuốc điều trị các căn bệnh khác". "Điều trị các căn bệnh khác" được so sánh ở đây là chi phí điều trị tim mạch, bệnh rối loạn chuyển hóa, miễn dịch, bệnh truyền nhiễm, dị ứng và nhãn khoa.[28]
Ứng dụng
[sửa | sửa mã nguồn]Xét nghiệm chẩn đoán
[sửa | sửa mã nguồn]Hóa phân tích
[sửa | sửa mã nguồn]Điều trị
[sửa | sửa mã nguồn]Liệu pháp kháng thể đơn dòng có nhiều cơ chế, chẳng hạn như chẹn các phân tử chức năng gây ra quá trình chết tế bào theo chương trình hoặc điều chỉnh con đường truyền tín hiệu.[29][30]
Điều trị ung thư
[sửa | sửa mã nguồn]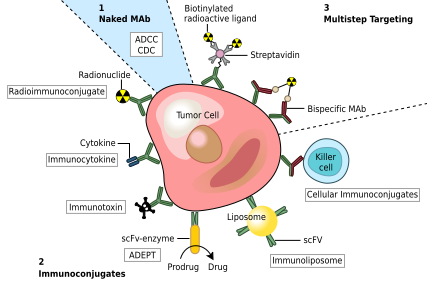
Một số mAb được FDA chấp thuận để điều trị bệnh ung thư gồm:[33]
Bệnh tự miễn
[sửa | sửa mã nguồn]Các kháng thể đơn dòng được sử dụng để điều trị các bệnh tự miễn bao gồm infliximab và adalimumab, có hiệu quả trong điều trị viêm khớp dạng thấp, bệnh Crohn, viêm loét đại tràng và viêm cột sống dính khớp nhờ khả năng liên kết và ức chế TNF-α.[34] Basiliximab và daclizumab ức chế IL-2 trên các tế bào T hoạt hóa và do đó giúp ngăn ngừa thải ghép thận cấp tính.[34] Omalizumab ức chế immunoglobulin E (IgE) ở người và rất hữu ích trong điều trị hen phế quản dị ứng từ trung bình đến nặng.
COVID-19
[sửa | sửa mã nguồn]Năm 2020, liệu pháp kháng thể đơn dòng bamlanivimab/etesevimab và casirivimab/imdevimab được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ cấp phép sử dụng khẩn cấp để giảm số ca nhập viện, số lượng bệnh nhân đến phòng cấp cứu và số ca tử vong.[35][36] Tháng 9 năm 2021, chính quyền Biden đã bơm 2,9 tỷ đô la Mỹ để sản xuất kháng thể đơn dòng Regeneron (2.100 đô la mỗi liều) để hạn chế sự thiếu hụt kháng thể đơn dòng.[37]
Từ tháng 12 năm 2021, các thử nghiệm in vitro (trong ống nghiệm) cho thấy các liệu pháp kháng thể đơn dòng (ngoại trừ sotrovimab và tixagevimab/cilgavimab) không có khả năng hoạt động chống lại biến thể omicron SARS-CoV-2.[38]
Trong giai đoạn 2021–22, tổng quan hệ thống của tổ chứcCochrane kết luận: KHÔNG đủ bằng chứng về việc sử dụng kháng thể đơn dòng trung hòa trong điều trị nhiễm COVID-19.[39][40] Tổng quan hệ thống chỉ áp dụng cho những người chưa được tiêm vắc-xin COVID‐19 và chỉ áp dụng cho các biến thể COVID-19 tồn tại trong quá trình nghiên cứu, không áp dụng cho các biến thể mới hơn, chẳng hạn như biến thể Omicron.[40]
Tác dụng phụ
[sửa | sửa mã nguồn]Một số kháng thể đơn dòng, chẳng hạn như bevacizumab và cetuximab, có thể gây ra các loại tác dụng phụ khác nhau.[41] Những tác dụng phụ này có thể được phân loại thành tác dụng phụ phổ biến và nghiêm trọng.[42]
Một số tác dụng phụ phổ biến bao gồm:
Tác dụng phụ nghiêm trọng:
- Sốc phản vệ
- Xuất huyết
- Huyết khối động-tĩnh mạch
- Viêm tuyến giáp tự miễn
- Suy giáp
- Viêm gan
- Suy tim
- Ung thư
- Thiếu máu
- Giảm bạch cầu
- Nhiệt miệng
- Viêm ruột
- Thủng ruột
- Viêm niêm mạc
Tham khảo
[sửa | sửa mã nguồn]- ^ “Cytochrome P450 Mediated Drug and Carcinogen Metabolism using Monoclonal Antibodies”. home.ccr.cancer.gov. Truy cập ngày 2 tháng 4 năm 2018.
- ^ Gelboin HV, Krausz KW, Gonzalez FJ, Yang TJ (tháng 11 năm 1999). “Inhibitory monoclonal antibodies to human cytochrome P450 enzymes: a new avenue for drug discovery”. Trends in Pharmacological Sciences. 20 (11): 432–438. doi:10.1016/S0165-6147(99)01382-6. PMID 10542439.
- ^ Waldmann, Thomas A. (21 tháng 6 năm 1991). “Monoclonal Antibodies in Diagnosis and Therapy”. Science (bằng tiếng Anh). 252 (5013): 1657–1662. Bibcode:1991Sci...252.1657W. doi:10.1126/science.2047874. PMID 2047874.
- ^ a b Ehrlich, P. (1960), “Experimental Researches on Specific Therapy”, The Collected Papers of Paul Ehrlich (bằng tiếng Anh), Elsevier, tr. 106–117, doi:10.1016/b978-0-08-009056-6.50015-4, ISBN 978-0-08-009056-6 [Reprint of "Experimental Researches on Specific Therapy: On Immunity with special Reference to the Relationship between Distribution and Action of Antigens" from''The Harben Lectures for 1907 of the Royal Institute of Public Health'', London: Lewis, 1908]
- ^ Heynick, F. (2009). “The original 'magic bullet' is 100 years old - extra”. The British Journal of Psychiatry. 195 (5): 456. doi:10.1192/bjp.195.5.456. PMID 19880937.
- ^ a b c Witkop, B. (1999). “Paul Ehrlich and his Magic bullets--revisited”. Proceedings of the American Philosophical Society. 143 (4): 540–557. JSTOR 3181987. PMID 11624364.
- ^ “The Nobel Prize in Physiology or Medicine 1908”. Nobelprize.org. Nobel Media AB. Truy cập ngày 16 tháng 3 năm 2015.
- ^ Tansey EM, Catterall PP (tháng 7 năm 1994). “Monoclonal antibodies: a witness seminar in contemporary medical history”. Medical History. 38 (3): 322–327. doi:10.1017/s0025727300036632. PMC 1036884. PMID 7934322.
- ^ Schwaber J, Cohen EP (tháng 8 năm 1973). “Human x mouse somatic cell hybrid clone secreting immunoglobulins of both parental types”. Nature. 244 (5416): 444–447. doi:10.1038/244444a0. PMID 4200460.
- ^ Cambrosio A, Keating P (1992). “Between fact and technique: the beginnings of hybridoma technology”. Journal of the History of Biology. 25 (2): 175–230. doi:10.1007/BF00162840. PMID 11623041.
- ^ a b Marks, LV. “The Story of César Milstein and Monoclonal Antibodies”. WhatisBiotechnology.org. Truy cập ngày 23 tháng 9 năm 2020.
- ^ Riechmann L, Clark M, Waldmann H, Winter G (tháng 3 năm 1988). “Reshaping human antibodies for therapy”. Nature. 332 (6162): 323–327. Bibcode:1988Natur.332..323R. doi:10.1038/332323a0. PMID 3127726.
- ^ Altmann DM (tháng 11 năm 2018). “A Nobel Prize-worthy pursuit: cancer immunology and harnessing immunity to tumour neoantigens”. Immunology. 155 (3): 283–284. doi:10.1111/imm.13008. PMC 6187215. PMID 30320408.
- ^ a b c Ho M (tháng 6 năm 2018). “Inaugural Editorial: Searching for Magic Bullets”. Antibody Therapeutics. 1 (1): 1–5. doi:10.1093/abt/tby001. PMC 6086361. PMID 30101214.
- ^ Seeber S, Ros F, Thorey I, Tiefenthaler G, Kaluza K, Lifke V, và đồng nghiệp (2014). “A robust high throughput platform to generate functional recombinant monoclonal antibodies using rabbit B cells from peripheral blood”. PLOS ONE. 9 (2): e86184. Bibcode:2014PLoSO...986184S. doi:10.1371/journal.pone.0086184. PMC 3913575. PMID 24503933.
- ^ Wardemann H, Yurasov S, Schaefer A, Young JW, Meffre E, Nussenzweig MC (tháng 9 năm 2003). “Predominant autoantibody production by early human B cell precursors”. Science. 301 (5638): 1374–1377. Bibcode:2003Sci...301.1374W. doi:10.1126/science.1086907. PMID 12920303.
- ^ Koelsch K, Zheng NY, Zhang Q, Duty A, Helms C, Mathias MD, và đồng nghiệp (tháng 6 năm 2007). “Mature B cells class switched to IgD are autoreactive in healthy individuals”. The Journal of Clinical Investigation. 117 (6): 1558–1565. doi:10.1172/JCI27628. PMC 1866247. PMID 17510706.
- ^ Smith K, Garman L, Wrammert J, Zheng NY, Capra JD, Ahmed R, Wilson PC (1 tháng 1 năm 2009). “Rapid generation of fully human monoclonal antibodies specific to a vaccinating antigen”. Nature Protocols. 4 (3): 372–384. doi:10.1038/nprot.2009.3. PMC 2750034. PMID 19247287.
- ^ Duty JA, Szodoray P, Zheng NY, Koelsch KA, Zhang Q, Swiatkowski M, và đồng nghiệp (tháng 1 năm 2009). “Functional anergy in a subpopulation of naive B cells from healthy humans that express autoreactive immunoglobulin receptors”. The Journal of Experimental Medicine. 206 (1): 139–151. doi:10.1084/jem.20080611. PMC 2626668. PMID 19103878.
- ^ Huang J, Doria-Rose NA, Longo NS, Laub L, Lin CL, Turk E, và đồng nghiệp (tháng 10 năm 2013). “Isolation of human monoclonal antibodies from peripheral blood B cells”. Nature Protocols. 8 (10): 1907–1915. doi:10.1038/nprot.2013.117. PMC 4844175. PMID 24030440.
- ^ van der Schoot JM, Fennemann FL, Valente M, Dolen Y, Hagemans IM, Becker AM, và đồng nghiệp (tháng 8 năm 2019). “Functional diversification of hybridoma-produced antibodies by CRISPR/HDR genomic engineering”. Science Advances. 5 (8): eaaw1822. Bibcode:2019SciA....5.1822V. doi:10.1126/sciadv.aaw1822. PMC 6713500. PMID 31489367.
- ^ Siegel DL (tháng 1 năm 2002). “Recombinant monoclonal antibody technology”. Transfusion Clinique et Biologique. 9 (1): 15–22. doi:10.1016/S1246-7820(01)00210-5. PMID 11889896.
- ^ “Dr. George Pieczenik”. LMB Alumni. MRC Laboratory of Molecular Biology (LMB). 17 tháng 9 năm 2009. Bản gốc lưu trữ ngày 23 tháng 12 năm 2012. Truy cập ngày 17 tháng 11 năm 2012.
- ^ Schmitz U, Versmold A, Kaufmann P, Frank HG (2000). “Phage display: a molecular tool for the generation of antibodies – a review”. Placenta. 21 Suppl A (Suppl A): S106–S112. doi:10.1053/plac.1999.0511. PMID 10831134.
- ^ Boulianne GL, Hozumi N, Shulman MJ (1984). “Production of functional chimaeric mouse/human antibody”. Nature. 312 (5995): 643–646. Bibcode:1984Natur.312..643B. doi:10.1038/312643a0. PMID 6095115.
- ^ Chadd HE, Chamow SM (tháng 4 năm 2001). “Therapeutic antibody expression technology”. Current Opinion in Biotechnology. 12 (2): 188–194. doi:10.1016/S0958-1669(00)00198-1. PMID 11287236.
- ^ Lonberg N, Huszar D (1995). “Human antibodies from transgenic mice”. International Reviews of Immunology. 13 (1): 65–93. doi:10.3109/08830189509061738. PMID 7494109.
- ^ Hernandez I, Bott SW, Patel AS, Wolf CG, Hospodar AR, Sampathkumar S, Shrank WH (tháng 2 năm 2018). “Pricing of monoclonal antibody therapies: higher if used for cancer?”. The American Journal of Managed Care. 24 (2): 109–112. PMID 29461857.
- ^ Breedveld FC (tháng 2 năm 2000). “Therapeutic monoclonal antibodies”. Lancet. 355 (9205): 735–740. doi:10.1016/S0140-6736(00)01034-5. PMID 10703815.
- ^ Australian Prescriber (2006). “Monoclonal antibody therapy for non-malignant disease”. Australian Prescriber. 29 (5): 130–133. doi:10.18773/austprescr.2006.079.
- ^ Phùng Thị Thu Hằng (2008). “Cải tiến hiệu quả điều trị ung thư sử dụng kháng thể” (PDF). Tạp chí Công nghệ sinh học. 6: 265–285.
- ^ Modified from Carter P (tháng 11 năm 2001). “Improving the efficacy of antibody-based cancer therapies”. Nature Reviews. Cancer. 1 (2): 118–129. doi:10.1038/35101072. PMID 11905803.
- ^ Takimoto CH, Calvo E. (1 January 2005) "Principles of Oncologic Pharmacotherapy" Lưu trữ 2017-07-22 tại Wayback Machine in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Cancer Management Lưu trữ 4 tháng 10 năm 2013 tại Wayback Machine
- ^ a b Rang HP (2003). Pharmacology. Edinburgh: Churchill Livingstone. tr. 241, for the examples infliximab, basiliximab, abciximab, daclizumab, palivusamab, gemtuzumab, alemtuzumab and rituximab, and mechanism and mode. ISBN 978-0443071454.
- ^ “Coronavirus (COVID-19) Update: FDA Authorizes Monoclonal Antibodies for Treatment of COVID-19”. U.S. Food and Drug Administration (FDA) (Thông cáo báo chí). 21 tháng 11 năm 2020. Truy cập ngày 21 tháng 11 năm 2020.
 Bài viết này tích hợp văn bản từ nguồn này, vốn thuộc phạm vi công cộng.
Bài viết này tích hợp văn bản từ nguồn này, vốn thuộc phạm vi công cộng.
- ^ “FDA Authorizes Monoclonal Antibodies for Treatment of COVID-19”. U.S. Food and Drug Administration (FDA) (Thông cáo báo chí). 9 tháng 2 năm 2021. Truy cập ngày 10 tháng 2 năm 2021.
 Bài viết này tích hợp văn bản từ nguồn này, vốn thuộc phạm vi công cộng.
Bài viết này tích hợp văn bản từ nguồn này, vốn thuộc phạm vi công cộng.
- ^ Bernstein, Lenny (14 tháng 9 năm 2021). “Biden administration moves to stave off shortages of monoclonal antibodies”. The Washington Post. ISSN 0190-8286. Truy cập ngày 21 tháng 12 năm 2021.
- ^ Kozlov, Max (tháng 12 năm 2021). “Omicron overpowers key COVID antibody treatments in early tests”. Nature. doi:10.1038/d41586-021-03829-0. PMID 34937889.
- ^ Kreuzberger, Nina; Hirsch, Caroline; Chai, Khai Li; và đồng nghiệp (2 tháng 9 năm 2021). “SARS-CoV-2-neutralising monoclonal antibodies for treatment of COVID-19”. The Cochrane Database of Systematic Reviews. 2021 (9): CD013825. doi:10.1002/14651858.cd013825.pub2. ISSN 1465-1858. PMC 8411904. PMID 34473343.
- ^ a b Hirsch, Caroline; Park, Yun Soo; Piechotta, Vanessa; và đồng nghiệp (17 tháng 6 năm 2022). “SARS-CoV-2-neutralising monoclonal antibodies to prevent COVID-19”. The Cochrane Database of Systematic Reviews. 2022 (6): CD014945. doi:10.1002/14651858.cd014945.pub2. ISSN 1465-1858. PMC 9205158. PMID 35713300.
- ^ “Monoclonal antibodies to treat cancer | American Cancer Society”. www.cancer.org. Truy cập ngày 19 tháng 4 năm 2018.
- ^ “Monoclonal antibody drugs for cancer: How they work”. Mayo Clinic. Truy cập ngày 19 tháng 4 năm 2018.
 GIẢM
11%
GIẢM
11%
![[Review sách] Cân bằng cảm xúc cả lúc bão giông](https://down-spe-vn.img.susercontent.com/3d596d5e3b0931abe3992652454f58a7.webp) GIẢM
25%
GIẢM
25%
 GIẢM
38%
GIẢM
38%
 GIẢM
25%
GIẢM
25%
![[Review sách] Những giấc mơ ở hiệu sách Morisaki - Chốn bình yên gắn kết tâm hồn đồng điệu](https://down-tx-vn.img.susercontent.com/edd27e656c28712031d4105f97d6d801.webp)




