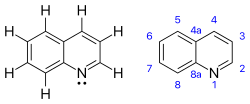
Quinolin
| |||
| |||
| Names | |||
|---|---|---|---|
| Preferred IUPAC name
Quinoline[2] | |||
Systematic IUPAC name
| |||
Other names
| |||
| Identifiers | |||
3D model (JSmol)
|
|||
| 3DMet | B00959 Lưu trữ 2012-10-11 tại Wayback Machine | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.001.865 | ||
| EC Number | 202-051-6 | ||
| KEGG | |||
| MeSH | Quinolines | ||
PubChem <abbr title="<nowiki>Compound ID</nowiki>">CID
|
|||
| RTECS number | VA9275000 | ||
| UNII |
| ||
| UN number | 2656 | ||
CompTox Dashboard (<abbr title="<nowiki>U.S. Environmental Protection Agency</nowiki>">EPA)
|
|||
| |||
| |||
| Properties | |||
| C9H7N | |||
| Molar mass | 129.16 g/mol | ||
| Appearance | yellowish oily liquid | ||
| Density | 1.093 g/mL | ||
| Melting point | −15 °C (5 °F; 258 K) | ||
| Boiling point | 237 °C (459 °F; 510 K) /760 mm Hg, 108 to 110 °C/11 mm Hg | ||
| Slightly soluble | |||
| Solubility | Hòa tan trong alcohol, ether, and carbon disulfide | ||
| Acidity (pKa) | 4.85 (conjugated acid)[3] | ||
| -86.0·10−6 cm³/mol | |||
| Thermochemistry | |||
Std enthalpy of
formation (ΔfH⦵298) |
174.9 kJ mol−1 | ||
| Hazards | |||
| R-phrases (outdated) | R21, R22 | ||
| S-phrases (outdated) | S26, S27, S28, S29, S30, Template:S31, Template:S32, S33, Template:S34, S35, S36 | ||
| NFPA 704 | |||
| Flash point | 101 °C (214 °F; 374 K) | ||
Autoignition<br><br>temperature
|
400 °C (752 °F; 673 K) | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (median dose)
|
331 mg/kg | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
| Infobox<span typeof="mw:Entity"> </span>references | |||
Quinoline là một hợp chất hữu cơ thơm dị vòng có công thức hóa học C9H7N. Nó là một chất lỏng hút ẩm không màu với mùi mạnh. Các mẫu tuổi, đặc biệt là nếu tiếp xúc với ánh sáng, trở thành màu vàng và sau đó là màu nâu. Quinoline chỉ tan ít trong nước lạnh nhưng dễ hòa tan trong nước nóng và hầu hết các dung môi hữu cơ.[4] Bản thân Quinoline có ít ứng dụng, nhưng nhiều dẫn xuất của nó rất hữu ích trong các ứng dụng đa dạng. Một ví dụ nổi bật là quinine, một loại chất kiềm được tìm thấy trong thực vật. 4-hydroxy-2-alkylquinolines (HAQs) có liên quan đến kháng kháng sinh.
Xảy ra và cô lập
[sửa | sửa mã nguồn]Quinoline lần đầu tiên được chiết xuất từ nhựa than đá vào năm 1834 bởi nhà hóa học người Đức Friedlieb Ferdinand Runge;[4] ông gọi quinoline leukol ("dầu trắng" trong tiếng Hy Lạp).[5] Than đá vẫn là nguồn chính của quinoline thương mại.[6] Năm 1842, nhà hóa học người Pháp Charles Gerhardt thu được một hợp chất bằng cách chưng cất khô quinine, strychnine hoặc cinchonine với kali hydroxide;[4] ông gọi hợp chất Chinoilin hoặc Chinolein.[7] Các hợp chất của Runge và Gephardt dường như là các đồng phân riêng biệt vì chúng phản ứng khác nhau. Tuy nhiên, nhà hóa học người Đức August Hoffmann cuối cùng đã nhận ra rằng sự khác biệt trong hành vi là do sự hiện diện của chất gây ô nhiễm và hai hợp chất này thực sự giống hệt nhau.[8]
Giống như các hợp chất dị vòng nitơ khác, chẳng hạn như các dẫn xuất pyridine, quinoline thường được báo cáo là chất gây ô nhiễm môi trường liên quan đến các cơ sở chế biến đá phiến dầu hoặc than đá, và cũng đã được tìm thấy tại các khu xử lý gỗ cũ. Do khả năng hòa tan tương đối cao trong quinoline nước có tiềm năng di chuyển đáng kể trong môi trường, có thể thúc đẩy ô nhiễm nước. Quinoline dễ bị phân hủy bởi một số vi sinh vật, chẳng hạn như loài Rhodococcus Strain Q1, được phân lập từ bùn và đất của nhà máy giấy.[9]
Quinolines có mặt với một lượng nhỏ trong dầu thô trong phần diesel nguyên chất. Nó có thể được loại bỏ bởi quá trình gọi là hydrodenitrifization.
Tổng hợp
[sửa | sửa mã nguồn]Quinoline thường được tổng hợp từ các anilin đơn giản sử dụng một số phản ứng được đặt tên.
Đi theo chiều kim đồng hồ từ trên cùng là:
- Kết hợp tổng hợp quinoline bằng cách sử dụng anilin và k-di ketone.
- Tổng hợp Conrad-Limpach bằng cách sử dụng anilin và-ketoesters.
- Phản ứng Doebner sử dụng anilin với axit aldehyd và pyruvic để tạo thành axit quinoline-4-carboxylic
- Phản ứng Doebner-Miller sử dụng anilin và các hợp chất cacbonyl,-không bão hòa.
- Phản ứng Gould-Jacobs bắt đầu từ anilin và ethyl ethoxymethylenemalonate
- Tổng hợp Skraup bằng cách sử dụng sắt sulfat, glycerol, anilin, nitrobenzene và axit sulfuric.
Một số các quá trình khác tồn tại, đòi hỏi các anilin được thay thế cụ thể hoặc các hợp chất liên quan:
- Tổng hợp quinoline Camps sử dụng o-acylaminoacetophenone và hydroxide
- Tổng hợp Friedländer sử dụng 2-aminobenzaldehyd và acetaldehyd
- Tổng hợp quinoline Knorr, sử dụng-ketoanilide và axit sulfuric
- Tổng hợp quinoline Niementowski, sử dụng axit anthranilic và ketone
- Phản ứng Pfitzinger sử dụng isatin với base và hợp chất cacbonyl để tạo ra axit quinoline-4-carboxylic thay thế
- Phản ứng Povarov sử dụng anilin, benzen và anken hoạt hóa
Các ứng dụng
[sửa | sửa mã nguồn]Quinoline được sử dụng trong sản xuất thuốc nhuộm, điều chế hydroxyquinoline sulfate và niacin. Nó cũng được sử dụng làm dung môi cho nhựa và terpen.
Quinoline chủ yếu được sử dụng như trong sản xuất các hóa chất đặc biệt khác. Khoảng 4 tấn được sản xuất hàng năm theo một báo cáo được công bố năm 2005.[6] Công dụng chính của nó là tiền chất của 8-hydroxyquinoline, một chất chelating linh hoạt và tiền chất của thuốc trừ sâu. Các dẫn xuất 2- và 4-methyl của nó là tiền chất của thuốc nhuộm cyanine. Oxy hóa quinoline tạo ra axit quinolinic (axit pyridine-2,3-dicarboxylic), tiền chất của thuốc diệt cỏ được bán dưới tên "Khẳng định".[6]
Việc giảm quinoline với natri borohydride với sự hiện diện của axit axetic được biết là tạo ra Kairoline A.[10] (Cf Kairine)
Quinoline có một số dẫn xuất chống sốt rét, bao gồm quinine, chloroquine, amodiaquine và primaquine.
Xem thêm
[sửa | sửa mã nguồn]- Vòng thơm đơn giản liên quan
- Isoquinoline, một chất tương tự với nguyên tử nitơ ở vị trí 2
- Pyridine, một chất tương tự không có vòng benzen nung chảy
- Naphthalene, một chất tương tự với carbon thay vì nitơ
- Indole, một chất tương tự chỉ có vòng nitơ năm thành viên
- Pyrroloquinoline quinone (PQQ), một đồng yếu tố oxy hóa khử và bổ sung dinh dưỡng gây tranh cãi
Tham khảo
[sửa | sửa mã nguồn]- ^ "QUINOLINE (BENZOPYRIDINE)". Chemicalland21.com. Truy cập 2012-06-14.
- ^ Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. 4, 211. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The name ‘quinoline’ is a retained name that is preferred to the alternative systematic fusion names ‘1-benzopyridine’ or ‘benzo[b]pyridine’.
- ^ Brown, H.C., et al., in Baude, E.A. and Nachod, F.C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- ^ a b c Chisholm, Hugh biên tập (1911). . Encyclopædia Britannica. 22 (ấn bản thứ 11). Cambridge University Press. tr. 759.
- ^ F. F. Runge (1834) "Ueber einige Produkte der Steinkohlendestillation" (On some products of coal distillation), Annalen der Physik und Chemie, 31 (5): 65–78; see especially p. 68: "3. Leukol oder Weissöl" (3. White oil [in Greek] or white oil [in German]). From p. 68: "Diese dritte Basis habe ich Leukol oder Weissöl genannt, weil sie keine farbigen Reactionen zeigt." (This third base I've named leukol or white oil because it shows no color reactions.)
- ^ a b c Gerd Collin; Hartmut Höke. “Quinoline and Isoquinoline”. Bách khoa toàn thư Ullmann về Hóa chất công nghiệp. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_465. ISBN 978-3-527-30673-2. Lỗi chú thích: Thẻ
<ref>không hợp lệ: tên “Hoke” được định rõ nhiều lần, mỗi lần có nội dung khác - ^ Gerhardt, Ch. (1842) "Untersuchungen über die organischen Basen" (Investigations of organic bases), Annalen der Chemie und Pharmacie, 42: 310-313. See also: (Editor) (1842) "Chinolein oder Chinoilin" (Quinoline or quinoilin), Annalen der Chemie und Pharmacie, 44: 279-280.
- ^ Initially, Hoffmann thought that Runge's Leukol and Gerhardt's Chinolein were distinct. (See: Hoffmann, August Wilhelm (1843) "Chemische Untersuchungen der organischen Basen im Steinkohlen-Theeröl" (Chemical investigations of organic bases in coal tar oil), Annalen der Chemie und Pharmacie, 47: 37-87; see especially pp. 76-78.) However, after further purification of his Leukol sample, Hoffmann determined that the two were indeed identical. (See: (Editor) (1845) "Vorläufige Notiz über die Identität des Leukols und Chinolins" (Preliminary notice of the identity of leukol and quinoline), Annalen der Chemie und Pharmacie, 53: 427-428.)
- ^ O'Loughlin, Edward J.; Kehrmeyer, Staci R.; Sims, Gerald K. (1996). “Isolation, characterization, and substrate utilization of a quinoline-degrading bacterium”. International Biodeterioration & Biodegradation. 38 (2): 107. doi:10.1016/S0964-8305(96)00032-7.
- ^ GRIBBLE, Gordon W.; HEALD, Peter W. (1975). “Reactions of Sodium Borohydride in Acidic Media; III. Reduction and Alkylation of Quinoline and Isoquinoline with Carboxylic Acids”. Synthesis. 1975 (10): 650–652. doi:10.1055/s-1975-23871. ISSN 0039-7881.
Liên kết ngoài
[sửa | sửa mã nguồn] GIẢM
42%
GIẢM
42%
 GIẢM
0%
GIẢM
0%
![[Review sách] Xá lợi toàn thân - Bài Pháp Vô Ngôn](https://down-bs-vn.img.susercontent.com/sg-11134201-7rble-lluxxe4d8mzd69.webp) GIẢM
20%
GIẢM
20%
 GIẢM
22%
GIẢM
22%
 GIẢM
19%
GIẢM
19%




![[Xiao] Tứ Kiếp - Genshin Impact](https://i.ytimg.com/vi/lNCvBV9HplM/maxresdefault.jpg)


