Allylestrenol
 | |
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Gestanin, Gestanon, Perselin, Turinal, others |
| Đồng nghĩa | Allyloestrenol; SC-6393; Org AL-25; 3-Deketo-17α-allyl-19-nortestosterone; 17α-Allylestr-4-en-17β-ol; 17α-(Prop-2-en-1-yl)estr-4-en-17β-ol |
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | By mouth |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Liên kết protein huyết tương | "Considerable"[1][2] (and low affinity for SHBG)[4] |
| Chuyển hóa dược phẩm | Gan (reduction, hydroxylation, conjugation; CYP3A4)[1][2][3] |
| Chất chuyển hóa | • 17α-Allyl-19-NT[1][2][4] |
| Chu kỳ bán rã sinh học | "Several hours" or 10 hours[1][2][5] |
| Bài tiết | Urine (as conjugates)[1][2] |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| ECHA InfoCard | 100.006.440 |
| Dữ liệu hóa lý | |
| Công thức hóa học | C21H32O |
| Khối lượng phân tử | 300.486 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
Allylestrenol, được bán dưới tên thương hiệu Gestanin và Turinal, là một loại thuốc proestin được sử dụng để điều trị sẩy thai tái phát và dọa sảy thai và ngăn ngừa chuyển dạ sớm ở phụ nữ mang thai.[6][7][8] Tuy nhiên, ngoại trừ trong trường hợp thiếu progesterone đã được chứng minh, việc sử dụng nó cho các mục đích như vậy không còn được khuyến khích. Nó cũng được sử dụng ở Nhật Bản để điều trị tăng sản tuyến tiền liệt lành tính (BPH) ở nam giới.[9][10][11] Thuốc được sử dụng một mình và không được điều chế kết hợp với estrogen.[12] Nó được dùng bằng đường uống.[13]
Tác dụng phụ của allylestrenol rất ít và chưa được xác định rõ, nhưng được cho là tương tự như các thuốc liên quan.[14] Allylestrenol là một progestin, hoặc một tổng hợp progestogen, và do đó là một chất chủ vận của thụ thể progesterone, các đích sinh học của progestogen như progesterone.[15] Nó không có hoạt động nội tiết tố quan trọng khác.[4][16] Thuốc là một tiền chất của 17α-allyl-19-nortestosterone (3-ketoallylestrenol) trong cơ thể.[17][18]
Allylestrenol được mô tả lần đầu tiên vào năm 1958 và được giới thiệu sử dụng trong y tế vào năm 1961.[19][20][21][22] Nó đã được bán trên thị trường rộng rãi trên toàn thế giới trong quá khứ, nhưng ngày nay tính khả dụng và sử dụng của nó tương đối hạn chế.[6][23][24][25] Nó vẫn có sẵn ở một số nước châu Âu và một số nước châu Á.
Sử dụng trong y tế
[sửa | sửa mã nguồn]Allylestrenol được sử dụng trong điều trị sẩy thai tái phát và dọa sảy thai và để ngăn ngừa chuyển dạ sớm.[6][7] Tuy nhiên, ngoại trừ trong trường hợp thiếu progesterone đã được chứng minh, việc sử dụng nó cho các chỉ định như vậy không còn được khuyến khích. Allylestrenol là một trong số ít các proestogen thường được sử dụng cho các mục đích như vậy, những loại khác bao gồm progesterone, hydroxyprogesterone caproate và dydrogesterone.[26] Thuốc cũng đã được nghiên cứu trong điều trị các rối loạn phụ khoa như vô kinh, kinh nguyệt không đều và hội chứng tiền kinh nguyệt.[14] Không giống như các proestin khác, allylestrenol không được sử dụng trong biện pháp tránh thai nội tiết tố hoặc trong liệu pháp hormone mãn kinh. Trong một nghiên cứu, nó đã được tìm thấy là không đủ để chuyển đổi nội mạc tử cung ở phụ nữ kết hợp với estradiol valerate.[27] Mặt khác, allylestrenol đã được tìm thấy có hiệu quả trong việc điều trị các cơn bốc hỏa ở phụ nữ sau mãn kinh.[28]
Allylestrenol đã được sử dụng phổ biến ở Nhật Bản với liều lượng cao, thường là 50 mg/ngày nhưng lên tới 100 mg/ngày, để điều trị HA ở nam giới.[9][10][11][29][30][31][32][33][34][35][36][37][38][39][40][41][41][42][42][43][44] Các loại thuốc liên quan đã được sử dụng tương tự để điều trị BPH, đặc biệt là ở Nhật Bản, bao gồm chlormadinone axetat, gestonorone caproate và oxendolone. Allylestrenol cũng đã được nghiên cứu trong điều trị ung thư tuyến tiền liệt ở Nhật Bản.[45] Thuốc đã được nghiên cứu như là một thuốc chặn tuổi dậy thì trong điều trị dậy thì sớm.[46]
Các hình thức có sẵn
[sửa | sửa mã nguồn]Allylestrenol có sẵn ở dạng viên nén uống5 mg.[12][47][48] Nó thường được sử dụng với liều lượng từ 5 đến 40 mg/ngày. Ở Nhật Bản, 25 mg allylestrenol dạng viên uống, dưới tên thương hiệu Perselin, được bán trên thị trường để điều trị BPH.[38]
Tác dụng phụ
[sửa | sửa mã nguồn]Tác dụng phụ của allylestrenol rất ít và chưa được xác định rõ, nhưng được cho là tương tự như các thuốc liên quan (ví dụ, các proestin khác).[14] Khi được sử dụng với liều lượng cao trong điều trị HA ở nam giới, allylestrenol có thể gây ra các triệu chứng của suy sinh dục và rối loạn chức năng tình dục.[32][35][36] Thuốc indeloxazine có thể chống lại rối loạn chức năng tình dục liên quan đến allylestrenol.[40] Allylestrenol không có androgenic hoặc tác dụng phụ nội tiết tố ngoài mục tiêu khác.[4][16]
Dược lý
[sửa | sửa mã nguồn]Dược lực học
[sửa | sửa mã nguồn]
Hoạt động tiên sinh và ngoài mục tiêu
[sửa | sửa mã nguồn]Allylestrenol là một progestogen, hoặc một chất chủ vận của thụ thể progesterone (PR).[15] Nó thiếu nhóm keto ở vị trí C3 (một phần của cấu trúc 3-keto-4-ene quan trọng) thường gặp trong proestogen và được coi là cần thiết cho hoạt động, và liên quan đến điều này, được cho là một tiền chất 17α-allyl-19-nortestosterone (3-ketoallylestrenol).[17][18][49] Allylestrenol là một proestogen ít mạnh hơn nhiều so với nhiều dẫn xuất 19-nortestosterone khác. Liều lượng rụng trứng hiệu quả - kích thích hoặc tránh thai của allylestrenol ở phụ nữ đã được nghiên cứu, mặc dù hạn chế.[50] Ở tuổi 20 mg/ngày allylestrenol, rụng trứng xảy ra ở 50% của 6 chu kỳ, và ở 25 mg/ngày, rụng trứng xảy ra ở 0% của 3 chu kỳ.[51] Tổng liều chuyển hóa nội mạc tử cung của allylestrenol ở phụ nữ trong suốt chu kỳ là 150 đến 250 mg.[52] Không giống như hầu hết các dẫn xuất 19-nortestosterone khác, allylestrenol được báo cáo là một proestogen tinh khiết và do đó không có hoạt tính androgenic, estrogen và glucocorticoid.[4][16] Như vậy, nó dường như có các tính chất tương tự như progesterone tự nhiên.
Các hồ sơ liên kết và hoạt động của allylestrenol và chất chuyển hóa hoạt động chính của nó tại các thụ thể hoóc môn steroid và các protein liên quan đã được nghiên cứu.[4][17] Allylestrenol có ít hơn 0,2% ái lực của ORG-2058 và dưới 2% ái lực của progesterone đối với PR. Tương tự, nó có ít hơn 0,2% ái lực của testosterone đối với thụ thể androgen (AR), dưới 0,2% ái lực của estradiol đối với thụ thể estrogen (ER), ít hơn 0,2% ái lực của dexamethasone đối với glucocorticoid thụ thể (GR) và 0,9% ái lực của testosterone đối với globulin gắn với hormone giới tính (SHBG). Ngược lại, chất chuyển hóa 17α-allyl-19-nortestosterone của nó có 24% ái lực của ORG-2058 và 186% ái lực của progesterone đối với PR, 4,5% ái lực của testosterone đối với AR, 9,8% ái lực với AR dexamethasone cho GR và 2,8% ái lực của testosterone đối với SHBG, trong khi đó tương tự có ít hơn 0,2% ái lực của estradiol đối với ER. Ái lực của 17α-allyl-19-nortestosterone đối với AR thấp hơn so với norethisterone và medroxyprogesterone axetat và ái lực của nó với SHBG thấp hơn nhiều so với norethisterone. Những phát hiện này có thể giúp giải thích sự vắng mặt của tác dụng gây quái thai của allylestrenol trên cơ quan sinh dục ngoài của thai nhi chuột đực và chuột đực.
| Hợp chất | PR | AR | ER | GR | MR | SHBG | CBG |
|---|---|---|---|---|---|---|---|
| Allylestrenol | 0 | 0 | 0 | 0 | ? | 1 | ? |
| 17α-Allyl-19-NT | 186 | 5 | 0 | 10 | ? | 3 | ? |
| Ghi chú: Giá trị là tỷ lệ phần trăm (%). Các phối tử tham chiếu (100%) là P4 cho PR, T cho AR, E2 cho ER, DEXA cho GR, aldosterone cho MR, T cho SHBG và cortisol cho CBG. Nguồn: [4] | |||||||
Tác dụng kháng gonadotropic
[sửa | sửa mã nguồn]
Tương tự như các proestogen khác, allylestrenol có tác dụng kháng gonadotropic mạnh. Nó có thể làm giảm đáng kể nồng độ lưu hành của hormone luteinizing, testosterone và dihydrotestosterone ở nam giới.[33][35][40][41] Với liều 50 mg/ngày, allylestrenol đã được tìm thấy để ức chế nồng độ testosterone lưu hành tới 78% ở nam giới mắc bệnh HA. Đây là khoảng tối đa mà proestogen được biết là có thể ức chế nồng độ testosterone ở nam giới.[53][54][55] Theo đó, việc giảm nồng độ hormone testosterone và luteinizing với allylestrenol ở nam giới đã được tìm thấy trong một nghiên cứu tương đương với chlormadinone axetat và oxendolone.[34] Tuy nhiên, một nghiên cứu khác cho thấy mức giảm testosterone thấp hơn đáng kể với 50 mg/ngày allylestrenol so với 50 mg/ngày chlormadinone acetate tương ứng khoảng 49 Biến52% so với 76 Lần 85%. Nghiên cứu trên động vật cho thấy allylestrenol tạo ra tác dụng có lợi của nó trong BPH thông qua các tác dụng chống tăng huyết áp và do đó ức chế nồng độ androgen và ức chế sự phát triển của tuyến tiền liệt, tương tự như các proestin khác.[56] Một số nghiên cứu đã phát hiện ra rằng allylestrenol ít hiệu quả đối với HA hơn so với chlormadinone acetate nhưng cũng tạo ra ít tác dụng phụ và rối loạn chức năng tình dục.[32][36] Liệu pháp allylestrenol cho BPH có liên quan đến việc giảm đáng kể nồng độ kháng nguyên dành riêng cho tuyến tiền liệt, có thể che giấu sự phát hiện ung thư tuyến tiền liệt.[44]
Các hoạt động khác
[sửa | sửa mã nguồn]Allylestrenol không phải là chất ức chế 5α-reductase đáng kể.[56] Trong một nghiên cứu, nó cho thấy khoảng 80.000 lần thấp hơn tiềm năng cho sự ức chế của 5α-reductase in vitro so với thành lập 5α-reductase inhibitor epristeride (IC50 = 11,3 nM cho epristeride và 890 Tổ hợp cho allylestrenol). Trong một nghiên cứu khác, đã ức chế 70% 5α-reductase bởi allylestrenol ở nồng độ 60 µM. Sự khác biệt này có thể là do các điều kiện thí nghiệm khác nhau, nhưng vẫn thấp hơn nhiều so với epristeride.
Dược động học
[sửa | sửa mã nguồn]Sau khi uống, nồng độ allylestrenol cao nhất đạt được sau 2 đến 4 giờ [1] Thuốc cho thấy liên kết protein huyết tương đáng kể. Nó có ái lực tương đối thấp đối với SHBG, thấp hơn nhiều so với norethisterone.[4] Allylestrenol được chuyển hóa ở gan, thông qua giảm, hydroxyl hóa và liên hợp. Nó được biết đến là một chất nền của CYP3A4. Nó được cho là một tiền chất của 17α-allyl-19-nortestosterone (3-ketoallylestrenol), theo đó, là một chất chuyển hóa hoạt động được biết đến của allylestrenol.[17][18] Thời gian bán hủy sinh học của allylestrenol đã được báo cáo là "vài giờ" hoặc, có lẽ ở dạng hoạt động của nó, khoảng 10 giờ [5] Trong máu, allylestrenol không thay đổi chiếm 15 đến 40% phóng xạ, một chất chuyển hóa không liên hợp chiếm 4 đến 10% phóng xạ và phần còn lại của phóng xạ tương ứng với các chất chuyển hóa liên hợp. Allylestrenol được đào thải chủ yếu qua nước tiểu, 44% 24 giờ và 67% trong vòng 4 ngày Nó được bài tiết gần như hoàn toàn dưới dạng liên hợp, với 75% trong số này là liên hợp sulfat và 24% là liên hợp glucuronide.
Hóa học
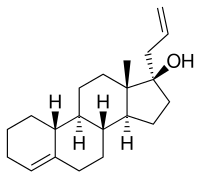
[sửa | sửa mã nguồn]Allylestrenol, còn được gọi là 3-deketo-17α-allyl-19-nortestosterone hoặc 17α-allylestr-4-en-17β-ol, là một steroid estrane tổng hợp và là một dẫn xuất của testosterone.[57] Nó là thành viên của phân nhóm estrane thuộc họ proestin 19-nortestosterone,[58] nhưng không giống như hầu hết các proestin 19-nortestosterone khác, không phải là dẫn xuất của norethisterone (17α-ethynyl-19-nortestosterone).[4][18][59] Điều này là do nó sở hữu một nhóm allyl ở vị trí C17α chứ không phải nhóm ethynyl thông thường. Như vậy, cùng với altrenogest (17α-allyl-19-nor-δ 9,11 -testosterone), allylestrenol là một dẫn xuất của 17α-allyltestosterone chứ không phải là 17α-ethynyltestosterone.
Allylestrenol cũng là duy nhất trong số hầu hết các proestin 19-nortestosterone ở chỗ nó thiếu ketone ở vị trí C3.[57] Nó chia sẻ tài sản này với lynestrenol (17α-ethynylestr-4-en-17β-ol), desogestrel (11-methylene-17α-ethynyl-18-methylestr-4-en-17β-ol) và steroid đồng hóa (androgenic) AAS) ethylestrenol (17α-ethylestr-4-en-17β-ol). Allylestrenol là allyl C17α và C3 deketo phái sinh của AAS nandrolone (19-nortestosterone), cũng như allyl C17α và C3 deketo tương tự của AAS normethandrone (17α-methyl-19-nortestosterone) và norethandrolone (17α-methyl-19 -nortestosterone).
Tổng hợp
[sửa | sửa mã nguồn]Tổng hợp hóa học của allylestrenol đã được công bố.[19][57][60][61][62]
Lịch sử
[sửa | sửa mã nguồn]Allylestrenol được cấp bằng sáng chế vào năm 1958 [19] và đã được bán trên thị trường cho mục đích y tế từ năm 1961.[20][21][22] Nó được phát triển bởi Phòng thí nghiệm Organon.
Xã hội và văn hoá
[sửa | sửa mã nguồn]Tên gốc
[sửa | sửa mã nguồn]Allylestrenol là tên gốc của thuốc và INN, BAN và JAN, trong khi allylestrénol là DCF của nó và allilestrenolo là DCIT của nó.[24][25][57][63] BAN ban đầu là allyloestrenol, nhưng cuối cùng nó đã được thay đổi. Thuốc cũng được biết đến với tên mã phát triển SC-6393.
Tên thương hiệu
[sửa | sửa mã nguồn]Các tên thương hiệu chính của allylestrenol bao gồm Gestanin, Gestanon, Perselin và Turinal.[6][19][23][24][25] Nó cũng đã được bán trên thị trường dưới một loạt các tên thương hiệu khác, bao gồm Alese, Alilestrenol, Allynol, Allytry, Alynol, Anin, Arandal, Astanol, Cobarenol, Crestanon, Elmolan, Fetugard, Foegard, Fulterm, Gestan, Gest G3in Premaston, Prenolin, Prestrenol, Profar, Proeston, Protanon và Shegest.
Khả dụng
[sửa | sửa mã nguồn]
Allylestrenol đã được bán trên thị trường rộng rãi trên toàn thế giới, bao gồm ở Châu Âu, Nam, Đông và Đông Nam Á, Châu Phi, Châu Đại Dương và Châu Mỹ Latinh.[6][23][24][25] Tuy nhiên, mặc dù nó đã được bán rộng rãi trong quá khứ, nhưng sự sẵn có của allylestrenol tương đối hạn chế ngày nay. Nó dường như vẫn có sẵn ở Bangladesh, Cộng hòa Séc, Ai Cập, Hồng Kông, Ấn Độ, Indonesia, Nhật Bản, Litva, Malaysia, Philippines, Nga, Singapore và Đài Loan. Trước đây, allylestrenol cũng đã có sẵn ở Úc, Áo, Bỉ, Brazil, Đức, Hy Lạp, Hungary, Ý, Luxembourg, México, Ba Lan, Nam Phi, Tây Ban Nha, Thụy Điển, Thụy Sĩ, Thổ Nhĩ Kỳ, Ukraine, Vương quốc Anh và Nam Tư (bây giờ là Serbia và Montenegro). Tuy nhiên, nó dường như đã bị ngưng ở các nước này. Nó dường như không được bán ở Hoa Kỳ hoặc Canada.
Tham khảo
[sửa | sửa mã nguồn]- ^ a b c d e f Bengtsson LP, Tausk M (tháng 9 năm 1972). Pharmacology of the endocrine system and related drugs: progesterone, progestational drugs and antifertility agents. Pergamon Press. tr. 235–237.
- ^ a b c d e Lỗi chú thích: Thẻ
<ref>sai; không có nội dung trong thẻ ref có tênThijssen1967 - ^ “SuperCYP”. Bản gốc lưu trữ ngày 3 tháng 11 năm 2011. Truy cập ngày 24 tháng 8 năm 2019.
- ^ a b c d e f g h i Bergink EW, Loonen PB, Kloosterboer HJ (tháng 8 năm 1985). “Receptor binding of allylestrenol, a progestagen of the 19-nortestosterone series without androgenic properties”. Journal of Steroid Biochemistry. 23 (2): 165–8. doi:10.1016/0022-4731(85)90232-8. PMID 3928974.
- ^ a b Saha, A., Roy, K., & Kakali, D. E. (2000). Effects of Allylestrenol on Blood Lipids in Relation to its Biological Activity. Indian Journal of Pharmaceutical Sciences, 62(2), 115.
- ^ a b c d e Sweetman, Sean C. biên tập (2009). “Sex hormones and their modulators”. Martindale: The Complete Drug Reference (ấn bản thứ 36). London: Pharmaceutical Press. tr. 2082. ISBN 978-0-85369-840-1.
- ^ a b Cortés-Prieto J, Bosch AO, Rocha JA (1980). “Allylestrenol: three years of experience with Gestanon in threatened abortion and premature labor”. Clinical Therapeutics. 3 (3): 200–8. PMID 7459930.
- ^ Haas DM, Hathaway TJ, Ramsey PS (tháng 10 năm 2018). “Progestogen for preventing miscarriage in women with recurrent miscarriage of unclear etiology”. The Cochrane Database of Systematic Reviews (10): CD003511. doi:10.1002/14651858.CD003511.pub4. PMID 30298541.
- ^ a b Kanimoto Y, Okada K (tháng 11 năm 1991). “[Antiandrogen therapy of benign prostatic hyperplasia--review of the agents evaluation of the clinical results]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 37 (11): 1423–8. PMID 1722627.
- ^ a b Umeda K (tháng 11 năm 1991). “[Clinical results and problems of anti-androgen therapy of benign prostatic hypertrophy]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 37 (11): 1429–33. PMID 1722628.
- ^ a b Ishizuka O, Nishizawa O, Hirao Y, Ohshima S (tháng 11 năm 2002). “Evidence-based meta-analysis of pharmacotherapy for benign prostatic hypertrophy”. International Journal of Urology. 9 (11): 607–12. doi:10.1046/j.1442-2042.2002.00539.x. PMID 12534901.
- ^ a b Muller (ngày 19 tháng 6 năm 1998). European Drug Index: European Drug Registrations, Fourth Edition. CRC Press. tr. 545–. ISBN 978-3-7692-2114-5.
- ^ Seth (ngày 18 tháng 11 năm 2009). Textbook Of Pharmacology. Elsevier India. tr. 1–. ISBN 978-81-312-1158-8.
- ^ a b c Borglin, N. E. (1960). “Clinical Evaluation of the Progestational Effect of Allylestrenol”. European Journal of Endocrinology. 35 (4 Suppl): NP–S15. doi:10.1530/acta.0.XXXVS0NP. ISSN 0804-4643.
- ^ a b Field-Richards S, Snaith L (tháng 1 năm 1961). “Allylestrenol: a new oral progestogen”. Lancet. 1 (7169): 134–6. doi:10.1016/s0140-6736(61)91310-1. PMID 13699366.
- ^ a b c Madjerek, Z.; de Visser, J.; van der Vies, J.; Overbeek, G. A. (1960). “Allylestrenol, a Pregnancy Maintaining Oral Gestagen”. European Journal of Endocrinology. XXXV (I): 8–19. doi:10.1530/acta.0.XXXV0008. ISSN 0804-4643.
- ^ a b c d McRobb L, Handelsman DJ, Kazlauskas R, Wilkinson S, McLeod MD, Heather AK (tháng 5 năm 2008). “Structure-activity relationships of synthetic progestins in a yeast-based in vitro androgen bioassay”. The Journal of Steroid Biochemistry and Molecular Biology. 110 (1–2): 39–47. doi:10.1016/j.jsbmb.2007.10.008. PMID 18395441.
- ^ a b c d F. J. Zeelen (1990). Medicinal chemistry of steroids. Elsevier Science Limited. tr. 108–109. ISBN 978-0-444-88727-6.
Other examples are allylestrenol (42), a pro-drug converted to the 3-keto analogue (43), which is used in the treatment of threatened abortion [78,79] and altrenogest (44), used in sows and mares to suppress ovulation and estrus behaviour [80]. [...] Progestins with a 17a-allyl side chain: (42) allylestrenol, (43), (44) altrenogest.
- ^ a b c d William Andrew Publishing (ngày 22 tháng 10 năm 2013). Pharmaceutical Manufacturing Encyclopedia, 3rd Edition. Elsevier. tr. 170–. ISBN 978-0-8155-1856-3.
- ^ a b Field-Richards S, Snaith L (tháng 1 năm 1961). “Allylestrenol: a new oral progestogen”. Lancet. 1 (7169): 134–6. doi:10.1016/S0140-6736(61)91310-1. PMID 13699366.
- ^ a b J. A. Simpson; E. S. C. Weiner (1997). Oxford English Dictionary Additions Series. Clarendon Press. tr. 36–. ISBN 978-0-19-860027-5.
1961 Lancet 21 Jan. 135/1 Allylestrenol ('Gestanin', Organon)..seems to be completely free from androgenic activity. 1962 Med. Jrnl. Austral. 8 Sept. 375/2 Each tablet of the combined hormone preparation, 'Premenquil', contains 5 mg. of allyloestrenol. [...]
- ^ a b Medical Proceedings: A South African Journal for the Advancement of Medical Science. Juta and Company. 1962.
Just released in South Africa is Gestanin, Organon Laboratories' new safe oral progestogen. Gestanin is allylestrenol, one of a new group of steroids synthesized by Organon.
- ^ a b c “Micromedex Products: Please Login”.
- ^ a b c d “Allylestrenol”.
- ^ a b c d Index Nominum 2000: International Drug Directory. Taylor & Francis. tháng 1 năm 2000. tr. 29–. ISBN 978-3-88763-075-1.
- ^ Haas DM, Hathaway TJ, Ramsey PS (tháng 10 năm 2018). “Progestogen for preventing miscarriage in women with recurrent miscarriage of unclear etiology”. The Cochrane Database of Systematic Reviews. 10: CD003511. doi:10.1002/14651858.CD003511.pub4. PMC 6516817. PMID 30298541.
- ^ Birkenfeld A, Navot D, Ezra Y, Ron A, Schenker JG (tháng 7 năm 1987). “The effect of estradiol valerate and allylestrenol on endometrial transformation in hypergonadotropic hypogonadic women”. European Journal of Obstetrics, Gynecology, and Reproductive Biology. 25 (3): 221–9. doi:10.1016/0028-2243(87)90102-X. PMID 3609436.
- ^ Barták A, Rozprávka M, Blovský J (tháng 10 năm 1992). “[Lynestrenol and allylestrenol in the therapy of postmenopausal hot flushes]”. Ceskoslovenska Gynekologie (bằng tiếng Séc). 57 (8): 408–13. PMID 1473164.
- ^ Yamanaka H, Kosaku N, Makino T, Shida K (tháng 9 năm 1983). “[Fundamental and clinical study of the anti-prostatic effect of allylestrenol]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 29 (9): 1133–45. PMID 6203385.
- ^ Tajima A, Aso Y, Ushiyama T, Hata M, Kambayashi T, Ohmi Y, Masuda H, Nakahara M, Kitagawa M, Suzuki A (tháng 3 năm 1986). “[Clinical effect of allylestrenol on benign prostatic hypertrophy]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 32 (3): 477–85. PMID 2425610.
- ^ Kohri K, Kurita T, Iguchi M, Kataoka K (tháng 3 năm 1986). “[Clinical effects of allylestrenol on prostatic hypertrophy]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 32 (3): 486–92. PMID 2425611.
- ^ a b c Shida K, Koyanagi T, Kawakura K, Nishida T, Kumamoto Y, Orikasa S, Sato S, Takeda M, Yamanaka H, Shimazaki J (tháng 4 năm 1986). “[Clinical effects of allylestrenol on benign prostatic hypertrophy by double-blind method]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 32 (4): 625–48. PMID 2426932.
- ^ a b Ohyama M, Tanifuji T, Haraguchi C, Fujii N, Higaki Y, Yoshida H, Imamura K (tháng 4 năm 1986). “[Clinical study of allylestrenol (Org AL-25) on patients with prostatic hypertrophy--transrectal ultrasonography and urodynamic examination]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 32 (4): 649–59. PMID 2426933.
- ^ a b Katayama T, Umeda K, Kazama T (tháng 11 năm 1986). “[Hormonal environment and antiandrogenic treatment in benign prostatic hypertrophy]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 32 (11): 1584–9. PMID 2435122.
- ^ a b c d Kumamoto Y, Yamaguchi Y, Sato Y, Suzuki R, Tanda H, Kato S, Mori K, Matsumoto H, Maki A, Kadono M (tháng 2 năm 1990). “[Effects of anti-androgens on sexual function. Double-blind comparative studies on allylestrenol and chlormadinone acetate Part I: Nocturnal penile tumescence monitoring]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 36 (2): 213–26. PMID 1693037.
- ^ a b c Kumamoto Y, Yamaguchi Y, Sato Y, Suzuki R, Tanda H, Kato S, Mori K, Matsumoto H, Maki A, Kadono M (tháng 2 năm 1990). “[Effects of anti-androgens on sexual function. Double-blind comparative studies on allylestrenol and chlormadinone acetate. Part II: Self-assessment questionnaire method]” (PDF). Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 36 (2): 227–44. PMID 1693038.
- ^ Tsuji Y, Ariyoshi A, Nakamura H, Michinaga S, Tomita Y, Ohmori A, Tahara H, Yamashita Y, Fujisawa Y, Kajiwara I (tháng 8 năm 1992). “[Antiandrogen therapy of benign prostatic hypertrophy: clinical effects of allylestrenol evaluated by transrectal ultrasonographic measurement]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 38 (8): 961–6. PMID 1384295.
- ^ a b Fukuoka H, Ishibashi Y, Shiba T, Tuchiya F, Sakanishi S (tháng 7 năm 1993). “[Clinical study of allylestrenol (Perselin) on patients with prostatic hypertrophy]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 39 (7): 679–83. PMID 7689782.
- ^ Iguchi H, Ikeuchi T, Kai Y, Yoshida H (tháng 3 năm 1994). “[Influence of anti-androgen therapy for prostatic hypertrophy on lipid metabolism]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 40 (3): 215–9. PMID 7513937.
- ^ a b c Horita H, Kumamoto Y, Satoh Y, Suzuki N, Wada H, Shibuya A, Adachi H, Kurohata T, Tsukamoto T (tháng 5 năm 1995). “[The preventive effect of indeloxazine hydrochloride to the sexual dysfunction caused by anti-androgenergic agent (allylestrenol)]”. Nihon Hinyokika Gakkai Zasshi. The Japanese Journal of Urology (bằng tiếng Nhật). 86 (5): 1044–50. PMID 7541089.
- ^ a b c Noguchi K, Harada M, Masuda M, Takeda M, Kinoshita Y, Fukushima S, Miyai K, Fukuoka H, Hosaka M (tháng 9 năm 1998). “Clinical significance of interruption of therapy with allylestrenol in patients with benign prostatic hypertrophy”. International Journal of Urology. 5 (5): 466–70. doi:10.1111/j.1442-2042.1998.tb00389.x. PMID 9781436.
- ^ a b Noguchi K, Uemura H, Takeda M, Sekiguchi Y, Ogawa K, Hosaka M (tháng 9 năm 2000). “[Rebound of prostate specific antigen after discontinuation of antiandrogen therapy for benign prostatic hyperplasia]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 46 (9): 605–7. PMID 11107528.
- ^ Noguchi K, Takeda M, Hosaka M, Kubota Y (tháng 5 năm 2002). “[Clinical effects of allylestrenol on patients with benign prostatic hyperplasia (BPH) evaluated with criteria for treatment efficacy in BPH]”. Hinyokika Kiyo. Acta Urologica Japonica (bằng tiếng Nhật). 48 (5): 269–73. PMID 12094708.
- ^ a b Noguchi K, Suzuki K, Teranishi J, Kondo K, Kishida T, Saito K, Uemura H, Kubota Y (tháng 7 năm 2006). “Recovery of serum prostate specific antigen value after interruption of antiandrogen therapy with allylestrenol for benign prostatic hyperplasia”. Hinyokika Kiyo. Acta Urologica Japonica. 52 (7): 527–30. PMID 16910584.
- ^ Takeuchi H (1981). “The therapeutic effect of concurrent administration of 5-fluorouracil and allylestrenol or hexestrol in small doses on prostatic carcinoma”. The Prostate. Supplement. 1: 111–7. PMID 6281750.
- ^ Riquelme Moreno E, Montiel López P, Bravo Guerra R, Escobar Cauz G (tháng 7 năm 1972). “[Control of 5 cases of idiopathic precocious puberty with allylestrenol]”. Ginecologia y Obstetricia de Mexico (bằng tiếng Tây Ban Nha). 32 (189): 99–108. PMID 5057420.
- ^ KD Tripathi (ngày 30 tháng 9 năm 2013). Essentials of Medical Pharmacology. JP Medical Ltd. tr. 318–. ISBN 978-93-5025-937-5.
- ^ R. S. Satoskar; S. D. Bhandarkar &nirmala N. Rege (1973). Pharmacology and Pharmacotherapeutics. Popular Prakashan. tr. 941–. ISBN 978-81-7991-527-1.
- ^ Rozenbaum H (tháng 3 năm 1982). “Relationships between chemical structure and biological properties of progestogens”. American Journal of Obstetrics and Gynecology. 142 (6 Pt 2): 719–24. doi:10.1016/S0002-9378(16)32477-2. PMID 7065053.
- ^ Endrikat J, Gerlinger C, Richard S, Rosenbaum P, Düsterberg B (tháng 12 năm 2011). “Ovulation inhibition doses of progestins: a systematic review of the available literature and of marketed preparations worldwide”. Contraception. 84 (6): 549–57. doi:10.1016/j.contraception.2011.04.009. PMID 22078182.
- ^ Gregory Pincus (ngày 3 tháng 9 năm 2013). The Control of Fertility. Elsevier. tr. 222–. ISBN 978-1-4832-7088-3.
- ^ Freimut A. Leidenberger; Thomas Strowitzki; Olaf Ortmann (ngày 29 tháng 8 năm 2009). Klinische Endokrinologie für Frauenärzte. Springer-Verlag. tr. 225–. ISBN 978-3-540-89760-6.
- ^ Jacobi GH, Altwein JE, Kurth KH, Basting R, Hohenfellner R (tháng 6 năm 1980). “Treatment of advanced prostatic cancer with parenteral cyproterone acetate: a phase III randomised trial”. British Journal of Urology. 52 (3): 208–15. doi:10.1111/j.1464-410X.1980.tb02961.x. PMID 7000222.
- ^ Knuth UA, Hano R, Nieschlag E (tháng 11 năm 1984). “Effect of flutamide or cyproterone acetate on pituitary and testicular hormones in normal men”. The Journal of Clinical Endocrinology and Metabolism. 59 (5): 963–9. doi:10.1210/jcem-59-5-963. PMID 6237116.
- ^ Sander S, Nissen-Meyer R, Aakvaag A (1978). “On gestagen treatment of advanced prostatic carcinoma”. Scandinavian Journal of Urology and Nephrology. 12 (2): 119–21. doi:10.3109/00365597809179977. PMID 694436.
- ^ a b Yasuda N, Fujino K, Shiraji T, Nambu F, Kondo K (tháng 7 năm 1997). “Effects of steroid 5alpha-reductase inhibitor ONO-9302 and anti-androgen allylestrenol on the prostatic growth, and plasma and prostatic hormone levels in rats”. Japanese Journal of Pharmacology. 74 (3): 243–52. doi:10.1254/jjp.74.243. PMID 9268084.
- ^ a b c d J. Elks (ngày 14 tháng 11 năm 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. tr. 31–. ISBN 978-1-4757-2085-3.
- ^ Anita MV; Sandhya Jain; Neerja Goel (ngày 31 tháng 12 năm 2017). Use of Progestogens in Clinical Practice of Obstetrics and Gynecology. JP Medical Ltd. tr. 10–. ISBN 978-93-5270-218-3.
- ^ Jeffrey K. Aronson (ngày 21 tháng 2 năm 2009). Meyler's Side Effects of Endocrine and Metabolic Drugs. Elsevier. tr. 289–. ISBN 978-0-08-093292-7.
- ^ Gunnet JW, Dixon LA (2000). “Hormones, Sex Hormones”. Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.19052407211414.a01. ISBN 978-0471238966.
- ^ Die Gestagene. Springer-Verlag. ngày 27 tháng 11 năm 2013. tr. 16. ISBN 978-3-642-99941-3.
- ^ De Winter MS, Siegman CM, Szpilfogel SA (1959). “17-alkylated-3-deoxo-19-nor-testosterone”. Chem. Ind.: 905.
- ^ Morton IK, Hall JM (ngày 6 tháng 12 năm 2012). Concise Dictionary of Pharmacological Agents: Properties and Synonyms. Springer Science & Business Media. tr. 11–. ISBN 978-94-011-4439-1.
 GIẢM
23%
GIẢM
23%
 GIẢM
14%
GIẢM
14%
 GIẢM
21%
GIẢM
21%
 GIẢM
9%
GIẢM
9%
 GIẢM
41%
GIẢM
41%
 GIẢM
-50%
GIẢM
-50%
.jpg)


