Naegleriasis
| Naegleriasis | |
|---|---|
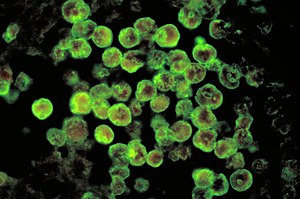 | |
| Ảnh hiển vi của Naegleriasis gây nên bởi Naegleria fowleri. Nhuộm kháng thể huỳnh quang trực tiếp. | |
| Phát âm | |
| Chuyên khoa | Infectious disease |
| ICD-10 | A06.6, B60.2 |
| ICD-9-CM | 136.2 |
Naegleriasis, còn gọi là viêm não-màng não do amip chủ yếu (PAM), viêm não do amip, nhiễm naegleria, là sự xâm nhiễm vào não của nguyên sinh vật sống tự do Naegleria fowleri, hay "amip ăn não". Tên gọi "amip ăn não" còn được dùng để chỉ amip Balamuthia mandrillaris, điều này gây ra một vài sự nhầm lẫn giữa hai loại. Tuy nhiên, Balamuthia mandrillaris không có quan hệ gì với Naegleria fowleri, nó gây ra một loại bệnh khác gọi là viêm não u hạt do amip và không như Naegleriasis thường thấy ở những người có chức năng miễn dịch bình thường, viêm não u hạt do amip thường xảy ra ở những người có chức năng miễn dịch kém như người nhiễm HIV/AIDS hay ung thư bạch cầu.[1]
N. fowleri thường được tìm thấy ở những vùng nước ngọt ấm như ao, hồ, sông và suối nước nóng. Ngoài ra nó cũng được tìm thấy ở trong đất, nguồn cấp nước đô thị bảo trì kém, bình đun nước nóng, gần nguồn nước thải ấm của các nhà máy công nghiệp, trong nước khử trùng không đảm bảo, các bể bơi không được clo hóa. Hiện chưa có bằng chứng cho thấy sinh vật này sống trong nước biển.
Dù là bệnh hiếm gặp nhưng một khi đã mắc thì tử vong gần như là điều chắc chắn với tỷ lệ lớn hơn 95%.[2][3][4]
Dấu hiệu và triệu chứng
[sửa | sửa mã nguồn]Các triệu chứng có thể xuất hiện từ một cho đến bảy ngày sau khi bị nhiễm amip. Triệu chứng ban đầu bao gồm sự thay đổi cảm nhận của khứu giác và vị giác, đau đầu, sốt, buồn nôn, ói mửa và cứng cổ. Ngoài ra còn có tình trạng rối loạn tâm thần, ảo giác, mất sự chú ý, mất điều hòa, co giật. Tiếp theo, bệnh tiến triển nhanh chóng trong vòng ba đến bảy ngày, và cái chết thường đến sau 7 đến 14 ngày,[5] dù vậy cũng có thể lâu hơn. Vào năm 2013, một người ở Đài Loan đã tử vong sau khi nhiễm Naegleria fowleri được 25 ngày.[6]
Nguyên nhân
[sửa | sửa mã nguồn]
N. fowleri xâm nhập hệ thần kinh trung ương thông qua mũi, đặc biệt là qua niêm mạc khứu giác và lá sàng mô mũi. Điều này xảy ra thường là do nước có chứa N. fowleri xộc vào khoang mũi qua các hoạt động như bơi, tắm, hay rửa mũi.
Amip đi theo các sợi thần kinh khứu giác qua lá sàng của xương sàng đến sọ. Từ đó chúng di chuyển đến hành khứu giác rồi tới các khu vực khác của não. Sau đó chúng ăn các mô thần kinh dẫn đến tình trạng hoại tử và xuất huyết nghiêm trọng.[7]
Tiếp theo, những sinh vật này bắt đầu tiêu thụ các tế bào não, từng phần một.[8] Chúng trở thành tác nhân gây ra Naegleriasis (hay PAM), một loại bệnh tác động đến hệ thần kinh trung ương.[9] Bệnh này thường xảy ra ở trẻ em hoặc thanh thiếu niên khỏe mạnh, những đối tượng không có tiền sử bị suy giảm miễn dịch và có tình trạng tiếp xúc với những vùng nước ngọt không lâu trước thời điểm phát hiện bệnh.[10]
Sự phát sinh
[sửa | sửa mã nguồn]Naegleria fowleri lan truyền trong những vùng nước ngọt ấm, tù đọng (thường là vào những tháng hè), và xâm nhập hệ thần kinh trung ương từ nước chứa amip xộc vào khoang mũi bằng cách bám vào dây thần kinh khứu giác.[11] Sau đó chúng di chuyển qua lá sàng tới hành khứu giác ở não trước,[12] rồi nhân số lượng lên nhanh chóng nhờ ăn mô thần kinh.
Chẩn đoán
[sửa | sửa mã nguồn]N. fowleri có thể sinh trưởng trong những môi trường chất lỏng không có ngoại vật hoặc trên các đĩa agar phi dinh dưỡng phủ vi khuẩn. Khuẩn Escherichia coli có thể được sử dụng để phủ lên đĩa (tấm) agar phi dinh dưỡng và thêm vào đó một giọt cặn dịch não tủy. Tiếp theo các đĩa này được ủ ở 37 °C và kiểm tra hàng ngày.[13] Việc phát hiện được thực hiện bằng cách ly tâm một mẫu nước có thêm E. coli, rồi đặt một viên nén vào đĩa agar phi dinh dưỡng. Sau vài ngày, người ta kiểm tra đĩa bằng kính hiển vi và nhận dạng các nang Naegleria qua hình thái của chúng. Sự xác nhận sau cùng có thể thực hiện bằng các phương pháp phân tử và hóa sinh khác nhau.[14] Việc khẳng định sự hiện hữu của Naegleria có thể hoàn tất bằng một cuộc xét nghiệm, tại đó sinh vật này bị phát hiện trong một môi trường nhược trương (nước cất). Khả năng gây bệnh có thể cao hơn ở nhiệt độ cao (42 °C), Naegleria fowleri có thể sinh trưởng tại nhiệt độ đó, còn loài không gây bệnh Naegleria gruberi thì không.
Phòng ngừa
[sửa | sửa mã nguồn]Michael Beach, chuyên viên của Trung tâm kiểm soát và phòng ngừa dịch bệnh Hoa Kỳ, đã đưa ra lời khuyên rằng sử dụng kẹp mũi để ngăn ngừa nước nhiễm mầm bệnh xâm nhập vào mũi là một cách thức phòng vệ hiệu quả, lưu ý về điều kiện để bệnh có thể xảy đến đó là để cho nước đi lên mũi.[15]
Điều trị
[sửa | sửa mã nguồn]Kể từ lần mô tả đầu tiên hồi thập niên 1960, cho đến năm 2015 mới chỉ ghi nhận được 7 trường hợp sống sót sau khi mắc PAM, ba trong số đó ở Mỹ và một ở Mexico.[16][17] Kết quả tiên lượng luôn là không khả quan với những người mắc bệnh và khả năng sống sót duy trì ở mức nhỏ hơn 1%.[10]
Dựa vào các bằng chứng từ phòng thí nghiệm và báo cáo về các trường hợp, amphotericin B là cơ sở truyền thống trong điều trị PAM kể từ ca sống sót đầu tiên ghi nhận tại Mỹ năm 1982.[17][18]
Cách điều trị thường còn là sử dụng kết hợp liệu pháp với nhiều loại kháng sinh khác bên cạnh amphotericin như fluconazole, miconazole, rifampicin và azithromycin. Phương pháp này đã cho thấy thành công ở mức hạn chế chỉ khi áp dụng sớm trong giai đoạn đầu nhiễm bệnh.[19] Fluconazole đã cho thấy hiệu quả chống lại naegleria khi kết hợp với amphotericin trong ống nghiệm nên thường được sử dụng.[17]
Trong khi sử dụng rifampicin là phổ biến, trong đó bao gồm cả bốn trường hợp sống sót tại Bắc Mỹ, việc tiếp tục dùng loại thuốc này đã được đặt nghi vấn.[17] Nó chỉ hoạt động không ổn định trong ống nghiệm và có ảnh hưởng mạnh đến mức độ điều trị sử dụng thuốc kháng sinh khác.[17]
Các steroid như dexamethasone cũng đã được sử dụng để cố gắng làm giảm chứng viêm não.[20]
Vào năm 2013, hai trường hợp chữa trị thành công gần đây nhất tại Mỹ đã áp dụng phương pháp kết hợp thuốc bao gồm miltefosine cũng như liệu pháp kiểm soát nhiệt độ mục tiêu (TTM).[16] Hiện không có dữ liệu về tác dụng của miltefosine đối với hệ thần kinh trung ương.[17] Trung tâm kiểm soát và phòng ngừa dịch bệnh Hoa Kỳ hiện đang cung cấp miltefosine cho các bác sĩ để đối phó với các loại amip sống tự do trong đó có naegleria.[16]
Chlorpromazine đã cho thấy triển vọng trong ống nghiệm cũng như các dạng viêm màng não-mô não do Naegleria ở động vật.[21]
Chẩn đoán một cách kịp thời vẫn là trở ngại rất lớn cho việc điều trị, khi mà đa phần các trường hợp chỉ phát hiện ra sau khi bệnh nhân đã qua đời.
Dịch tễ
[sửa | sửa mã nguồn]Naegleriasis tuy là bệnh hiếm gặp nhưng có khả năng gây tử vong rất cao. Tính đến năm 2004 trên thế giới mới chỉ ghi nhận được 200 ca mắc bệnh,[22] con số này tính đến năm 2008 là 300.[23] Theo nghiên cứu điều trị bằng thuốc tại Đại học Aga Khan ở Pakistan, các thử nghiệm trong ống nghiệm với một số loại thuốc được FDA phê chuẩn dùng cho những bệnh phi lây nhiễm đã chứng minh hiệu quả tiêu diệt Naegleria fowleri cao hơn 95%.[24] Nguồn tương tự cũng đề xuất một phương pháp truyền thuốc theo đường xuyên qua sọ đến não.[25]
Hình thức amip xâm nhiễm hệ thần kinh này được ghi chép lần đầu tại Australia năm 1965.[26][27] Trong năm 1966 đã có bốn trường hợp mắc bệnh được báo cáo tại Mỹ. Đến năm 1968, sinh vật là nguyên nhân gây bệnh, mà trước đó người ta nghĩ là loài Acanthamoeba hoặc Hartmannella, được xác định là Naegleria. Cũng trong năm đó đã có báo cáo về 16 trường hợp mắc bệnh trong giai đoạn 1963-1965 tại Ústí nad Labem, Tiệp Khắc.[28] Vào năm 1970, loại amip này được đặt tên là N. fowleri.[29]
Số trường hợp nhiễm bệnh dường như tăng lên theo phạm vi thông qua biến đổi khí hậu đang gia tăng.[30] Đồng thời, số ca bệnh báo cáo được dự kiến sẽ tăng, đơn giản vì năng lực chẩn đoán đã tốt hơn cả ở những bệnh nhân còn sống cũng như ở những tử thi sau khi chết.[31][32]
| Quốc gia | Các ca nhiễm |
|---|---|
| Costa Rica | một trong năm 2014 [33] |
| Tiệp Khắc | 16 trong giai đoạn 1962-1965 [34] |
| Ấn Độ | 3 trong giai đoạn 2001-2009 (2 ở trẻ nhỏ và 1 ở người lớn), một trong năm 2016 [35][36][37][38] |
| Iran | 1 ở trẻ nhỏ trong năm 2012 [39] |
| New Zealand | 8 trong giai đoạn 1968-1979 [40] |
| Pakistan | 69 trong giai đoạn 2012-2014, có khả năng là từ nghi thức tẩy rửa [41][42][43] |
| Đài Loan | một trong năm 2013 từ suối nước nóng [44] |
| Vương quốc Anh | một trong năm 1979 tại nhà tắm La Mã được phục hồi ở thành phố Bath [45][46] |
| Mỹ | 133 trong giai đoạn 1962-2015,[47][48][49] đa phần tại vùng Đông Nam[50] |
| Venezuela | một trong năm 1998 và 2 trong năm 2006 [51][52] |
Lịch sử
[sửa | sửa mã nguồn]Các bác sĩ M. Fowler và R. F. Carter lần đầu mô tả chứng bệnh trên người do amip ở Australia vào năm 1965.[53] Việc làm của họ đã cung cấp một ví dụ về cách thức mà nguyên sinh vật có thể tồn tại một cách hiệu quả cả tự do trong môi trường cũng như trong cơ thể người. Kể từ năm 1965 đã có hơn 144 trường hợp được xác nhận tại các quốc gia khác nhau. Vào năm 1966, Fowler đã đặt tên cho chứng nhiễm N. fowleri là viêm não-màng não do amip chủ yếu (primary amoebic meningoencephalitis [PAM]) để phân biệt với sự xâm nhập của các loại amip khác như Entamoeba histolytica.[54] Một nghiên cứu trở về trước đã xác định trường hợp mắc PAM đầu tiên được ghi nhận có thể xảy ra tại Anh vào năm 1909.[55]
Nghiên cứu
[sửa | sửa mã nguồn]Nghiên cứu hiện nay tập trung vào sự phát triển của phương pháp chẩn đoán phản ứng chuỗi trùng hợp thời gian thực (real time PCR). Một phương pháp được phát triển liên quan đến việc theo dõi quá trình khuếch đại trong thời gian thực với các probe gắn chất phát huỳnh quang nhắm vào chuỗi MpCI5.[56] Một nhóm khác kết hợp ba phản ứng như một phép chẩn đoán N. fowleri, Acanthamoeba spp. và Balamuthia mandrillaris.[57]
Khi mà con người chưa tìm được cách thức chữa trị hiệu quả, nghiên cứu để phát triển một liệu pháp là tìm kiếm nhân tố gây bệnh, cụ thể là N. fowleri; các loại thuốc có thể nhằm mục tiêu là những yếu tố gây hại. Một yếu tố tiềm tàng trong tính di động của amip là protein mã hóa bởi Nfa1. Khi gen Nfa1 biểu hiện ở amip không gây bệnh Naegleria gruberi và các amip cùng được nuôi với các tế bào mô đích, protein này chịu trách nhiệm cho sự tiêu hóa tế bào.[58] Tiếp theo nghiên cứu này, các thí nghiệm triệt tiêu biểu hiện gen Nfa1 được thực hiện bằng can thiệp ARN. Trong đó, ARN sợi đôi nhằm vào chuỗi Nfa1 được áp dụng và sau đó mức độ biểu hiện của sản phẩm gen suy giảm đột ngột.[59] Phương pháp này có tiềm năng trở thành một kỹ thuật có thể áp dụng được cho việc triệt tiêu biểu hiện của các nhân tố gây hại trong các thể tư dưỡng N. fowleri.
Một vắc-xin sử dụng tá chất Cry1Ac đã trải qua bước nghiên cứu ban đầu.[60]
Xem thêm
[sửa | sửa mã nguồn]Tham khảo
[sửa | sửa mã nguồn]- ^ Shadrach, WS; Rydzewski, K; Laube, U; Holland, G; Ozel, M; Kiderlen, AF; Flieger, A (tháng 5 năm 2005). “Balamuthia mandrillaris, free-living ameba and opportunistic agent of encephalitis, is a potential host for Legionella pneumophila bacteria”. Applied and environmental microbiology. 71 (5): 2244–9. PMID 15870307.
- ^ “6 die from brain-eating amoeba after swimming”. MSNBC. Associated Press. ngày 28 tháng 9 năm 2007.
- ^ “The Centers for Disease Control and Prevention, Division of Parasitic Diseases – Naegleria fowleri - Primary Amoebic Meningoencephalitis (PAM) - General Information”. Truy cập ngày 26 tháng 5 năm 2014.
- ^ Cetin N, Blackall D.Naegleria fowleri meningoencephalitis.Blood 2012 Apr 19;119(16):3658.PMID 22645743
- ^ “CDC - 01 This Page Has Moved: CDC Parasites Naegleria”. Truy cập ngày 27 tháng 7 năm 2015.
- ^ Su MY, Lee MS,et al. A fatal case of Naegleria fowleri meningoencephalitis in Taiwan.Korean J Parasitol. 2013 Apr;51(2):203-6. doi: 10.3347/kjp.2013.51.2.203. Epub 2013 Apr 25. PMID 23710088
- ^ Gautam PL, Sharma S et al. A rare case of survival from primary amebic meningoencephalitis.Indian Crit Care med.2012 Jan;16(1):34-6. doi: 10.4103/0972-5229.94432.PMID 22557831
- ^ Marciano-Cabral, F; John, DT (1983). “Cytopathogenicity of Naegleria fowleri for rat neuroblastoma cell cultures: scanning electron microscopy study”. Infection and immunity. 40 (3): 1214–7. PMC 348179. PMID 6852919.
- ^ Monsters Inside Me (22 tháng 12 năm 2010). “Monsters Inside Me: The Brain-Eating Amoeba: Video: Animal Planet”. Animal.discovery.com. Truy cập ngày 4 tháng 9 năm 2012.
- ^ a b Centers for Disease Control and Prevention (CDC) (2008). “Primary amebic meningoencephalitis – Arizona, Florida, and Texas, 2007”. MMWR. Morbidity and mortality weekly report. 57 (21): 573–7. PMID 18509301.
- ^ Centers for Disease Control and Prevention (CDC) (tháng 5 năm 2008). “Primary amebic meningoencephalitis—Arizona, Florida, and Texas, 2007”. MMWR Morb. Mortal. Wkly. Rep. 57 (21): 573–7. PMID 18509301.
- ^ Cervantes-Sandoval I, Serrano-Luna Jde J, García-Latorre E, Tsutsumi V, Shibayama M (tháng 9 năm 2008). “Characterization of brain inflammation during primary amoebic meningoencephalitis”. Parasitol. Int. 57 (3): 307–13. doi:10.1016/j.parint.2008.01.006. PMID 18374627.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Donald C. Lehman; Mahon, Connie; Manuselis, George (2006). Textbook of Diagnostic Microbiology (ấn bản thứ 3). Philadelphia: Saunders. ISBN 1-4160-2581-2.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Pougnard, C.; Catala, P.; Drocourt, J.-L.; Legastelois, S.; Pernin, P.; Pringuez, E.; Lebaron, P. (2002). “Rapid Detection and Enumeration of Naegleria fowleri in Surface Waters by Solid-Phase Cytometry”. Applied and Environmental Microbiology. 68 (6): 3102–7. doi:10.1128/AEM.68.6.3102-3107.2002. PMC 123984. PMID 12039772.
- ^ "6 die from brain-eating amoeba in lakes", Chris Kahn/Associated Press, 9/28/07
- ^ a b c “Naegleria fowleri — Primary Amebic Meningoencephalitis (PAM) — Amebic Encephalitis”. ngày 23 tháng 4 năm 2015. Truy cập ngày 17 tháng 1 năm 2016.
- ^ a b c d e f Grace, Eddie; Asbill, Scott; Virga, Kris (ngày 1 tháng 11 năm 2015). “Naegleria fowleri: Pathogenesis, Diagnosis, and Treatment Options”. Antimicrobial Agents and Chemotherapy (bằng tiếng Anh). 59 (11): 6677–6681. doi:10.1128/AAC.01293-15. ISSN 0066-4804. PMC 4604384. PMID 26259797. Bản gốc lưu trữ ngày 29 tháng 4 năm 2017. Truy cập ngày 23 tháng 3 năm 2016.
- ^ Seidel, James S.; Harmatz, Paul; Visvesvara, G. S.; Cohen, Arthur; Edwards, Jack; Turner, Jerrold (ngày 11 tháng 2 năm 1982). “Successful Treatment of Primary Amebic Meningoencephalitis”. New England Journal of Medicine. 306 (6): 346–348. doi:10.1056/NEJM198202113060607. ISSN 0028-4793. PMID 7054710.
- ^ Bauman, Robert W. (2009). “Microbial Diseases of the Nervous System and Eyes”. Microbiology, With Diseases by Body System (ấn bản thứ 2). San Francisco: Pearson Education. tr. 617.
- ^ Linam, W. Matthew; Ahmed, Mubbasheer; Cope, Jennifer R.; Chu, Craig; Visvesvara, Govinda S.; Silva, Alexandre J. da; Qvarnstrom, Yvonne; Green, Jerril (ngày 1 tháng 3 năm 2015). “Successful Treatment of an Adolescent With Naegleria fowleri Primary Amebic Meningoencephalitis”. Pediatrics (bằng tiếng Anh). 135 (3): e744–e748. doi:10.1542/peds.2014-2292. ISSN 0031-4005. PMC 4634363. PMID 25667249.
- ^ Kim, J.-H.; Jung, S.-Y.; Lee, Y.-J.; Song, K.-J.; Kwon, D.; Kim, K.; Park, S.; Im, K.-I.; Shin, H.-J. (2008). “Effect of Therapeutic Chemical Agents In Vitro and on Experimental Meningoencephalitis Due to Naegleria fowleri”. Antimicrobial Agents and Chemotherapy. 52 (11): 4010–6. doi:10.1128/AAC.00197-08. PMC 2573150. PMID 18765686.
- ^ Wiwanitkit V (2004). “Review of clinical presentations in Thai patients with primary amoebic meningoencephalitis”. MedGenMed. 6 (1): 2. PMC 1140726. PMID 15208515.
- ^ Caruzo G, Cardozo J (tháng 10 năm 2008). “Primary amoebic meningoencephalitis: a new case from Venezuela”. Trop Doct. 38 (4): 256–7. doi:10.1258/td.2008.070426. PMID 18820207.[liên kết hỏng]
- ^ Abdul Mannan Baig, Huma Kulsoom, and Naveed Ahmed Khan. Primary amoebic meningoencephalitis: amoebicidal effects of clinically approved drugs against Naegleria fowleri.Journal of Medical Microbiology. 02/2014; doi:10.1099/jmm.0.072306-0
- ^ Abdul M. Baig and Naveed A. Khan. Novel Chemotherapeutic Strategies in the Management of Primary Amoebic Meningoencephalitis Due to Naegleria fowleri. CNS Neuroscience & Therapeutics /01/2014; doi:10.1111/cns.12225
- ^ Fowler, M.; Carter, R. F. (tháng 9 năm 1965). “Acute pyogenic meningitis probably due to Acanthamoeba sp.: a preliminary report”. British Medical Journal. 2 (5464): 740–2. doi:10.1136/bmj.2.5464.734-a. PMC 1846173. PMID 5825411.
- ^ Symmers, W. S. C. (tháng 11 năm 1969). “Primary amoebic meningoencephalitis in Britain” (PDF). British Medical Journal. 4 (5681): 449–54. doi:10.1136/bmj.4.5681.449. PMC 1630535. PMID 5354833.
- ^ Červa, L.; Novák, K. (tháng 4 năm 1968). “Ameobic meningoencephalitis: sixteen fatalities”. Science. 160 (3823): 92. doi:10.1126/science.160.3823.92. PMID 5642317.
- ^ Gutierrez, Yezid (ngày 15 tháng 1 năm 2000). “Chapter 6: Free Living Amebae”. Diagnostic Pathology of Parasitic Infections with Clinical Correlations (ấn bản thứ 2). USA: Oxford University Press. tr. 114–115. ISBN 0-19-512143-0.
- ^ Kemble SK, Lynfield R, et al.Fatal Naegleria fowleri infection acquired in Minnesota: possible expanded range of a deadly thermophilic organism. Clin Infect Dis. 2012 Mar;54(6):805-9. doi: 10.1093/cid/cir961. Epub 2012 Jan 11.PMID 22238170
- ^ Kanwal, Farooqi M, Ali S, Ahmed SS.The paradox of primary amoebic meningoencephalitis--a rare disease, but commonly misdiagnosed.J PakMed Assoc2013 May;63(5):667.PMID 22238170
- ^ Reference 38
- ^ “Brain-eating amoeba victim: Sanford boy 'a ray of light'”. Bản gốc lưu trữ ngày 23 tháng 8 năm 2014. Truy cập ngày 22 tháng 8 năm 2014.
- ^ Ccaronerva, L.; Novak, K. (1968). “Amoebic Meningoencephalitis: Sixteen Fatalities”. Science. 160 (3823): 92–92. doi:10.1126/science.160.3823.92. PMID 5642317.
- ^ Shenoy S, Wilson G, Prashanth HV, et al.Primary meningoencephalitis by Naegleria fowleri: first reported case from Mangalore, South India. J Clin Microbiol. 2002 Jan;40(1):309-10.PMID 11773141
- ^ Hebbar S, Bairy I, et al.Fatal case of Naegleria fowleri meningo-encephalitis in an infant: case report.Ann Trop Paediatr. 2005 Sep;25(3):223-6.PMID 16156990
- ^ Gupta N, Bhaskar H, et al.Primary amoebic meningoencephalitis: first reported case from Rohtak, North India.National Institute of Communicable Diseases, New Delhi.PMID 20191204
- ^ “Today's News Headlines, New Indian Express, Latest News, Updates, and Stories”. The New Indian Express. Truy cập 3 tháng 1 năm 2025.
- ^ Movahedi Z, Shokrollahi MR,et al. Primary amoebic meningoencephalitis in an Iranian infant.Case Rep Med. 2012;2012:782854. doi: 10.1155/2012/782854. Epub 2012 Jul 26.PMID 22899941
- ^ Cursons, R; Sleigh, J; Hood, D; Pullon, D (2003). “A case of primary amoebic meningoencephalitis: North Island, New Zealand”. The New Zealand medical journal. 116 (1187): U712. PMID 14752540.
- ^ “Brain-eating amoeba: need for water chlorination stressed”. Truy cập ngày 19 tháng 7 năm 2012.
- ^ “'Brain-eating amoeba' claims another life in Karachi access-date = ngày 10 tháng 10 năm 2014”. Thiếu dấu sổ thẳng trong:
|tiêu đề=(trợ giúp) - ^ “Patient who succumbed to Naegleria Fowleri because of doing Ablution”. Teeth Maestro Blog. Truy cập ngày 28 tháng 10 năm 2010.
- ^ Reference10
- ^ “The City of Bath, Somerset, UK”. H2G2. Truy cập ngày 1 tháng 11 năm 2007.
- ^ Kilvington, Simon; John Beeching (tháng 6 năm 1995). “Identification and epidemiological typing of Naegleria fowleri with DNA probes” (PDF). Applied and Environmental Microbiology. 61 (6): 2071–2078. PMC 167479. PMID 7793928. Bản gốc (PDF) lưu trữ ngày 27 tháng 9 năm 2011. Truy cập ngày 31 tháng 10 năm 2007.
- ^ “California woman dies from brain-eating amoeba”. CBS News. ngày 2 tháng 7 năm 2015. Truy cập ngày 5 tháng 7 năm 2015.
- ^ Joelving, Frederick (ngày 28 tháng 8 năm 2012). “CDC strengthens brain-eating amoeba, neti pot link”. Reuters. Bản gốc lưu trữ ngày 4 tháng 3 năm 2016. Truy cập ngày 4 tháng 1 năm 2013.
- ^ “CDC strengthens brain-eating ameba, neti pot link”. Chicago Tribune. ngày 28 tháng 8 năm 2012. Bản gốc lưu trữ ngày 4 tháng 3 năm 2016. Truy cập ngày 25 tháng 3 năm 2016.
- ^ “Naegleria – Frequently Asked Questions (FAQs)”. Centers for Disease Control and Prevention. ngày 5 tháng 7 năm 2011. Truy cập ngày 17 tháng 8 năm 2011.
- ^ Rodríguez R, Méndez O, et al.Central nervous system infection by free-living amebas: report of 3 Venezuelan cases.Rev Neurol. 1998 Jun;26(154):1005-8.PMID 9658480
- ^ Petit F, Vilchez V, et al.Primary amebic meningoencephalitis: two new cases report from Venezuela. Arq Neuropsiquiatr 2006 Dec;64(4):1043-6.PMID 17221024
- ^ Fowler, M; Carter, RF (1965). “Acute pyogenic meningitis probably due to Acanthamoeba sp.: a preliminary report”. British Medical Journal. 2 (5464): 740–2. doi:10.1136/bmj.2.5464.734-a. PMC 1846173. PMID 5825411.
- ^ Butt, Cecil G. (1966). “Primary Amebic Meningoencephalitis”. New England Journal of Medicine. 274 (26): 1473–6. doi:10.1056/NEJM196606302742605. PMID 5939846.
- ^ Symmers, WC (1969). “Primary amoebic meningoencephalitis in Britain”. British Medical Journal. 4 (5681): 449–54. doi:10.1136/bmj.4.5681.449. PMC 1630535. PMID 5354833.
- ^ Maďarová, Lucia; Trnková, Katarína; Feiková, Soňa; Klement, Cyril; Obernauerová, Margita (2010). “A real-time PCR diagnostic method for detection of Naegleria fowleri”. Experimental Parasitology. 126 (1): 37–41. doi:10.1016/j.exppara.2009.11.001. PMID 19919836.
- ^ Qvarnstrom, Y.; Visvesvara, G. S.; Sriram, R.; Da Silva, A. J. (2006). “Multiplex Real-Time PCR Assay for Simultaneous Detection of Acanthamoeba spp., Balamuthia mandrillaris, and Naegleria fowleri”. Journal of Clinical Microbiology. 44 (10): 3589–95. doi:10.1128/JCM.00875-06. PMC 1594764. PMID 17021087.
- ^ Song, K; Jeong, S; Park, S; Kim, K; Kwon, M; Im, K; Pak, J; Shin, H (2006). “Naegleria fowleri: Functional expression of the Nfa1 protein in transfected Naegleria gruberi by promoter modification”. Experimental Parasitology. 112 (2): 115–20. doi:10.1016/j.exppara.2005.10.004. PMID 16321386.
- ^ Jung, S; Kim, J; Lee, Y; Song, K; Kim, K; Park, S; Im, K; Shin, H (2008). “Naegleria fowleri: nfa1 gene knock-down by double-stranded RNAs”. Experimental Parasitology. 118 (2): 208–13. doi:10.1016/j.exppara.2007.08.008. PMID 17904122.
- ^ Rojas-Hernández S, Rodríguez-Monroy MA, López-Revilla R, Reséndiz-Albor AA, Moreno-Fierros L (2004). “Intranasal coadministration of the Cry1Ac protoxin with amoebal lysates increases protection against Naegleria fowleri meningoencephalitis”. Infect. Immun. 72 (8): 4368–75. doi:10.1128/IAI.72.8.4368-4375.2004. PMC 470623. PMID 15271892.Quản lý CS1: sử dụng tham số tác giả (liên kết)
Liên kết ngoài
[sửa | sửa mã nguồn] GIẢM
48%
GIẢM
48%
![[Review sách] Normal people - Sally Rooney](https://down-bs-vn.img.susercontent.com/sg-11134201-22090-edroebrkpwhvaf.webp) GIẢM
16%
GIẢM
16%
 GIẢM
30%
GIẢM
30%
 GIẢM
15%
GIẢM
15%
 GIẢM
3%
GIẢM
3%
 GIẢM
15%
GIẢM
15%



