Acid tartaric
| Acid tartaric[1] | |
|---|---|
 | |
 | |
| Danh pháp IUPAC | 2,3-Dihydroxybutanedioic acid |
| Tên khác | Tartaric acid 2,3-Dihydroxysuccinic acid Threaric acid Racemic acid Uvic acid Paratartaric acid Winestone |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| DrugBank | DB01694 |
| KEGG | |
| MeSH | |
| ChEBI | |
| ChEMBL | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | C4H6O6 (công thức cơ bản) HO2CCH(OH)CH(OH)CO2H (công thức cấu trúc) |
| Khối lượng mol | 150,087 g/mol |
| Bề ngoài | Bột màu trắng |
| Khối lượng riêng | 1,79 g/mL (H2O) |
| Điểm nóng chảy | 171 đến 174 °C (444 đến 447 K; 340 đến 345 °F) (L hoặc D-tartaric; tinh khiết) 206 °C (DL, racemic) 165–166 °C (meso-khan) 146–148 °C (meso-ngậm nước)[2] |
| Điểm sôi | |
| Độ hòa tan trong nước |
|
| Độ axit (pKa) | L(+) 25 °C: pKa1= 2,89, pKa2= 4,40 meso 25 °C: pKa1= 3,22, pKa2= 4,85[3] |
| MagSus | −67,5•10−6 cm³/mol |
| Base liên hợp | Bitartrat |
| Các nguy hiểm | |
| Phân loại của EU | Kích thích (Xi) |
| Chỉ dẫn R | R36 |
| Các hợp chất liên quan | |
| Cation khác | Mononatri tartrat Dinatri tartrat Monokali tartrat Dikali tartrat |
| Nhóm chức liên quan | Acid butyric Acid succinic Acid dimercaptosuccinic Acid malic Acid maleic Acid fumaric |
| Hợp chất liên quan | 2,3-Butanediol Acid cichoric |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Acid tartaric là một acid hữu cơ màu trắng, tinh thể xuất hiện tự nhiên trong nhiều loại trái cây, đáng chú ý nhất là trong nho, cũng như trong chuối, me và cam quýt.[4] Muối của nó, kali bitartrat, thường được gọi là kem của cao răng, phát triển tự nhiên trong quá trình sản xuất rượu vang. Nó thường được trộn với natri bicacbonat và được bán dưới dạng bột nở dùng làm chất men trong chế biến thực phẩm. Bản thân acid được thêm vào thực phẩm dưới dạng chất chống oxy hóa E334 và để truyền vị chua đặc trưng của nó.
Acid tartaric là một acid alpha-hydroxy-cacboxylic, đặc tính diproton và aldaric, và là một dẫn xuất dihydroxyl của acid succinic.
Lịch sử
[sửa | sửa mã nguồn]Acid tartaric đã được biết đến với các nhà sản xuất rượu vang trong nhiều thế kỷ. Bản ghi chép về việc khai thác từ tàn dư làm rượu vang được nhà giả kim Jābir ibn Hayyān thực hiện vào khoảng năm 800.[5] Quá trình hóa học để chiết xuất được nhà hóa học người Thụy Điển Carl Wilhelm Scheele phát triển vào năm 1769.[6]
Acid tartaric đóng một vai trò quan trọng trong việc phát hiện ra thủ tính trong hóa học. Tính chất này của acid tartaric được Jean Baptiste Biod quan sát lần đầu tiên vào năm 1832, khi ông quan sát thấy khả năng xoay ánh sáng phân cực của nó.[7][8] Louis Pasteur tiếp tục nghiên cứu này vào năm 1847 bằng cách nghiên cứu các hình dạng của các tinh thể natri amoni tartrat, mà ông tìm thấy là có thủ tính. Bằng cách phân loại thủ công các tinh thể có hình dạng khác nhau, Pasteur là người đầu tiên tạo ra một mẫu acid levotartaric tinh khiết.[9][10][11][12][13]
Hóa học lập thể
[sửa | sửa mã nguồn]
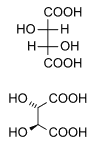
Acid tartaric trong tự nhiên là thủ tính, và là một nguyên liệu hữu ích trong tổng hợp hóa học hữu cơ. Dạng tự nhiên của acid là acid dextrotartaric hoặc acid L-(+)-tartaric (tên lỗi thời acid d-tartaric). Vì nó có sẵn trong tự nhiên, nó rẻ hơn một chút so với đồng phân đối cực và đồng phân meso của nó. Các tiền tố dextro và levo là những thuật ngữ cổ.[14] Sách giáo khoa hiện đại đề cập đến dạng tự nhiên là acid (2R,3R)-tartaric (acid L-(+)-tartaric), và đồng phân đối cực của nó là (acid 2S,3S)-tartaric (acid D-(-)-tartaric). Đồng phân meso là acid (2R,3S)-tartaric (đồng nhất với acid (2S,3R)-tartaric).
- Dextro và levo tạo thành các tinh thể hình cầu đơn nghiêng[15] và các tinh thể trực thoi.
- Acid tartaric racemic tạo thành tinh thể đơn nghiêng[16] và tinh thể ba nghiêng (nhóm không gian P1).[17][18]
- Acid meso tartaric khan tạo thành hai dạng đa hình khan: triclinic và orthorhombic.
- Acid meso tartaric monohydrat kết tinh dưới dạng đa hình đơn nghiêng và đa hình ba nghiêng tùy thuộc vào nhiệt độ mà quá trình kết tinh từ dung dịch nước xảy ra.[19]
Acid tartaric trong dung dịch Fehling liên kết với các ion đồng(II), ngăn chặn sự hình thành các muối hydroxide không hòa tan.
| Acid DL-tartaric (acid racemic) (tỷ lệ 1: 1) | acid mesotartaric | |
|---|---|---|
| acid dextrotartaric (acid L-(+)-tartaric) |
acid levotartaric (acid D-(−)-tartaric) | |

|
|

|
| Tên gọi chung | Acid tartaric | Acid levotartaric | Acid dextrotartaric | Acid mesotartaric | Acid racemic |
|---|---|---|---|---|---|
| Đồng nghĩa | Acid (2S,3S)-tartaric Acid (S,S)-tartaric Acid (−)-tartaric Acid l-tartaric(lỗi thời) Acid levotartaric Acid D-tartaric Acid D-threaric ('đồng phân không tự nhiên')[20] |
Acid (2R,3R)-tartaric Acid (R,R)-tartaric Acid (+)-tartaric Acid d-tartaric (lỗi thời) Acid L-tartaric Acid L-threaric ('đồng phân tự nhiên')[21] |
Acid (2R,3S)-tartaric Acid meso-tartaric Acid erythraric |
Acid rac-(2R,3S)-tartaric Acid (2RS,3SR)-tartaric Acid (±)-tartaric AcidDL-tartaric Acid dl-tartaric (lỗi thời) Acid paratartaric Acid uvic | |
| PubChem | CID 875 từ PubChem | CID 439655 từ PubChem | CID 444305 từ PubChem | CID 78956 từ PubChem | CID 5851 từ PubChem |
| Số EINECS | |||||
| Số CAS | 526-83-0 | 147-71-7 | 87-69-4 | 147-73-9 | 133-37-9 |
Sản xuất
[sửa | sửa mã nguồn]Acid L-(+)-tartaric
[sửa | sửa mã nguồn]Đồng phân acid L-(+)-tartaric của acid tartaric được sản xuất công nghiệp với số lượng lớn nhất. Nó thu được từ cặn rượu, một phụ phẩm rắn của quá trình lên men rượu. Phụ phẩm trước đây chủ yếu bao gồm kali bitartrat (KHC4H4O6). Muối kali này được chuyển thành calci tartrat (CaC4H4O6) sau khi xử lý bằng sữa vôi (Ca(OH)2):[22]
- KO2CCH(OH)CH(OH)CO2H + Ca(OH)2 → Ca(O2CCH(OH)CH(OH)CO 2) + KOH + H2O
Trong thực tế, sản lượng calci tartrat cao hơn thu được với việc bổ sung calci chloride. Calci tartrat sau đó được chuyển thành acid tartaric bằng cách xử lý muối bằng dung dịch acid sulfuric:
- Ca(O2CCH(OH)CH(OH)CO2) + H2SO4 → HO2CCH(OH)CH(OH)CO2H + CaSO4
Acid tartaric racemic
[sửa | sửa mã nguồn]Acid tartaric racemic (ví dụ: hỗn hợp 50:50 của các phân tử acid D-(-)-tartaric và acid L-(+)-tartaric) có thể được điều chế trong phản ứng nhiều bước từ acid maleic. Trong bước đầu tiên, acid maleic được epoxide hóa bằng hydro peroxide sử dụng kali tungstat làm chất xúc tác.[22]
- HO2CC2H2CO2H + H2O 2 → OC2H2(CO2H)2
Trong bước tiếp theo, epoxide bị thủy phân.
- OC2H2(CO2H)2 + H2O → (HOCH)2(CO2H)2
Acid meso-tartaric được hình thành thông qua quá trình đồng phân hóa nhiệt. Acid dextro-tartaric được đun nóng trong nước ở 165 °C trong khoảng 2 ngày. Acid meso-tartaric cũng có thể được điều chế từ acid dibromosuccinic sử dụng bạc hydroxide:[23]
- HO2CCHBrCHBrCO2H + 2 AgOH → HO2CCH(OH)CH(OH)CO2H + 2 AgBr
Acid meso-tartaric có thể được tách ra khỏi acid racemic dư bằng cách kết tinh, do racemat ít hòa tan hơn.
Khả năng phản ứng
[sửa | sửa mã nguồn]Acid L-(+)-tartaric có thể tham gia vào một số phản ứng. Như chỉ ra trong sơ đồ phản ứng dưới đây, acid dihydroxymaleic được tạo ra khi xử lý acid L-(+)-tartaric bằng hydro peroxide với sự có mặt của muối sắt.
- HO2CCH(OH)CH(OH)CO2H + H2O2 → HO2CC(OH)C(OH)CO2H + 2 H2O
Acid dihydroxymaleic sau đó có thể được oxy hóa thành acid tartronic bằng acid nitric.[24]
Các dẫn xuất
[sửa | sửa mã nguồn]

Các dẫn xuất quan trọng của acid tartaric bao gồm các muối của nó, kem tartar (kali bitartrat), muối Rochelle (kali natri tartrat, thuốc nhuận tràng nhẹ) và thuốc tartar gây nôn (antimon kali tartrat).[25][26][27] Diisopropyl tartrat được sử dụng làm chất đồng xúc tác trong tổng hợp bất đối xứng.
Acid tartaric là một độc tố cơ, hoạt động bằng cách ức chế sản xuất acid malic, và ở liều cao gây tê liệt và tử vong.[28] Liều gây chết trung bình (LD50) là khoảng 7,5 gam/kg đối với người, 5,3 gam/kg đối với thỏ và 4,4 gam/kg đối với chuột nhắt.[29] Với con số này, cần có trên 500 g (18 oz) để giết một người nặng 70 kg (150 lb), vì vậy nó có thể được trộn an toàn trong nhiều loại thực phẩm, đặc biệt là đồ ngọt có vị chua. Là một phụ gia thực phẩm, acid tartaric được sử dụng làm chất chống oxy hóa với số E 334; các tartrat là các chất phụ gia khác phục vụ như chất chống oxy hóa hoặc chất nhũ hóa.
Khi kem tartar được thêm vào nước thì huyền phù sinh ra có tác dụng làm sạch các tiền xu bằng đồng rất tốt, vì dung dịch tartrat có thể hòa tan lớp đồng(II) oxide có trên bề mặt của các đồng xu. Phức hợp đồng(II) được tạo ra hòa tan nhiều trong nước.
Acid tartaric trong rượu vang
[sửa | sửa mã nguồn]
Acid tartaric có thể được những người uống rượu vang nhận ra ngay lập tức như là nguồn của "kim cương rượu vang", là các tinh thể kali bitartrat nhỏ đôi khi hình thành tự phát trên nút chai hoặc ở đáy chai. Các "tartrat" này là vô hại, mặc dù đôi khi bị nhầm lẫn với thủy tinh vỡ và được ngăn chặn trong nhiều loại rượu vang thông qua quá trình ổn định lạnh (không phải lúc nào cũng được ưa thích vì nó có thể thay đổi nét đặc trưng của rượu vang). Các tartrat còn lại ở bên trong các thùng già hóa đã có lúc là nguồn cung cấp kali bitartrat công nghiệp chính.
Acid tartaric có vai trò quan trọng về mặt hóa học, làm giảm độ pH của "hèm rượu nho" đang lên men đến mức mà nhiều vi khuẩn gây hư hỏng không mong muốn không thể sống và hoạt động, cũng như có vai trò của một chất bảo quản sau khi lên men. Trong miệng, acid tartaric tạo một chút vị chua của rượu vang, mặc dù acid citric và acid malic cũng có vai trò trong việc tạo vị chua.
Trong cam chanh
[sửa | sửa mã nguồn]Các kết quả từ một nghiên cứu cho thấy trong cam chanh thì trái cây được sản xuất từ canh tác hữu cơ chứa hàm lượng acid tartaric cao hơn so với trái cây được sản xuất trong nông nghiệp thông thường.[4]
Trong chất siêu dẫn
[sửa | sửa mã nguồn]Acid tartaric dường như làm tăng nhiệt độ tới hạn trong một số chất siêu dẫn nhất định, được cho là bằng cách làm tăng bậc oxy hóa, trong khi cơ chế của hiện tượng này vẫn chưa được biết chính xác.[30]
Ứng dụng
[sửa | sửa mã nguồn]Acid tartaric và các dẫn xuất của nó có rất nhiều công dụng trong lĩnh vực dược phẩm. Ví dụ, nó đã được sử dụng trong sản xuất muối sủi bọt, hay kết hợp với acid citric để cải thiện hương vị của thuốc uống.[24] Dẫn xuất kali antimonyl của acid được gọi là chất gây nôn tartar, có trong thuốc ho như một chất long đờm với liều lượng nhỏ.
Acid tartaric cũng có một vài ứng dụng trong công nghiệp. Acid này được quan sát thấy càng hóa (chelat) các ion kim loại như calci và magnesi. Do đó, acid này được sử dụng trong nông nghiệp và các ngành công nghiệp kim loại như một tác nhân tạo càng cho các vi chất dinh dưỡng phức hợp trong phân bón đất và để làm sạch bề mặt kim loại, tương ứng bao gồm nhôm, đồng, sắt và hợp kim của các kim loại này.[22]
Tham khảo
[sửa | sửa mã nguồn]- ^ Tartaric Acid – Compound Summary, PubChem.
- ^ Lide, D. R. biên tập (2005). CRC Handbook of Chemistry and Physics (ấn bản thứ 86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Dawson R.M.C. et al., 1959. Data for Biochemical Research, Oxford, Clarendon Press.
- ^ a b Duarte, A. M.; Caixeirinho, D.; Miguel, M. G.; Sustelo, V.; Nunes, C.; Fernandes, M. M.; Marreiros, A. (2012). “Organic acids concentration in Citrus juice from conventional versus organic farming”. Acta Horticulturae (933): 601–606. doi:10.17660/actahortic.2012.933.78. ISSN 0567-7572. Bản gốc lưu trữ ngày 2 tháng 6 năm 2018. Truy cập ngày 25 tháng 4 năm 2020.
- ^ Lisa Solieri, Paolo Giudici (2009). Vinegars of the World. Springer. tr. 29. ISBN 88-470-0865-4.
- ^ Retzius Anders Jahan, 1770. "Försök med vinsten och dess syra" (Experiments with cream of tartar and its acid), Kungliga Vetenskapsakademiens Handlingar (Proceedings of the Royal Academy of Sciences), 31: 207–213. Từ trang 209: "§. 6. Dessa försök omtalte jag för Hr. Carl Wilhelm Scheele (en snabb och lårgirug Pharmaciæ Studiosus) ... " (§. 6. Tôi nói đến các thực nghiệm này nhân danh ông Carl Wilhelm Scheele (một sinh viên dược học nhanh nhẹn và chăm chỉ) ...)
- ^ Biod, 1835. "Mémoire sur la polarization circulaire et sur ses applications à la chimie organique" (Ký sự về phân cực tròn và các ứng dụng của nó trong hóa học hữu cơ), Mémoires de l'Académie des sciences de l'Institut, tập 2, 13: 39–175. Acid tartaric kết tinh (acide tartarique cristallisé) quay ánh sáng phân cực phẳng được ghi trong Bảng G trang 168. (Lưu ý: Bài báo này được đọc tại Viện Hàn lâm Khoa học Hoàng gia Pháp vào ngày 5 tháng 11 năm 1832.)
- ^ Biod, 1838. "Pour discerner les mélanges et les combinaisons chimiques définies ou non définies, qui agissent sur la lumière polarisée; suivies d'applications aux combinaisons de l'acide tartarique avec l'eau, l'alcool et l'esprit de bois" (Để phân biệt các hỗn hợp và các kết hợp hóa học, đã định nghĩa hoặc chưa định nghĩa, có tác động lên ánh sáng phân cực; tiếp theo là các ứng dụng để kết hợp acid tartaric với nước, rượu [tức là etanol], và dầu gỗ [tức là metanol]), Mémoires de l'Académie des sciences de l'Institut, tập 2, 15: 93–279.
- ^ L. Pasteur, 1848. "Mémoire sur la relation qui peut exister entre la forme cristalline et la composition chimique, et sur la cause de la polarisation rotatoire" (Ký sự về mối quan hệ có thể tồn tại giữa dạng tinh thể và thành phần hóa học, và nguyên nhân của sự phân cực quay)," Comptes rendus de l'Académie des sciences (Paris), 26: 535–538.
- ^ L. Pasteur, 1848. "Sur les relations qui peuvent exister entre la forme cristalline, la composition chimique et le sens de la polarisation rotatoire" (Về các mối quan hệ có thể tồn tại giữa dạng tinh thể, và thành phần hóa học, và ý nghĩa của sự phân cực quay), Annales de Chimie et de Physique, tập 3, 24: 442–459.
- ^ Pasteur Louis, 1850. "Recherches sur les propriétés spécifiques des deux acides qui composent l'acide racémique" (Nghiên cứu các tính chất cụ thể của hai acid tạo ra acid racemic), Annales de Chimie et de Physique, tập 3, 28 (3): 56–99. Xem thêm Pl. II. (Xem thêm báo cáo của ủy ban được chỉ định để xác minh những phát hiện của Pasteur, trang 99–117.) [tiếng Pháp]
- ^ George B. Kauffman & Robin D. Myers (1998). “Pasteur's resolution of racemic acid: A sesquicentennial retrospect and a new translation” (PDF). The Chemical Educator. 3 (6): 1–4. doi:10.1007/s00897980257a. Bản gốc (PDF) lưu trữ ngày 17 tháng 1 năm 2006.
- ^ H. D. Flack (2009). “Louis Pasteur's discovery of molecular chirality and spontaneous resolution in 1848, together with a complete review of his crystallographic and chemical work” (PDF). Acta Crystallographica A. 65 (5): 371–389. doi:10.1107/S0108767309024088. PMID 19687573. Bản gốc (PDF) lưu trữ ngày 6 tháng 9 năm 2012.
- ^ “Lecture 28: Stereochemical Nomenclature; Racemization and Resolution - CosmoLearning Chemistry”. CosmoLearning. Bản gốc lưu trữ ngày 22 tháng 7 năm 2023. Truy cập ngày 25 tháng 4 năm 2020.
- ^ W, T, Astbury (tháng 2 năm 1923). “The Crystalline Structure and Properties of Tartaric Acid”. Proc. R. Soc. A. 102 (718): 506–528. Bibcode:1923RSPSA.102..506A. doi:10.1098/rspa.1923.0010.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết), based on P. Groth's "Chemische Krystallographie".
- ^ CRC Handbook of Chemistry and Physics, 49th edition.
- ^ Samantha Callear and Michael Hursthouse (2008). “D-Tartaric acid”. Crystallography Open Database.
- ^ Paul Luner; và đồng nghiệp (tháng 7 năm 2002). “(+-)-Tartaric acid”. Acta Crystallographica Section C. 58 (6): o333–o335. Bibcode:2002AcCrC..58O.333L. doi:10.1107/S0108270102006650. PMID 12050433., “(±)-Tartaric acid”. Crystallography Open Database. 2002.
- ^ G. A. Bootsma and J. C. Schoone (1967). “Crystal Structures of Meso Tartaric Acid”. Acta Crystallogr. 22 (4): 522–532. Bibcode:1967AcCry..22..522B. doi:10.1107/S0365110X67001070.
- ^ “Tartaric Acid_1”.
- ^ “Tartaric Acid_2”.
- ^ a b c J.-M. Kassaian "Tartaric acid" in Ullmann's encyclopedia of Industrial Chemistry; VCH: Weinheim, Germany, 2002, 35, 671-678. doi:10.1002/14356007.a26_163
- ^ Augustus Price West. Experimental Organic Chemistry. World Book Company: New York, 1920, 232-237.
- ^ a b DeFraties, J. J. (2000). “Hydroxy Dicarboxylic Acids”. Kirk Othmer encyclopedia of Chemical Technology. tr. 1–19. doi:10.1002/0471238961.0825041802120109.a01.
- ^ Zalkin, Allan; Templeton, David H.; Ueki, Tatzuo (1973). “Crystal structure of l-tris(1,10-phenathroline)iron(II) bis(antimony(III) d-tartrate) octahydrate”. Inorganic Chemistry. 12 (7): 1641–1646. doi:10.1021/ic50125a033.
- ^ Haq, I.; Khan, C. (1982). “Hazards of a traditional eye-cosmetic—SURMA”. JPMA. the Journal of the Pakistan Medical Association. 32 (1): 7–8. PMID 6804665.
- ^ McCallum, R. I. (1977). “President's address. Observations upon antimony”. Proceedings of the Royal Society of Medicine. 70 (11): 756–63. PMC 1543508. PMID 341167.
- ^ Alfred Swaine Taylor, Edward Hartshorne (1861). Medical jurisprudence. Blanchard and Lea. tr. 61.
- ^ Joseph A. Maga, Anthony T. Tu (1995). Food additive toxicology. CRC Press. tr. 137–138. ISBN 0-8247-9245-9.
- ^ arXiv, Emerging Technology from the. “Red Wine, Tartaric Acid, and the Secret of Superconductivity”. MIT Technology Review (bằng tiếng Anh). Truy cập ngày 9 tháng 1 năm 2020.
Liên kết ngoài
[sửa | sửa mã nguồn] Tư liệu liên quan tới Acid tartaric tại Wikimedia Commons
Tư liệu liên quan tới Acid tartaric tại Wikimedia Commons- Tệp PDB cho MSE Lưu trữ 2018-09-20 tại Wayback Machine
![[Sách] Những cô em gái - Nguyễn Nhật Ánh](https://down-ws-vn.img.susercontent.com/15910be8b1f00f27ed5c124482bcbcfd.webp) GIẢM
13%
GIẢM
13%
 GIẢM
20%
GIẢM
20%
 GIẢM
19%
GIẢM
19%
 GIẢM
18%
GIẢM
18%
 GIẢM
34%
GIẢM
34%
 GIẢM
44%
GIẢM
44%



