Calci cyanide
| Calci cyanide | |
|---|---|
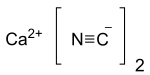 Cấu trúc của calci cyanide | |
| Danh pháp IUPAC | Calci đicyanide |
| Tên hệ thống | Calci đicyanide |
| Tên khác | Calci đicyanide Cyanide đen |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | Ca(CN)2 |
| Khối lượng mol | 92,112 g/mol |
| Bề ngoài | bột trắng |
| Mùi | giống hydro cyanide |
| Khối lượng riêng | 1,853 g/cm³ (20 ℃) |
| Điểm nóng chảy | 640 °C (913 K; 1.184 °F) (phân hủy) |
| Điểm sôi | |
| Độ hòa tan trong nước | tan |
| Độ hòa tan | tan trong cồn, axit yếu |
| Cấu trúc | |
| Cấu trúc tinh thể | Trực thoi |
| Nhiệt hóa học | |
| Dược lý học | |
| Dữ liệu chất nổ | |
| Các nguy hiểm | |
| Nguy hiểm chính | độ độc cao |
| NFPA 704 |
|
| PEL | [1] |
| Các hợp chất liên quan | |
| Cation khác | Beryli cyanide Magie cyanide Stronti cyanide Bari cyanide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Calci cyanide còn được gọi là cyanide đen,[2] là một hợp chất vô cơ có công thức hóa học Ca(CN)2. Nó là một chất rắn màu trắng, mặc dù nó hiếm khi được quan sát ở dạng tinh khiết. Các mẫu trên thị trường có thể có màu xám đen. Đó là muối calci của ion cyanide. Nó thủy phân dễ dàng (ngay cả trên không khí ẩm) để giải phóng hydro cyanide. Giống như các muối cyanide khác, nó rất độc.[3]
Điều chế
[sửa | sửa mã nguồn]Calci cyanide có thể được điều chế bằng cách xử lý bột calci oxit với axit cyanhydric khan sôi và có xúc tác như amonia hoặc nước để giảm thiểu sự mất mát axit cyanhydric bằng phản ứng trùng hợp. Nó cũng có thể được điều chế bằng cách phản ứng axit cyanhidric lỏng với calci carbide. Ngoài ra calci cyanide có thể được điều chế bằng cách phản ứng với axit cyanhydric với vôi sống (CaO) ở nhiệt độ cao khoảng 400 ℃. Ở nhiệt độ cao hơn khoảng 600 ℃, calci cyanamit được hình thành thay vào đó.[4] Vật liệu được chuẩn bị thường không tinh khiết do các chất dẫn xuất polyme của hydro cyanide, do đó sản phẩm thường có màu đen.
Phản ứng
[sửa | sửa mã nguồn]Thủy phân calci cyanide dễ dàng để tạo ra khí hydro cyanide. Nó phản ứng với các chất oxy hóa. Calci cyanide cũng đôi khi được sử dụng để sản xuất amoni cyanide bằng cách phản ứng với amoni cacbonat.
- Ca(CN)2 + (NH4)2CO3 → 2NH4CN + CaCO3
Ứng dụng
[sửa | sửa mã nguồn]Calci cyanide được sử dụng hầu hết trong ngành khai thác mỏ. Nó hoạt động như một nguồn cyanide không tốn kém trong nhiều hoạt động rửa trôi hoặc vat để lấy các kim loại quý như vàng và bạc từ quặng của chúng.[5] Nó làm điều này bằng cách tạo ra các phức hợp liên kết với các kim loại tách chúng ra khỏi các quặng.[6] Nó được phân phối ở dạng bột rắn hoặc dưới dạng lỏng[5]. Sự độc hại cao của calci cyanide khi tiếp xúc, hít vào hoặc nuốt phải làm cho nó có ích như một loại thuốc diệt chuột. Ví dụ, nó đã được sử dụng trong việc quản lý quần thể các con nhím Ấn Độ (Hystrix indica)[7]. Độc tính của nó đã được khai thác tương tự như một thuốc trừ sâu[8]. Tuy nhiên, tính độc hại cao của nó làm cho nó không thuận lợi trong nhiều trường hợp và đôi khi các hóa chất khác ít gây tổn hại hơn được sử dụng thay thế.[7] Nó cũng được sử dụng trong việc tạo ra hydro cyanide, amoni cyanide và muối ferrocyanide.
Tham khảo
[sửa | sửa mã nguồn]- ^ “CALCIUM CYANIDE”. Truy cập 21 tháng 12 năm 2017.
- ^ "Calcium Cyanide." Merriam-Webster Dictionary. 2001. http://www.merriam-webster.com/dictionary/calcium%20cyanide (truy cập ngày 22 tháng 4 năm 2012).
- ^ Ernst Gail, Stephen Gos, Rupprecht Kulzer, Jürgen Lorösch, Andreas Rubo and Manfred Sauer "Cyano Compounds, Inorganic" Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2004. doi:10.1002/14356007.a08_159.pub2
- ^ . "Production of Hydrocyanic Acid" United States Patent Office. 1933.(accessed ngày 22 tháng 4 năm 2012).
- ^ a b "Use of Cyanide for the Gold Industry" International Cyanide Management Code for the Use of Cyanide in the Gold. 2011. http://www.cyanidecode.org/cyanide_use.php Lưu trữ 2012-02-29 tại Wayback Machine (accessed ngày 22 tháng 4 năm 2012).
- ^ . "coordination compound" Encyclopædia Britannica. Encyclopædia Britannica Online Academic Edition. 2012. http://www.britannica.com/EBchecked/topic/136410/coordination-compound.
- ^ a b . "Evaluation of Aluminium Phosphide Fumigation for the Control of Indian Crested Porcupine (Hystrix indica) in Scrublands*. 2008.
- ^ . "CALCIUM CYANIDE FOR CHINCH-BUG CONTROL" UNIVERSITY OF ILLINOIS Agricultural Experiment Station. 1924.
 GIẢM
33%
GIẢM
33%
 GIẢM
29%
GIẢM
29%
 GIẢM
17%
GIẢM
17%
 GIẢM
24%
GIẢM
24%


![[Review sách] Những giấc mơ ở hiệu sách Morisaki - Chốn bình yên gắn kết tâm hồn đồng điệu](https://down-tx-vn.img.susercontent.com/edd27e656c28712031d4105f97d6d801.webp)



