Đồng(II) acetat
| Đồng(II) acetat | |
|---|---|
 Mẫu đồng(II) acetat hydrat | |
 | |
 Hai góc nhìn cấu trúc của đồng(II) acetat hydrat | |
| Danh pháp IUPAC | Tetra-μ2-acetatodiaquadicopper(II) |
| Tên khác | Đồng(II) etanoat Cupric acetat Đồng điacetat Đồng đietanoat Verdigris Cuprum(II) acetat Cuprum điacetat Cuprum(II) etanoat Cuprum đietanoat |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| UNII | |
| Thuộc tính | |
| Công thức phân tử | Cu(CH3COO)2 |
| Khối lượng mol | 181,63524 g/mol (khan) 199,65052 g/mol (1 nước) |
| Bề ngoài | Chất rắn tinh thể xanh lá cây đậm |
| Mùi | không mùi (1 nước) |
| Khối lượng riêng | 1,882 g/cm³ (1 nước) |
| Điểm nóng chảy | Không xác định[1] |
| Điểm sôi | 240 °C (513 K; 464 °F) |
| Độ hòa tan trong nước | 1 nước: 7,2 g/100 mL (nước lạnh) 20 g/100 mL (nước nóng) |
| Độ hòa tan | Tan trong cồn Tan ít trong ete và glycerol |
| Chiết suất (nD) | 1,545 (1 nước) |
| Cấu trúc | |
| Cấu trúc tinh thể | Đơn nghiêng |
| Các nguy hiểm | |
| NFPA 704 |
|
| Chỉ dẫn R | 22–36/37/38–50/53 |
| Chỉ dẫn S | 26–60–61 |
| Điểm bắt lửa | Không cháy |
| PEL | TWA 1 mg/m³ (tính theo Cu)[2] |
| LD50 | 710 mg/kg (oral, rat)[3] |
| REL | TWA 1 mg/m³ (tính theo Cu)[2] |
| IDLH | TWA 100 mg/m³ (tính theo Cu)[2] |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Đồng(II) acetat, còn gọi là cupric acetat, là một hợp chất hữu cơ với công thức hóa học Cu(C2H3O2)2 (hoặc Cu(OAc)2, OAc− là acetat (CH
3CO−
2). Dẫn xuất ngậm nước, trong đó có chứa một phân tử nước cho mỗi nguyên tử Cu, là có sẵn. Cu(OAc)2 khan là chất rắn tinh thể màu xanh lá cây đậm, trong khi Cu2(OAc)4(H2O)2 có màu xanh lá cây hơi xanh biển hơn. Từ xa xưa, một số dạng của đồng(II) acetat đã được sử dụng như thuốc diệt nấm và các chất màu xanh lá cây. Ngày nay, đồng(II) acetat được sử dụng như là thuốc thử cho sự tổng hợp của nhiều hợp chất vô cơ và hữu cơ[4]. Đồng(II) acetat, giống như tất cả các hợp chất đồng, phát ra một ánh sáng màu lục lam trong ngọn lửa.
Cấu trúc
[sửa | sửa mã nguồn]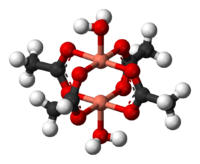
Đồng(II) acetat monohydrat có cấu trúc đối xứng cũng xuất hiện ở Rh(II) và Cr(II) tetracetat[5][6]. Một nguyên tử oxy trên mỗi acetat được liên kết với một đồng tại 1,97 Å (197 pm). Hoàn thành hình cầu phối hợp là hai phối tử nước, với khoảng cách Cu–O khoảng cách 2,20 Å (220 pm). Các nguyên tử đồng tọa độ 2, 5 bị ngăn cách với một khoảng 2,65 Å (265 pm), gần với việc tách Cu–Cu trong đồng kim loại[7]. Hai trung tâm đồng tương tác với nhau dẫn đến sự giảm sút của mômen từ ở 90 K, Cu2(OAc)4(H2O)2 là chất nghịch từ do việc hủy của hai spin đối lập. Cu2(OAc)4(H2O)2 là một bước quan trọng trong sự phát triển của các lý thuyết hiện đại cho các chất phản sắt từ[8].
Tổng hợp
[sửa | sửa mã nguồn]Đồng(II) acetat được điều chế công nghiệp bằng cách nung nóng đồng(II) hydroxide hoặc đồng(II) cacbonat với axit acetic[4].
Hợp chất liên quan
[sửa | sửa mã nguồn]Nung nóng hỗn hợp đồng(II) acetat khan và kim loại đồng tạo ra đồng(I) acetat:[9][10]
- Cu + Cu(OAc)2 → 2CuOAc
Không giống như đẫn xuất đồng(II), đồng(I) acetat, không màu và nghịch từ.
"Đồng(II) acetat base" được điều chế bằng cách trung hòa dung dịch đồng(II) acetat. Acetat base là kém hòa tan. Chất này này là một thành phần của xanh đồng, chất màu xanh lục lam hình thành trên đồng trong quá trình tiếp xúc lâu với khí quyển.
Sử dụng trong tổng hợp hóa học
[sửa | sửa mã nguồn]Đồng(II) acetat đã tìm thấy một số sử dụng như một tác nhân oxy hóa trong tổng hợp hữu cơ. Trong phản ứng Eglinton, Cu2(OAc)4 được sử dụng để ghép nối các alkyne đầu cuối, tạo ra 1,3-diyne:[11][12]
- Cu2(OAc)4 + 2RC≡CH → 2CuOAc + RC≡C−C≡CR + 2HOAc
Phản ứng thực hiện thông qua chất trung gian đồng(I) acetylua, mà sau đó bị oxy hóa bởi đồng (II) acetat, giải phóng gốc acetylua ra. Một phản ứng có liên quan liên quan đến acetylua đồng là sự tổng hợp của ynamines, các alkyne cuối với các nhóm amin bằng Cu2(OAc)4.[13] Nó đã được sử dụng cho hydroaminat hóa acrylonitrile[14].
Nó kết hợp với điasen trioxit để tạo thành đồng(II) acetoasenit, một loại thuốc trừ sâu và thuốc diệt nấm mạnh mẽ được gọi là Paris xanh hoặc Schweinfurt xanh.
Tham khảo
[sửa | sửa mã nguồn]- ^ http://pubs.acs.org/doi/pdf/10.1021/ed053p397
- ^ a b c “NIOSH Pocket Guide to Chemical Hazards #0150”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ http://www.sargentwelch.com/pdf/msds/Copper_II_Acetate_212.00.pdf
- ^ a b Richardson, H. Wayne. “Copper Compounds”. Bách khoa toàn thư Ullmann về Hóa chất công nghiệp. Weinheim: Wiley-VCH. doi:10.1002/14356007.a07_567. ISBN 978-3-527-30673-2.
- ^ Van Niekerk, J. N.; Schoening, F. R. L. (1953). “X-Ray Evidence for Metal-to-Metal Bonds in Cupric and Chromous Acetate”. Nature. 171 (4340): 36–37. doi:10.1038/171036a0.
- ^ Wells, A. F. (1984). Structural Inorganic Chemistry. Oxford: Clarendon Press.[thiếu ISBN]
- ^ Catterick, J.; Thornton, P. (1977). “Structures and physical properties of polynuclear carboxylates”. Adv. Inorg. Chem. Radiochem. 20: 291–362. doi:10.1016/s0065-2792(08)60041-2.
- ^ Carlin, R. L. (1986). Magnetochemistry. Berlin: Springer.[thiếu ISBN]
- ^ Kirchner, S. J.; Fernando, Q. (1980). “Copper(I) Acetate”. Inorg. Synth. 20: 53–55. doi:10.1002/9780470132517.ch16.
- ^ Parish, E. J.; Kizito, S. A. (2001). “Copper(I) Acetate”. Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rc193.
- ^ Stöckel, K.; Sondheimer, F. “[18]Annulene”. Organic Syntheses. 54: 1. doi:10.15227/orgsyn.054.0001.; Collective Volume, 6, tr. 68
- ^ Campbell, I. D.; Eglinton, G. “Diphenyldiacetylene”. Organic Syntheses. 45: 39. doi:10.15227/orgsyn.045.0039.; Collective Volume, 5, tr. 517
- ^ Vogel, P.; Srogl, J. (2005). “Copper(II) Acetate”. EROS Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rc194.pub2. ISBN 978-0-470-84289-8..
- ^ Heininger, S. A. “3-(o-Chloroanilino)propionitrile”. Organic Syntheses. 38: 14. doi:10.15227/orgsyn.038.0014.; Collective Volume, 4, tr. 146
Liên kết ngoài
[sửa | sửa mã nguồn]- Copper.org – Other Copper Compounds Lưu trữ 2013-08-15 tại Wayback Machine 5 Feb. 2006
- Infoplease.com – Paris green 6 Feb. 2006
- Verdigris – History and Synthesis 6 Feb. 2006
- Australian - National Pollutant Inventory 8 Aug. 2016
- USA NIH National Center for Biotechnology Information 8 Aug. 2016
 GIẢM
26%
GIẢM
26%
 GIẢM
14%
GIẢM
14%
 GIẢM
32%
GIẢM
32%
![[Review Sách] Quân Vương](https://down-bs-vn.img.susercontent.com/vn-11134207-7ras8-m3xseo54r38h50.webp) GIẢM
32%
GIẢM
32%
 GIẢM
40%
GIẢM
40%
 GIẢM
20%
GIẢM
20%





