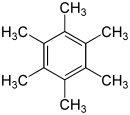
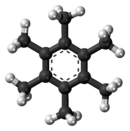
Hexamethylbenzen
Bài viết này là một bản dịch thô từ ngôn ngữ khác. Đây có thể là kết quả của máy tính hoặc của người chưa thông thạo dịch thuật. |
| Hexamethylbenzen | |||
|---|---|---|---|
| |||
| Tên khác | 1,2,3,4,5,6-Hexamethylbenzene Mellitene | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| ChEBI | |||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| Thuộc tính | |||
| Bề ngoài | Tinh thể trắng dạng bột | ||
| Khối lượng riêng | 1,0630 g cm−3 | ||
| Điểm nóng chảy | 165.6 ± 0.7 °C | ||
| Điểm sôi | 265,2 °C (538,3 K; 509,4 °F) | ||
| Độ hòa tan trong nước | Không tan | ||
| Độ hòa tan | acetic acid, acetone, benzene, chloroform, diethyl ether, ethanol | ||
| Các nguy hiểm | |||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Hexamethyl benzen, còn gọi là mellitene là một hydrocarbon với công thức phân tử C12H18 và công thức cấu trúc ngưng tụ C6(CH3)6. Nó là một hợp chất thơm và dẫn xuất của benzen: nó được tạo thành từ việc thay thế sáu nguyên tử hydro trong benzen bằng sáu nhóm methyl. Năm 1929 Kathleen Lonsdale báo cáo cấu trúc tinh thể của hexamethyl benzen chứng tỏ rằng vòng trung tâm là hình lục giác phẳng [1] do đó kết thúc một cuộc tranh luận đang diễn ra về các tham số vật lý của hệ thống benzen. Đây là kết quả có ý nghĩa lịch sử cả trong lĩnh vực tinh thể học tia X và để hiểu được tính thơm.[2][3]
Hợp chất này có thể được điều chế bằng cách phản ứng phenol với methanol ở nhiệt độ cao khi có mặt chất xúc tác rắn thích hợp như alumina [4][5][6] Cơ chế của quá trình này đã được nghiên cứu rộng rãi,[7][8][9][10] với một số trung gian đã được xác định.[6][11][12] Sự trimer hóa của dimethylacetylen cũng tạo thành hexamethylbenzen khi có mặt của một chất xúc tác thích hợp.[13][14] Hexamethylbenzen có thể bị oxy hóa thành acid mellit,[15] một hợp chất được tìm thấy trong tự nhiên dưới dạng muối nhôm trong loại khoáng vật hiếm mellite.[16] Hexamethyl benzen còn có thể được dùng làm phối tử trong các hợp chất cơ kim. Một ví dụ về hợp chất cơ rutheni cho thấy sự thay đổi cấu trúc trong phối tử sẽ dẫn đến sự thay đổi trạng thái oxy hóa của kim loại trung tâm,[17][18] mặc dù không tìm thấy sự thay đổi này trong các hợp chất cơ sắt tương tự.[17]
Vào năm 2016, một bài báo trong Angewandte Chemie International Edition cho thấy cấu trúc tinh thể của dication (cation 2+) hexamethylbenzen có dạng hình chóp,[19] trong đó một nguyên tử carbon có một tương tác liên kết với sáu nguyên tử carbon khác.[20][21] Cấu trúc này là "chưa từng có", vì thông thường carbon có hóa trị tối đa là bốn. Bài báo này cũng đã thu hút sự chú ý của New Scientist,[20] Chemical & Engineering News,[21] và Science News.[22]. Cấu trúc không vi phạm quy tắc bát tử vì các liên kết carbon-carbon không phải là các liên kết hai electron, và vì vậy có giá trị trong giảng dạy để minh họa việc một nguyên tử cacbon "có thể liên kết trực tiếp với hơn bốn nguyên tử khác". Steven Bachrach đã chứng minh rằng hexamethylbenzen là hợp chất siêu-phối trí nhưng không phải hợp chất siêu-hóa trị, và điều này cũng giải thích tính thơm của nó.[23] Ý tưởng về mô tả liên kết hóa học trong các hợp chất như thế này từ góc nhìn của hóa học các hợp chất cơ kim đã được đề xuất vào năm 1975,[24] ngay sau khi C
6(CH
3)2+
6 lần đầu được phát hiện.[25][26][27]
Danh pháp và đặc điểm
[sửa | sửa mã nguồn]Theo Blue Book, hóa chất này có tên hệ thống là 1,2,3,4,5,6-hexamethylbenzen. Tuy nhiên, tên của phần định vị (locant) không cần thiết, vì tên gọi hexamethyl benzen tương ứng duy nhất một chất và do đó cũng là tên IUPAC chính thức cho hợp chất này.[28] Đây là một hợp chất thơm, với sáu electron π (thỏa mãn quy tắc Hückel khi n = 1) bất định xứ (delocalized) trong một hệ vòng thơm; mỗi nguyên tử carbon của vòng ở trạng thái lai hóa sp2 và có dạng tam giác phẳng đều, trong khi mỗi carbon của nhóm methyl có dạng tứ diện với lai hóa sp3, phù hợp với mô tả cấu trúc thực nghiệm của nó. Khi kết tinh lại trong dung môi ethanol, hexamethyl benzen rắn có dạng tinh thể trực thoi hình kim hoặc lăng kính màu trắng hoặc không màu, có nhiệt độ nóng chảy là 165–166 °C,[5] nhiệt độ sôi 268 °C và khối lượng riêng 1,0630 g cm−3.[29] Các tinh thể màu vàng cam của hỗn hợp picryl chloride và hexamethyl benzen theo tỉ lệ 1: 1 có cấu trúc gồm các lớp xen kẽ nhau, với mỗi lớp chỉ bao gồm một trong hai thành phần trên,[30] có thể là do sự xen phủ các orbital π của các vòng thơm. Nó không hòa tan trong nước, nhưng hòa tan trong dung môi hữu cơ như benzen hay ethanol.[29]
Hexamethylbenzen đôi khi được gọi là mellitene,[29] có nguồn gốc từ mellite, tên của một loại khoáng chất hiếm có màu mật ong (μέλι meli (GEN μέλιτος melitos) là từ Hy Lạp cho mật ong).[31] Mellit bao gồm muối nhôm ở dạng ngậm nước của acid benzenhexacarboxylic (acid mellithic), với công thức Al
2[C
6(CO
2)
6]•16H
2O.[32] Acid mellit có thể được điều chế từ khoáng chất này[33] và sau đó tạo thành mellitene thông qua sự khử. Ngược lại, mellitene có thể được oxy hóa để tạo thành acid mellit:[15]

Cấu trúc
[sửa | sửa mã nguồn]Năm 1927 Kathleen Lonsdale xác định cấu trúc rắn của hexamethyl benzen từ tinh thể được cung cấp bởi Christopher Kelk Ingold.[3] Phân tích nhiễu xạ tia X của cô đã được xuất bản trong Nature[34] và sau đó bài báo đã được mô tả là "đáng chú ý... vào lúc bấy giờ".[3] Lonsdale mô tả công trình này trong cuốn Crystals and X-Rays,[35] của bà. Giải thích rằng bà nhận ra mặc dù ô đơn vị thuộc hệ ba nghiêng, mô hình nhiễu xạ lại có tính đối xứng giả-lục giác, cho phép thu hẹp số lượng các cấu trúc khả dĩ để từ đó, bằng phương pháp thử-và-sai, đưa ra mô hình đúng đắn nhất. Nghiên cứu này cho thấy hexamethyl benzen có cấu trúc phẳng và khoảng cách các liên kết carbon-carbon trong vòng benzen là như nhau,[2] cung cấp bằng chứng quan trọng để hiểu được về tính thơm.
Điều chế
[sửa | sửa mã nguồn]Năm 1880, Joseph Achille Le Bel và William H. Greene[36] đã mô tả phản ứng tổng hợp một nồi hexamethylbenzen (one-pot synthesis) với xúc tác kẽm chloride từ methanol.[37]. Tại điểm nóng chảy của chất xúc tác (283 °C), phản ứng có năng lượng tự do Gibbs (ΔG) -1090 kJ mol−1 và có thể được viết dưới dạng phương trình sau:[37]
- 15 CH
3OH → C
6(CH
3)
6 + 3 CH
4 + 15 H
2O
Le Bel và Greene giải thích quá trình này là sự hương phương hóa (aromatisation) bằng cách ngưng tụ các đơn vị metylen được tạo thành bởi sự dehydrate hóa các phân tử methanol, rồi sau đó là sự methyl hóa Friedel-Crafts của vòng benzen vừa tạo thành với chloromethan (được tạo thành ngay trong bình phản ứng). Tuy nhiên, sản phẩm chủ yếu là hỗn hợp các hydrocarbon bão hòa.[38] Hexamethylbenzen cũng là sản phẩm phụ trong tổng hợp alkyl hóa Friedel-Crafts của durene từ p-xylen.[39]
Hexamethylbenzen thường được điều chế trong pha khí ở nhiệt độ cao hơn chất xúc tác rắn. Một phương pháp sớm để chuẩn bị hexamethylbenzen liên quan phản ứng một hỗn hợp của aceton và hơi methanol trên một chất xúc tác alumina ở 400 °C.[40]. Kết hợp phenol với methanol trên alumina trong khí quyển cacbon dioxide khô ở 410-440 °C cũng tạo ra hexamethylbenzen,[4] mặc dù là một phần của hỗn hợp anisole (methoxybenzen), các cresol (methylphenol) và các phenol bị methyl hóa (methylated phenol) khác.[11] Việc điều chế hợp chất hữu cơ, sử dụng methanol và phenol với xúc tác alumina ở 530 °C, cho hiệu suất xấp xỉ 66% [5] mặc dù tổng hợp trong các điều kiện khác nhau cũng đã được báo cáo.
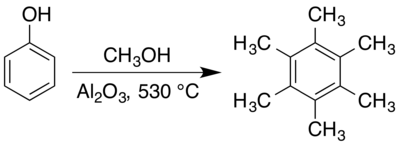
Các cơ chế phản ứng qua trung gian bề mặt này đã được điều tra, với một mục tiêu để đạt được sự kiểm soát tốt hơn đối với kết quả của phản ứng,[8][41] đặc biệt là trong việc tìm kiếm ortho-methyl hóa chọn lọc [9][10][42][43] Cả hai anisole và pentamethylbenzen đều được báo cáo là các chất trung gian trong quá trình này. Valentin Koptyug và các đồng nghiệp phát hiện ra rằng cả hai đồng phân hexamethylcyclohexadienon (2,3,4,4,5,6- và 2,3,4,5,6,6-) đều là các chất trung gian trong quá trình này, chuyển sang methyl để hình thành bộ khung 1,2,3,4,5,6-hexamethylbenzen carbon..[7][12]

Sự trimer hóa của but-2-yn (dimethylacetylene) có thể tạo thành hexamethylbenzen.[44] Phản ứng này được xúc tác bởi triphenylchromi tri-tetrahydrofuranat[13] hoặc bởi một phức hợp của triisobutylaluminium và titani tetrachloride.[14]
Sử dụng
[sửa | sửa mã nguồn]Hexamethylbenzen có nhiều ứng dụng trong các lĩnh vực nghiên cứu hóa học. Quá trình oxy hóa của nó tạo thành 2,3,4,5,6,6-hexamethyl-2,4-cyclohexadienon (theo báo cáo là một chất trung gian trong sự hình thành từ phenol [7][12]) đã được báo cáo trong Organic Syntheses sử dụng acid trifluoroperacetic hoặc dung dịch acid hydro peroxide:[45]

Nó cũng đã được sử dụng như một dung môi cho quang phổ 3He-NMR.[46]
Cũng như với chính benzen, hệ thống thơm giàu electron trong hexamethylbenzen cho phép nó hoạt động như một phối tử trong hóa học cơ kim.[16] Tính chất trao đổi điện tử của các nhóm methyl - cả hai đều có sáu trong số chúng riêng biệt và có sáu cặp meta trong số chúng - tăng cường cơ bản của vành đai trung tâm bằng sáu đến bảy bậc độ lớn so với benzen.[47] Các ví dụ về phức hợp như vậy đã được báo cáo cho một loạt các trung tâm kim loại, bao gồm cobalt,[48] chromi,[13] sắt,[17] rheni,[49] rhodi,[48] rutheni,[18] và titani.[14] Các cation được biết đến của phức hợp coban và rhodi với hexamethylbenzen có dạng [M(C
6(CH
3)
6)
2]n+ (M = Co, Fe, Rh, Ru; n = 1, 2), trong đó trung tâm kim loại bị ràng buộc bởi các electron π của hai phân tử aren và có thể dễ dàng được tổng hợp từ các muối kim loại thích hợp bằng cách trao đổi ligand, ví dụ:[48]
- CoBr
2 + 2 AlBr
3 → [Co(C
6(CH
3)
6)
2]2+
+ 2 AlBr−
4
Các phức hợp có thể trải qua phản ứng oxy hóa khử. Việc xử lý kim loại rhodi và cobalt được giảm một electron với một kim loại hoạt động thích hợp (nhôm cho hệ thống cobalt, kẽm cho rhodi) và phương trình mô tả các phản ứng trong hệ thống coban như sau:[48]
- 3 [Co(C
6(CH
3)
6)
2]2+
+ Al → 3 [Co(C
6(CH
3)
6)
2]+
+ Al3+

Left: n = 2, [RuII(ɳ6-C6(CH3)6)2]2+
Right: n = 0, [Ru0(ɳ4-C6(CH3)6)(ɳ6-C6(CH3)6)]
Các nhóm metyl được bỏ qua để làm rõ. Các cặp electron liên quan đến sự liên kết carbon-ruteni là màu đỏ.
Trong lĩnh vực hóa học cơ rutheni (organoruthenium chemistry), sự chuyển đổi oxy hóa - khử của quá trình khử tương tự hai electron của dication và sản phẩm trung tính của nó xảy ra ở -1,02 V trong acetonitrile[17] và đi kèm với sự thay đổi cấu trúc.[18][50] Hapticity (xúc giác) của một trong các hợp chất hexamethylbenzen thay đổi với trạng thái oxy hóa của trung tâm rutheni, việc phân chia [Ru(ɳ6-C6(CH3)6)2]2+ bị giới hạn thành [Ru(ɳ4-C6(CH3)6)(ɳ6-C6(CH3)6)],[18] với sự thay đổi cấu trúc cho phép mỗi phức hợp tuân theo quy tắc 18-electron và tối đa hóa sự ổn định.
Phức hợp sắt (II) tương đương bị giảm đi một lần điện tử (ở -0,48 V ở ethanol trong nước), nhưng sự giảm electron hai lần (ở -1,46 V) là không thể đảo ngược,[17] cho thấy sự thay đổi cấu trúc khác với Được tìm thấy trong hệ thống rutheni.
Dication
[sửa | sửa mã nguồn]
6(CH
3)2+
6
Sự cô lập của một ion với thành phần C
6(CH
3)
6H+
lần đầu tiên được báo cáo từ các nghiên cứu về hexamethyl Dewar benzen thập niên 1960;[51] một cấu trúc hình chóp được gợi ý dựa trên bằng chứng chứng cứ NMR[52] và sau đó được hỗ trợ bởi dữ liệu cấu trúc tinh thể rối loạn.[19] crystal structure data.[53] Vào đầu những năm 1970, công trình lý thuyết do Hepke Hogeveen dẫn đầu dự đoán sự tồn tại của một kim cương pyicidal dication C
6(CH
3)2+
6, và gợi ý này đã sớm được ủng hộ bằng các bằng chứng thực nghiệm.[25][26][27] Nghiên cứu quang phổ đối với quá trình oxy hóa hai benzen của benzen ở nhiệt độ rất thấp (dưới 4 K) cho thấy rằng một hộp xúc tác lục giác hình thành và nhanh chóng sắp xếp lại thành một cấu trúc kim tự tháp:[54]
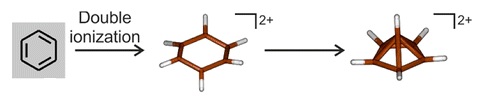

6(CH
3)2+
6 Có một khuôn khổ hình chóp penthagal-sắp xếp lại
Sự oxy hóa trực tiếp, hai electron của hexamethylbenzen sẽ dẫn đến sự sắp xếp gần như giống hệt nhau với kim tự tháp, nhưng những nỗ lực để tổng hợp nó bằng phương pháp này đã không thành công.[19] Tuy nhiên, một sửa đổi của phương pháp tiếp cận Hogeveen đã được báo cáo vào năm 2016, cùng với việc xác định cấu trúc tinh thể chất lượng cao của [C
6(CH
3)
6][SbF
6]
2•HSO
3F. Các kim tự tháp cao khoảng 1,18 Ångström, và mỗi nhóm methyl trên vòng nằm hơi trên mặt phẳng cơ sở [19] để cung cấp cho một hình học tứ diện đảo ngược hơi cho carbon của các cơ sở của kim tự tháp. Phương pháp chuẩn bị bao gồm xử lí epoxide hexamethyl Dewar benzene với acod magic, chính thức tóm tắt một anion oxide (O2−
) để hình thành việc dication:[19]

Mặc dù bằng chứng quang phổ gián tiếp và các tính toán trước đây đã chỉ ra sự tồn tại của chúng, việc phân lập và xác định cấu trúc của một hình thái có chứa carbon sáu phối trí chỉ liên kết với các nguyên tử carbon khác chưa từng có.[19] Và nó đã thu hút được sự chú ý của Chemical & Engineering News,[21] New Scientist,[20] Science News,[22] và ZME Science.[55] Nguyên tử carbon ở đỉnh kim tự tháp được liên kết với sáu nguyên tử khác, một sự bố trí bất thường như hóa trị tối đa thông thường cho nguyên tố này là bốn. Phân tử này có tính thơm và tránh được octet carbon vì chỉ có tổng cộng 6 electron trong năm liên kết giữa gốc kim tự tháp và đỉnh của nó. Tức là, mỗi cạnh dọc của kim tự tháp chỉ là một liên kết một phần chứ không phải là một liên kết cộng hóa trị thông thường có thể có hai điện tử chia sẻ giữa hai nguyên tử. Mặc dù carbon hàng đầu có gắn kết với sáu loại khác, nhưng nó sử dụng tổng cộng không quá tám electron. [[24]
6(CH
3)2+
6, vẽ bởi Steven Bachrach[23]
Right: Phức chất cơ kim tương tự [(η5
–C
5(CH
3)
5)Zn(CH
3)][56]
6(CH
3)2+
6, vẽ bởi Steven Bachrach[23]
Right: Phức chất cơ kim tuơng tự [(η5
–C
5(CH
3)
5)Zn(CH
3)][56]
Nhà hoá học tính toán Steven Bachrach đã thảo luận về việc kéo dài, lưu ý rằng các liên kết yếu hình thành các cạnh thẳng đứng của kim tự tháp, được thể hiện dưới dạng các đường nét đứt trong cấu trúc mà ông vẽ, có thứ tự liên kết Wiberg khoảng 0,54; Tiếp sau đó, tổng trật tự liên kết là 5 × 0,54 + 1 = 3,7 <4, và do đó các loài trên không phải là “siêu hóa trị” (hypervalent) nhưng nó lại là “siêu phối trí” (hypercoordinate).[23] Sự khác nhau trong liên kết trong quá trình phân chia - vòng có tính chất thơm và các cạnh thẳng đứng là các liên kết một phần yếu - được phản ánh trong các biến thể của độ dài liên kết carbon-carbon: các liên kết vòng là 1.439-1.445 Å, các liên kết với các nhóm methyl Là 1.479-1.489 Å,, và các cạnh thẳng đứng là 1.694–1.715 Å.[19]. Bachrach đã làm hợp lý tính thơm ba chiều của việc dication bằng cách xem xét nó như là bao gồm các vòng C
5(CH
3)+
5 là chô bốn bốn điện tử và đứng đầu bởi CCH +
3, cung cấp hai điện tử, cho tổng cộng sáu điện tử trong lồng thơm, phù hợp với quy tắc của Hückel chon = 1.[23] Từ quan điểm của hóa học kim loại hữu cơ, loài này có thể được xem là [(η5
–C
5(CH
3)
5)C(CH
3)]
.[24]Điều này đáp ứng các nguyên tắc octet bằng cách ràng buộc một trung tâm carbon (IV) (C4 +
) Với anion η5-pentamethylcyclopentadienyl thơm (chất cho sáu electron) và anion methyl (chất cho hai electron), tương tự như cách thức monozinc monomer pha khí [(η5
–C
5(CH
3)
5)Zn(CH
3)],, có cùng các phối tử gắn với một tâm kẽm (II) (Zn2 +
) thỏa mãn quy luật 18 điện tử trên kim loại[56][57]
Nhà hóa học Dean Tantillo từ Đại học California, Davis, nhận xét với Science News rằng "điều cực kỳ quan trọng là mọi người nhận ra rằng mặc dù chúng ta được dạy rằng carbon chỉ có bốn người bạn, carbon có thể được liên kết với hơn bốn nguyên tử" Và thêm rằng "carbon không phải là tạo ra sáu liên kết theo nghĩa mà chúng ta thường nghĩ đến một liên kết carbon-carbon như một liên kết hai electron." Moritz Malischewski, người thực hiện công việc với Konrad Seppelt, bình luận về Động lực để thực hiện công việc, nói: "Đó là tất cả về thách thức và khả năng các nhà khoa học kinh ngạc về những gì có thể có được"[20]
Tham khảo
[sửa | sửa mã nguồn]- ^ Lonsdale, Kathleen (1929). “The Structure of the Benzene Ring in Hexamethylbenzene”. Proc. R. Soc. A. 123 (792): 494–515. doi:10.1098/rspa.1929.0081.
- ^ a b Lydon, John (tháng 1 năm 2006). “A Welcome to Leeds” (PDF). Newsletter of the History of Physcis Group. Institute of Physics (19): 8–11.
- ^ a b c Lydon, John (tháng 7 năm 2006). “Letters” (PDF). Newsletter of the History of Physcis Group. Institute of Physics (20): 34–35.
- ^ a b Briner, E.; Plüss, W.; Paillard, H. (1924). “Recherches sur la déshydration catalytique des systèmes phénols-alcools”. Helv. Chim. Acta (bằng tiếng Pháp). 7 (1): 1046–1056. doi:10.1002/hlca.192400701132.
- ^ a b c Cullinane, N. M.; Chard, S. J.; Dawkins, C. W. C. (1955). “Hexamethylbenzene”. Organic Syntheses. 35: 73. doi:10.15227/orgsyn.035.0073.; Collective Volume, 4, tr. 520
- ^ a b Lỗi chú thích: Thẻ
<ref>sai; không có nội dung trong thẻ ref có tênPMB - ^ a b c Krysin, A. P.; Koptyug, V. A. (1969). “Reaction of phenols with alcohols on aluminum oxide II. The mechanism of hexamethylbenzene formation from phenol and methyl alcohol”. Russ. Chem. Bull. 18 (7): 1479–1482. doi:10.1007/BF00908756.
- ^ a b Ipatiew, W.; Petrow, A. D. (1926). “Über die katalytische Kondensation von Aceton bei hohen Temperaturen und Drucken. (I. Mitteilung)”. Ber. Dtsch. Chem. Ges. A/B (bằng tiếng Đức). 59: 2035–2038. doi:10.1002/cber.19260590859.
- ^ a b Kotanigawa, Takeshi; Yamamoto, Mitsuyoshi; Shimokawa, Katsuyoshi; Yoshida, Yuji (1971). “Methylation of Phenol over Metallic Oxides”. 44 (7): 1961–1964. doi:10.1246/bcsj.44.19611971. Chú thích journal cần
|journal=(trợ giúp) - ^ a b Kotanigawa, Takeshi (1974). “Mechanisms for the Reaction of Phenol with Methanol over the ZnO–Fe2O3 Catalyst”. Bull. Chem. Soc. Jpn. 47 (4): 950–953. doi:10.1246/bcsj.47.950.
- ^ a b Cullinane, N. M.; Chard, S. J. (1945). “215. The action of methanol on phenol in the presence of alumina. Formation of anisole, methylated phenols, and hexamethylbenzene”. J. Chem. Soc.: 821–823. doi:10.1039/JR9450000821.
- ^ a b c Shubin, V. G.; Chzhu, V. P.; Korobeinicheva, I. K.; Rezvukhin, A. I.; Koptyug, V. A. (1970). “UV, IR, AND PMR spectra of hydroxyhexamethylbenzenonium ions”. Russ. Chem. Bull. 19 (8): 1643–1648. doi:10.1007/BF00996497.
- ^ a b c Zeiss, H. H.; Herwig, W. (1958). “Acetylenic π-complexes of chromium in organic synthesis”. J. Am. Chem. Soc. 80 (11): 2913. doi:10.1021/ja01544a091.
- ^ a b c Franzus, B.; Canterino, P. J.; Wickliffe, R. A. (1959). “Titanium tetrachloride–trialkylaluminum complex—A cyclizing catalyst for acetylenic compounds”. J. Am. Chem. Soc. 81 (6): 1514. doi:10.1021/ja01515a061.
- ^ a b Wibaut, J. P.; Overhoff, J.; Jonker, E. W.; Gratama, K. (1941). “On the preparation of mellithic acid from hexa-methylbenzene and on the hexachloride of mellithic acid”. Recl. Trav. Chim. Pays-Bas. 60: 742–746. doi:10.1002/recl.19410601005.
- ^ a b Pampaloni, Guido (2010). “Aromatic hydrocarbons as ligands. Recent advances in the synthesis, the reactivity and the applications of bis(η6-arene) complexes”. Coord. Chem. Rev. 254 (5–6): 402–419. doi:10.1016/j.ccr.2009.05.014.
- ^ a b c d e Kotz, John C. (1986). “The Electrochemistry of Transition Metal Organometallic Compounds”. Trong Fry, Albert J.; Britton, Wayne E. (biên tập). Topics in Organic Electrochemistry. Springer Science & Business Media. tr. 83–176. ISBN 9781489920348.
- ^ a b c d e Huttner, Gottfried; Lange, Siegfried; Fischer, Ernst O. (1971). “Molecular Structure of Bis(Hexamethylbenzene)Ruthenium(0)”. Angew. Chem. Int. Ed. Engl. 10 (8): 556–557. doi:10.1002/anie.197105561.
- ^ a b c d e f g Malischewski, Moritz; Seppelt, Konrad (2017). “Crystal Structure Determination of the Pentagonal-Pyramidal Hexamethylbenzene Dication C6(CH3)62+”. Angew. Chem. Int. Ed. 56 (1): 368–370. doi:10.1002/anie.201608795.
- ^ a b c d Boyle, Rebecca (ngày 14 tháng 1 năm 2017). “Carbon seen bonding with six other atoms for the first time”. New Scientist (3108). Lưu trữ bản gốc ngày 16 tháng 1 năm 2017. Truy cập ngày 14 tháng 1 năm 2017.
- ^ a b c Ritter, Stephen K. (ngày 19 tháng 12 năm 2016). “Six bonds to carbon: Confirmed”. Chem. Eng. News. 94 (49): 13. Lưu trữ bản gốc ngày 9 tháng 1 năm 2017.
- ^ a b Hamers, Laurel (ngày 24 tháng 12 năm 2016). “Carbon can exceed four-bond limit”. Science News. 190 (13): 17. Lưu trữ bản gốc ngày 3 tháng 2 năm 2017.
- ^ a b c d e Bachrach, Steven M. (ngày 17 tháng 1 năm 2017). “A six-coordinate carbon atom”. comporgchem.com. Lưu trữ bản gốc ngày 19 tháng 1 năm 2017. Truy cập ngày 18 tháng 1 năm 2017.
- ^ a b c Hogeveen, Hepke; Kwant, Peter W. (1975). “Pyramidal mono- and dications. Bridge between organic and organometallic chemistry”. Acc. Chem. Res. 8 (12): 413–420. doi:10.1021/ar50096a004.
- ^ a b Hogeveen, Hepke; Kwant, Peter W. (1973). “Direct observation of a remarkably stable dication of unusual structure: (CCH3)62⊕”. Tetrahedron Lett. 14 (19): 1665–1670. doi:10.1016/S0040-4039(01)96023-X.
- ^ a b Hogeveen, Hepke; Kwant, Peter W.; Postma, J.; van Duynen, P. Th. (1974). “Electronic spectra of pyramidal dications, (CCH3)62+ và (CCH)62+”. Tetrahedron Lett. 15 (49–50): 4351–4354. doi:10.1016/S0040-4039(01)92161-6.
- ^ a b Hogeveen, Hepke; Kwant, Peter W. (1974). “Chemistry and spectroscopy in strongly acidic solutions. XL. (CCH3)62+, an unusual dication”. J. Am. Chem. Soc. 96 (7): 2208–2214. doi:10.1021/ja00814a034.
- ^ Favre, Henri A.; Powell, Warren H. (2013). Nomenclature of Organic Chemistry. IUPAC Recommendations and Preferred Name 2013. Royal Society of Chemistry. ISBN 9780854041824.
- ^ a b c Haynes, William M. biên tập (2016). CRC Handbook of Chemistry and Physics (ấn bản thứ 93). CRC Press. p. 3-296. ISBN 9781439880500.
- ^ Ross, Sidney D.; Bassin, Morton; Finkelstein, Manuel; Leach, William A. (1954). “Molecular Compounds. I. Picryl Chloride-Hexamethylbenzene in Chloroform Solution”. J. Am. Chem. Soc. 76 (1): 69–74. doi:10.1021/ja01630a018.
- ^ μέλι. Liddell, Henry George; Scott, Robert; A Greek–English Lexicon at the Perseus Project.
- ^ Wenk, Hans-Rudolf; Bulakh, Andrey (2016). “Organic Minerals”. Minerals – Their Constitution and Origin (ấn bản thứ 2). Cambridge University Press. ISBN 9781316423684.
- ^ Liebig, Justus (1844). “Lectures on orgnaic chemistry: delivered during the winter session, 1844, in the University of Giessen”. The Lancet. 2: 190–192.
- ^ Lonsdale, Kathleen (1928). “The Structure of the Benzene Ring”. Nature. 122 (810). doi:10.1038/122810c0.
- ^ Lonsdale, Kathleen (1948). Crystals and X-Rays. George Bell & Sons.
- ^ Le Bel, Joseph Achille; Greene, William H. (1880). “On the decomposition of alcohols, etc., by zinc chloride at high temperatures”. American Chemical Journal. 2: 20–26.
- ^ a b Chang, Clarence D. (1983). “Hydrocarbons from Methanol”. Catal. Rev. - Sci. Eng. 25 (1): 1–118. doi:10.1080/01614948308078874.
- ^ Olah, George A.; Doggweiler, Hans; Felberg, Jeff D.; Frohlich, Stephan; Grdina, Mary Jo; Karpeles, Richard; Keumi, Takashi; Inaba, Shin-ichi; Ip, Wai M.; Lammertsma, Koop; Salem, George; Tabor, Derrick (1984). “Onium Ylide chemistry. 1. Bifunctional acid-base-catalyzed conversion of heterosubstituted methanes into ethylene and derived hydrocarbons. The onium ylide mechanism of the C1→C2 conversion”. J. Am. Chem. Soc. 106 (7): 2143–2149. doi:10.1021/ja00319a039.
- ^ Smith, Lee Irvin (1930). “Durene”. Organic Syntheses. 10: 32. doi:10.15227/orgsyn.010.0032.; Collective Volume, 2, tr. 248
- ^ Reckleben, Hans; Scheiber, Johannes (1913). “Über eine einfache Darstellung des Hexamethyl-benzols”. Ber. Dtsch. Chem. Ges. (bằng tiếng Đức). 46 (2): 2363–2365. doi:10.1002/cber.191304602168.
- ^ Ipatiew, W. N.; Petrow, A. D. (1927). “Über die katalytische Kondensation des Acetons bei hohen Temperaturen und Drucken (II. Mitteilung)”. Ber. Dtsch. Chem. Ges. A/B (bằng tiếng Đức). 60: 753–755. doi:10.1002/cber.19270600328.
- ^ Kotanigawa, Takeshi; Shimokawa, Katsuyoshi (1974). “The Alkylation of Phenol over the ZnO–Fe2O3 Catalyst”. Bull. Chem. Soc. Jpn. 47 (6): 1535–1536. doi:10.1246/bcsj.47.1535.
- ^ Kotanigawa, Takeshi (1974). “The Methylation of Phenol and the Decomposition of Methanol on ZnO–Fe2O3 Catalyst”. Bull. Chem. Soc. Jpn. 47 (10): 2466–2468. doi:10.1246/bcsj.47.2466.
- ^ Weber, S. R.; Brintzinger, H. H. (1977). “Reactions of Bis(hexamethylbenzene)iron(0) with Carbon Monoxide and with Unsaturated Hydrocarbons”. J. Organomet. Chem. 127 (1): 45–54. doi:10.1016/S0022-328X(00)84196-0.
- ^ Hart, Harold; Lange, Richard M.; Collins, Peter M. (1968). “2,3,4,5,6,6-Hexamethyl-2,4-cyclohexadien-1-one”. Organic Syntheses. 48: 87. doi:10.15227/orgsyn.048.0087.; Collective Volume, 5, tr. 598
- ^ Saunders, Martin; Jiménez-Vázquez, Hugo A.; Khong, Anthony (1996). “NMR of 3He Dissolved in Organic Solids”. J. Phys. Chem. 100 (39): 15968–15971. doi:10.1021/jp9617783.
- ^ Bản mẫu:Kirk-Othmer
- ^ a b c d Fischer, Ernst Otto; Lindner, Hans Hasso (1964). “Über Aromatenkomplexe von Metallen. LXXVI. Di-hexamethylbenzol-metall-π-komplexe des ein- und zweiwertigen Kobalts und Rhodiums”. J. Organomet. Chem. (bằng tiếng Đức). 1 (4): 307–317. doi:10.1016/S0022-328X(00)80056-X.
- ^ Fischer, Ernst Otto; Schmidt, Manfred W. (1966). “Über Aromatenkomplexe von Metallen, XCI. Über monomeres und dimeres Bis-hexamethylbenzol-rhenium”. Chem. Ber. 99: 2206–2212. doi:10.1002/cber.19660990719.
- ^ Bennett, Martin A.; Huang, T.-N.; Matheson, T. W.; Smith, A. K. (1982). “16. (η6-Hexamethylbenzene)Ruthenium Complexes”. Inorg. Synth. 21: 74–78. doi:10.1002/9780470132524.ch16. ISBN 9780470132524.
- ^ Schäfer, W.; Hellmann, H. (1967). “Hexamethyl(Dewar Benzene) (Hexamethylbicyclo[2.2.0]hexa-2,5-diene)”. Angew. Chem. Int. Ed. Engl. 6 (6): 518–525. doi:10.1002/anie.196705181.
- ^ Paquette, Leo A.; Krow, Grant R.; Bollinger, J. Martin; Olah, George A. (1968). “Protonation of hexamethyl Dewar benzene and hexamethylprismane in fluorosulfuric acid – antimony pentafluoride – sulfur dioxide”. J. Am. Chem. Soc. 90 (25): 7147–7149. doi:10.1021/ja01027a060.
- ^ Laube, Thomas; Lohse, Christian (1994). “X-ray Crystal Structures of Two (deloc-2,3,5)-1,2,3,4,5,6- Hexamethylbicyclo[2.1.1]hex-2-en-5-ylium Ions”. J. Am. Chem. Soc. 116 (20): 9001–9008. doi:10.1021/ja00099a018.
- ^ Jašík, Juraj; Gerlich, Dieter; Roithová, Jana (2014). “Probing Isomers of the Benzene Dication in a Low-Temperature Trap”. J. Am. Chem. Soc. 136 (8): 2960–2962. doi:10.1021/ja412109h.
- ^ Puiu, Tibi (ngày 5 tháng 1 năm 2017). “Exotic carbon molecule has six bonds, breaking the four-bond limit”. zmescience.com. ZME Science. Lưu trữ bản gốc ngày 16 tháng 1 năm 2017. Truy cập ngày 14 tháng 1 năm 2017.
- ^ a b c Haaland, Arne; Samdal, Svein; Seip, Ragnhild (1978). “The molecular structure of monomeric methyl(cyclopentadienyl)zinc, (CH3)Zn(η-C5H5), determined by gas phase electron diffraction”. J. Organomet. Chem. 153 (2): 187–192. doi:10.1016/S0022-328X(00)85041-X.
- ^ Elschenbroich, Christoph (2006). “Organometallic Compounds of Groups 2 and 12”. Organometallics (ấn bản thứ 3). John Wiley & Sons. tr. 59–85. ISBN 9783527805143.
 GIẢM
50%
GIẢM
50%
 GIẢM
10%
GIẢM
10%
 GIẢM
20%
GIẢM
20%
 GIẢM
33%
GIẢM
33%
 GIẢM
21%
GIẢM
21%