Butan
| Butan | |||
|---|---|---|---|
 
| |||
| Tổng quan | |||
| Công thức hóa học | C4H10 | ||
| SMILES | CCCC | ||
| Phân tử gam | 58,08 g/mol | ||
| Bề ngoài | chất khí không màu | ||
| số CAS | [106-97-8] | ||
| Thuộc tính | |||
| Tỷ trọng và pha | 12.52 g/l, khí | ||
| Độ hoà tan trong nước | 6,1 mg/100 ml ở 20 °C) | ||
| Nhiệt độ nóng chảy | - 138,3 °C (134,9 K) | ||
| Nhiệt độ sôi | - 0,5 °C (272,7 K) | ||
| Nguy hiểm | |||
| MSDS | MSDS ngoài | ||
| Phân loại của EU | Rất dễ cháy (F+) | ||
| NFPA 704 |
| ||
| Nguy hiểm | R12 | ||
| An toàn | S2, S9, S16 | ||
| Điểm bốc cháy | - 60 °C | ||
| Nhiệt độ tự bốc cháy | 287 °C | ||
| Giới hạn nổ | 1,8–8,4% | ||
| Số RTECS | |||
| Dữ liệu bổ sung | |||
| Cấu trúc và tính chất |
n, εr, v.v.. | ||
| Tính chất nhiệt động |
Pha Rắn, lỏng, khí | ||
| Phổ | UV, IR, NMR, MS | ||
| Hóa chất liên quan | |||
| Ankan liên quan | Prôpan Pentan | ||
| Ngoại trừ có thông báo khác, các dữ liệu được lấy ở 25 °C, 100 kPa Thông tin về sự phủ nhận và tham chiếu | |||
Butan (/ˈbjuːteɪn/) là một hợp chất hữu cơ với công thức C4H10. Đây là một alkan với bốn nguyên tử carbon. Butan là một chất khí ở nhiệt độ phòng và áp suất khí quyển. Thuật ngữ này có thể chỉ một trong hai đồng phân cấu trúc, n-butan hoặc isobutan (còn được gọi là "methylpropan") hoặc hỗn hợp các đồng phân này. Tuy nhiên, trong danh pháp IUPAC, "butan" chỉ đề cập đến đồng phân n-butan (là đồng phân có cấu trúc không phân nhánh). Butan là khí rất dễ cháy, không màu, dễ dàng bị hóa lỏng và nhanh chóng bốc hơi ở nhiệt độ phòng. Tên butan xuất phát từ gốc từ but- (từ acid butyric, được đặt theo tên của từ Hy Lạp cho bơ) và -an. Nó được nhà hóa học Edward Frankland phát hiện vào năm 1849.[1] Nó được tìm thấy hòa tan trong dầu thô vào năm 1864 bởi Edmund Ronalds, người đầu tiên mô tả các thuộc tính của nó.[2][3]
Đồng phân
[sửa | sửa mã nguồn]| Tên gọi chung | butan bình thường butan không phân nhánh n- butan |
isobutane i- butan |
| Tên IUPAC | butan | 2-metylpropan |
| Sơ đồ phân tử |
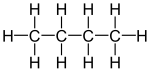
|
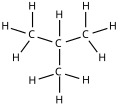
|
| Biểu đồ khung xương | 
|
Việc quay xung quanh liên kết C-C trung tâm tạo ra hai đồng phân khác nhau (trans và gauche) của n-butan.[4]
Tính chất
[sửa | sửa mã nguồn]Butan là một chất khí không màu, rất dễ cháy và dễ dàng hoá lỏng.
Phương trình điều chế
[sửa | sửa mã nguồn]Có trong khí dầu mỏ, khí thiên nhiên và khí chế biến dầu. Điều chế bằng cách cho ethyl bromide tác dụng với Na kim loại (phản ứng Vuyêc), dạng iso được điều chế bằng cách đồng phân hoá n-butan dưới tác dụng của AlCl3 và HCl ở 90 - 105 oC, 10 - 12 atm hoặc trên các chất xúc tác acid rắn:
- C4H6 + 2H2 → C4H10
- 2C2H5Cl + 2Na → C4H10 + 2NaCl
Ứng dụng
[sửa | sửa mã nguồn]Dùng làm nguyên liệu để điều chế butadien, isobutylen, xăng tổng hợp,... Hỗn hợp B với propan được dùng rộng rãi làm nhiên liệu; là thành phần chủ yếu của khí dầu mỏ hoá lỏng LPG (Liquified Petroleum Gas). Ở Việt Nam, LPG bắt đầu được sản xuất từ năm 2000 (tại nhà máy chế biến khí Phú Mỹ, tỉnh Bà Rịa – Vũng Tàu) từ khí đồng hành mỏ Bạch Hổ (xt. Khí dầu mỏ); sản lượng LPG năm 2002 khoảng 300 nghìn tấn nhưng vẫn chưa đáp ứng kịp nhu cầu tăng với tốc độ rất nhanh của thị trường trong nước.[cần dẫn nguồn]
Tham khảo
[sửa | sửa mã nguồn]- ^ “Occ paper” (PDF). www.chem.qmul.ac.uk. Bản gốc (PDF) lưu trữ ngày 17 tháng 4 năm 2017. Truy cập ngày 2 tháng 1 năm 2020.
- ^ Watts, H. (1868). Dictionary of Chemistry. 4. tr. 385.
- ^ Maybery, C.F. (1896). “On the Composition of the Ohio and Canadian Sulphur Petroleums”. Proceedings of the American Academy of Arts and Sciences. 31: 1–66. doi:10.2307/20020618. JSTOR 20020618.
- ^ Roman M. Balabin (2009). “Enthalpy Difference between Conformations of Normal Alkanes: Raman Spectroscopy Study of n-Pentane and n-Butane”. J. Phys. Chem. A. 113 (6): 1012–9. doi:10.1021/jp809639s. PMID 19152252.
 GIẢM
30%
GIẢM
30%
 GIẢM
18%
GIẢM
18%
 GIẢM
50%
GIẢM
50%
 GIẢM
29%
GIẢM
29%
 GIẢM
21%
GIẢM
21%





