Lithi
| Lithi, 3Li | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Lithi nổi trong dầu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Quang phổ vạch của lithi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất chung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tên, ký hiệu | Lithi, Li | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phiên âm | /ˈlɪθiəm/ LI-thee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hình dạng | Trắng bạc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lithi trong bảng tuần hoàn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số nguyên tử (Z) | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Khối lượng nguyên tử chuẩn (±) (Ar) | 6.941(2)[1] (6.938–6.997)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phân loại | kim loại kiềm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhóm, phân lớp | 1, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chu kỳ | Chu kỳ 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu hình electron | 1s2 2s1 hay [He]2s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
mỗi lớp | 2, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất vật lý | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Màu sắc | Trắng bạc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái vật chất | Chất rắn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ nóng chảy | 453,65 K (180,50 °C, 356,90 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ sôi | 1603 K (1330 °C, 2426 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ | 0,534 g·cm−3 (ở 0 °C, 101.325 kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ ở thể lỏng | ở nhiệt độ nóng chảy: 0,512 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điểm tới hạn | (ngoại suy) 3220 K, 67 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt lượng nóng chảy | 3,00 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt bay hơi | 147,1 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt dung | 24,860 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Áp suất hơi
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất nguyên tử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái oxy hóa | 1 Oxit bazơ mạnh | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ âm điện | 0,98 (Thang Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Năng lượng ion hóa | Thứ nhất: 520,2 kJ·mol−1 Thứ hai: 7298,1 kJ·mol−1 Thứ ba: 11815,0 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính cộng hoá trị | thực nghiệm: 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính liên kết cộng hóa trị | 128±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính van der Waals | 182 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thông tin khác | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu trúc tinh thể | Lập phương tâm khối | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vận tốc âm thanh | que mỏng: 6000 m·s−1 (ở 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ giãn nở nhiệt | 46 µm·m−1·K−1 (ở 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ dẫn nhiệt | 84,8 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điện trở suất | ở 20 °C: 92,8 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất từ | Thuận từ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cảm từ (χmol) | +14.2·10−6 cm3/mol (298 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun Young | 4,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun cắt | 4,2 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun khối | 11 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Mohs | 0,6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Brinell | 5 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số đăng ký CAS | 7439-93-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lịch sử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phát hiện | Johan August Arfwedson (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tách ra lần đầu | William Thomas Brande (1821) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đồng vị ổn định nhất | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bài chính: Đồng vị của Lithi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6Li tồn tại ngoài tự nhiên thấp hơn 3.75%. 7Li thì nhiều hơn với tỷ lệ 96.25%. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lithi hay liti[4] là một nguyên tố hóa học trong bảng tuần hoàn nguyên tố có ký hiệu Li[5] và số hiệu nguyên tử bằng 3, nguyên tử khối bằng 7. Lithi là một kim loại mềm có màu trắng bạc thuộc nhóm kim loại kiềm. Trong điều kiện tiêu chuẩn, Lithi là kim loại nhẹ nhất và là nguyên tố rắn có mật độ thấp nhất. Giống như tất cả các kim loại kiềm, Lithi là chất phản ứng mạnh và dễ cháy khi tiếp xúc với nước nên nó được bảo quản đặc biệt trong dầu khoáng. Lithi có ánh kim loại nhưng khi tiếp xúc với không khí ẩm nó bị ăn mòn bề mặt và bị chuyển màu nhanh chóng thành xám bạc mờ, sau đó là xỉn đen. Do có khả năng phản ứng mạnh, Lithi không bao giờ có mặt ở dạng nguyên tố trong tự nhiên, do vậy nó chỉ có ở dạng hợp chất ở dạng liên kết ion. Lithi có mặt nhiều trong các khoáng sản pegmatit, nhưng do tính dễ hòa tan ở dạng ion, nó cũng có mặt trong nước biển, và thường được tách ra từ muối và đất sét. Ở quy mô thương mại, lithi được tách ra bằng phương pháp điện phân từ hỗn hợp của lithi chloride và kali chloride.
Hạt nhân của lithi tương đối kém ổn định, vì hai đồng vị bền của lithi tự nhiên có năng lượng liên kết thấp nhất trên mỗi hạt nhân của tất cả các hạn nhân bền. Do tính kém ổn định hạt nhân tương đối nên lithi ít phổ biến trong hệ mặt trời so với 25 trong số 32 nguyên tố hóa học đứng đầu mặc dù hạt nhân của nó có khối lượng rất nhẹ.[6] Cũng lý do tương tự, lithi có mối liên lệ quan trọng với vật lý hạt nhân. Sự chuyển hóa hạt nhân của nguyên tử lithi thành heli năm 1932 là phản ứng hạt nhân được thực hiện thành công đầu tiên, và lithi-6 deuteride có vai trò là nhiên liệu phân hạch trong các vũ khí nhiệt hạch.[7]
Lithi và các hợp chất của nó có nhiều ứng dụng công nghiệp như thủy tinh cách nhiệt và gốm sứ, dầu nhờn lithi, phụ gia trong sản xuất sắt, thép và nhôm, pin lithi và pin ion lithi. Các ứng dụng này tiêu thụ gấp 3/4 sản lượng lithi. Bằng chứng thực nghiệm có sẵn là đủ để chấp nhận lithi là cần thiết; một RDA tạm thời cho một người trưởng thành nặng 70 kg trong 1,000 μg/ngày đã được đề nghị.[8][9]
Lithi dạng vết cũng có mặt trong các sinh vật. Nguyên tố này không thể hiện chức năng sinh học rõ ràng, vì các động và thực vật sống tốt mà không cần nó. Các chức năng không quan trọng cũng không loại trừ. Ion lithi Li+ ảnh hưởng đến nhiều muối lithi đã được chứng minh là hữu ích trong việc ổn định tinh thần trong một số loại thuốc điều trị rối loạn lưỡng cực, do những ảnh hưởng thần kinh của ion đến cơ thể con người.
Tính chất
[sửa | sửa mã nguồn]Vật lý
[sửa | sửa mã nguồn]Giống như các kim loại kiềm khác, lithi có một electron hóa trị nên nó dễ dàng cho đi electron này để tạo thành cation.[10] Do đó, đây là một chất bán dẫn nhiệt và điện tốt đồng thời cũng là một chất phản ứng mạnh. Lithi có khả năng phản ứng thấp hơn so với các kim loại kiềm khác do electron hóa trị gần với hạt nhân (hai electron còn lại trong orbitan s của lithi có mức năng lượng thấp hơn, và do đó nó không tham gia tạo các liên kết hóa học).[10]
Kim loại lithi đủ mềm để có thể cắt bằng dao. Vết cắt tươi có màu trắng bạc và đổi thành xám nhanh do sự oxy hóa tạo thành lithi oxide.[10] Lithi là một trong số các kim loại có điểm nóng chảy thấp nhất (180 °C), nhưng nó lại là kim loại có điểm sôi và nóng chảy cao nhất so với các kim loại kiềm.[11]
Lithi có tỉ trọng rất thấp đạt 0,534 g/cm³, tương đương với gỗ thông. Nó có mật độ thấp nhất so với các nguyên tố ở dạng rắn trong điều kiện nhiệt độ phòng, nguyên tố rắn xếp sau nó (kali có tỉ trọng 0,862 g/cm³) có mật độ lớn hơn nó 60%. Thêm vào đó, ngoài heli và hydro, nó có mật độ nhỏ hơn bất kỳ nguyên tố ở dạng lỏng nào, nó chỉ bằng 2/3 so với nitơ lỏng (0,808 g/cm³).[12] Lithi có thể nổi trên các hydrocarbon nhẹ và là một trong 3 kim loại có thể nổi trên nước, hai kim loại còn lại là natri và kali.

Hệ số giãn nở nhiệt của Lithi lớn gấp đôi so với nhôm và gần 4 lần của sắt.[13] Lithi là một chất siêu dẫn ở dưới 400 μK trong điều kiện áp suất tiêu chuẩn[14] và ở nhiệt độ cao hơn (trên 9 K) ở áp suất rất cao (>20 GPa).[15] Ở nhiệt độ dưới 70 K, lithi, giống như natri, trải qua sự chuyển pha không khuếch tán. Ở 4,2 K lithi có cấu trúc tinh thể trực thoi; ở nhiệt độ cao hơn nó chuyển sang cấu trúc lập phương tâm diện và sau đó là lập phương tâm khối. Ở nhiệt độ heli lỏng (4 K) cấu trúc thoi là dạng thường gặp nhất.[16] Nhiều dạng thù hình của lithi đã được quan sát ở áp suất cao.[17]
Lithi có nhiệt dung riêng đạt 3,58 kJ/kgK, là giá trị cao nhất trong tất cả các chất rắn.[18][19] Do vậy, kim loại lithi thường được dùng làm chất làm mát trong các ứng dụng truyền tải nhiệt.[18]
Hóa học và hợp chất
[sửa | sửa mã nguồn]Lithi dễ phản ứng với nước nhưng tạo năng lượng ít hơn so với các kim loại kiềm khác. Phản ứng tạo ra khí hydro và lithi hydroxide trong dung dịch.[10] Do phản ứng với nước nên lithi thường được lưu trữ trong bằng cách ngâm trong hydrocarbon, thường là dầu. Mặc dù các kim loại kiềm nặng hơn có thể được trữ trong các chất nặng hơn, như dầu khoáng, lithi thì không đủ nặng để chìm trong các chất lỏng như thế.[20] Trong không khí ẩm, lithi nhanh chóng bị xỉn do tạo thành một lớp lithi hydroxide (LiOH và LiOH·H2O) màu đen phủ bên ngoài, lithi nitride (Li3N) và lithi cacbonat (Li2CO3, đây đều là các sản của phản ứng thứ cấp giữa LiOH và CO2).[21]

Khi đốt bằng ngọn lửa, các hợp chất của lithi tạo ra một màu đỏ thẫm, nhưng khi cháy mạnh nó cho ra màu bạc sáng. Lithi bắt lửa và bốc cháy trong oxy khi tiếp xúc với nước hoặc hơi nước.[22] Lithi là một chất dễ cháy, và nó có thể nổ khi tiếp xúc với không khí và đặc biệt là với nước, mặc dù nó ít xảy ra so với các kim loại kiềm khác. Phản ứng lithi-nước ở nhiệt độ thường thì nhanh nhưng không mãnh liệt, vì hydro được tạo ra sẽ không tự cháy. Giống như tất cả kim loại kiềm, các đám cháy lithi rất khó dập tắt, nó cần các bột chữa cháy phải khô (loại nhóm D). Lithi là kim loại duy nhất phản ứng với nitơ ở nhiệt độ thường.[23][24]
Lithi có quan hệ chéo với magiê, một nguyên tố có cùng bán kính ion và nguyên tử. Sự tương đồng giữa hai kim loại như tạo thành các hơp chất nitride khi phản ứng với N2, sự hình thành lithi oxide (Li
2O) và peroxide (Li
2O
2) khi cháy trong O2, các muối có tính tan tương tự, và khả năng kém bền nhiệt của các hợp chất cacbonat và nitride của chúng.[21][25] Kim loại lithi phản ứng với khí hydro ở nhiệt độ cao tạo ra lithi hydride (LiH).[26]
Các hợp chất hai cấu tử khác như halide (LiF, LiCl, LiBr, LiI) và sulfide (Li
2S), superoxide (LiO
2), carbide (Li
2C
2). Các hợp chất vô cơ khác cũng tồn tại khi lithi kết hợp với các anion để tạo thành nhiều muối khác nhau như Lithi borat, Lithi amua, Lithi cacbonat, Lithi nitrat, hay bohydride (LiBH
4). Lithi nhôm hydride (LiAlH
4) được sử dụng phổ biến làm chất khử trong phản ứng tổng hợp hữu cơ.
Nhiều chất vô cơ của lithi được biết ở dạng liên kết cộng hóa trị giữa các nguyên tử cacbon và lithi tạo ra carbanion. Đây là những chất base và ái lực hạt nhân cacbon mạnh. Trong nhiều hợp chất lithi hữu cơ này, các ion lithi có khuynh hướng tập hợp thành các ô mạng có tính tự đối xứng cao, đây là trường hợp khá phổ biến đối với các kim loại kiềm.[27] LiHe, là một chất van der Waals tương tác yếu, đã được phát hiện ở nhiệt độ rất thấp.[28]
Lithi cũng được phát hiện thể hiện từ tính ở dạng khí trong các điều kiện nhất định.[29]
Đồng vị
[sửa | sửa mã nguồn]Lithi trong tự nhiên là hỗn hợp của 2 đồng vị ổn định 6Li và 7Li với 7Li là phổ biến nhất (92,5% trong tự nhiên).[10][20][30] Cả hai đồng vị tự nhiên đều có năng lượng liên kết hạt nhân thấp trên mỗi hạt nhân so với các nguyên tố nhẹ hơn và nặng hơn nằm kề nó trong bảng tuần hoàn là heli và berylli, tức các nguyên tố nhẹ ổn định, lithi có thể sinh năng lượng qua phản ứng phân hạch hạt nhân. Hai hạt nhân có năng lượng liên kết thấp hơn trên mỗi hạt nhân so với các hạt nhân ổn định khác là deuterium và heli-3.[31] Do đó, mặc dù khối lượng nguyên tử nhẹ, lithi ít phổ biến trong hệ mặt trời so với 25 trong 30 nguyên tố hóa học đầu tiên.[6] Nó có 7 đồng vị phóng xạ đã biết với ổn định nhất là 8Li có chu kỳ bán rã 838 ms và 9Li có chu kỳ bán rã 178,3 ms. Các đồng vị còn lại có chu kỳ bán rã dưới 8,6 ms. Đồng vị có chu kỳ bán rã ngắn nhất là 4Li, bị phân rã theo bức xạ proton và có chu kỳ bán rã 7,6x10−23 s.[32]
Lithi-7 là một trong những nguyên tố nguyên thủy (sản xuất trong các phản ứng tổng hợp hạt nhân của Vụ nổ lớn Big Bang). Một lượng nhỏ của 2 đồng vị 6Li và 7Li được tạo ra trong các sao, nhưng chúng được cho là bị đốt nhanh hơn tốc độ chúng được tạo ra.[33] Một lượng khác lithi bao gồm các đồng vị 6Li and 7Li có thể được tạo ra từ gió mặt trời, các tia vũ trụ va vào các nguyên tử nặng hơn, và từ thời kỳ đầu của hệ mặt trời 7Be và 10Be phân rã phóng xạ.[34] Trong khi lithi được tạo ra trong các sao qua sự tổng hợp hạt nhân sao, sau đó nó bị đốt cháy.7Li cũng có thể được tạo ra trong các sao cacbon.[35]
Tỉ lệ các đồng vị lithi ổn định đáng kể trong nhiều quá trình tự nhiên,[36] bao gồm sự thành tạo các khoáng vật (sự kết tủa hóa học), trao đổi chất, và trao đổi ion. Các đồng vị của lithi phân chia trong một loạt các quá trình tự nhiên, bao gồm cả việc hình thành khoáng chất (kết tủa hóa học), thủy phân, trao đổi ion (Lithi thay thế cho for magiê và sắt trong các cấu trúc bát giác của đất sét, trong đó Li-6 là có ưu thế hơn Li-7), trong các quá trình siêu lọc cũng như sự biến đổi đá. Đồng vị 11Li được biết là có tính chất quang hạt nhân. Quá trình chia tách hạt nhân bằng laser có thể được sử dụng để tác các hạt nhân lithi.[37]
Sản xuất vũ khí hạt nhân và các ứng dụng vật lý hạt nhân khác chiếm tỷ lệ sử dụng lithi nhân tạo chính, với đồng vị nhẹ 6Li được lưu giữ trong công nghiệp và quân sự có sự thau đổi nhỏ nhưng có thể đo đạc được những thay đổi của tỉ lệ 6Li so với 7Li thậm chí trong các nguồn tự nhiên như sông suối. Điều này dẫn đến một điều không chắc chắn bất bình thường trong việc chuẩn hóa khối lượng hạt nhân lithi, vì đại lượng này phụ thuộc vào tỉ lệ có mặt trong tự nhiên của các đồng vị lithi bền, cũng do chúng là các nguồn khoáng sản lithi thương mại.[38]
Sự phổ biến
[sửa | sửa mã nguồn]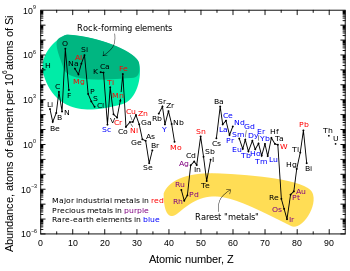
Vũ trụ
[sửa | sửa mã nguồn]Theo lý thuyết vũ trụ hiện đại, lithi (bao gồm cả hai đồng vị bền lithi-6 và lithi-7) nằm trong 3 nguyên tố được tổng hợp trong vụ nổ Big Bang.[39] Mặc dù số lượng lithi được tạo ra trong sự tổng hợp hạt nhân Big Bang bị phụ thuộc vào số lượng các photon trong baryon, các giá trị lithi phổ biến được chấp nhận có thể tính toán được, và có một "sự khác biệt lithi vũ trụ học" trong Vũ trụ: các sao già có vẻ có ít lithi hơn mọi người vẫn nghĩ, và một số sao trẻ hơn có nhiều hơn nhiều. Sự thiếu vắng lithi trong các sao già hơn dường như được gây ra bởi sự trộn lẫn lithi vào bên trong sao đó, tại đó nó bị phân hủy.[40] Hơn thế nữa, lithi được tạo ra trong các sao trẻ hơn. Mặc dù nó chuyển hóa thành 2 nguyên tử heli do sự va chạm với một proton ở nhiệt độ trên 2,4 triệu độ C (hầu hết các sao dễ dàng có được nhiệt độ này bên trong lòng của nó), lithi có nhiều hơn lượng dự đoán trong các sao được hình thành sau, còn về nguyên nhân thì chưa được hiểu rõ.[20]

Mặc dù nó là một trong 3 nguyên tố (cùng với heli và hydro) được tổng hợp từ Big Bang, lithi cùng với berylli và boron có số lượng thấp hơn đáng kể so với các nguyên tố lân cận. Đây là kết quả của nhiệt độ thấp cần thiểt để phân hủy lithi, và sự thiếu vắng một quá trình phổ biến để tạo ra nó.[42]
Lithi cũng được tìm thấy trong sao lùn nâu và có giá trị dị thường trong các sao cam. Do lithi có mặt trong các sao lùn nâu có khối lượng nhỏ hơn, lạnh hơn, nhưng nó bị phân hủy ở các sao lùn đỏ nóng hơn, sự có mặt của nó trong phổ của các sao có thể được sử dụng làm thí nghiệm lithi để phân biệt các nhóm sao này, cũng như các sao nhỏ hơn Mặt trời.[20][43][44] Một số ngôi sao màu cam cũng có thể chứa một nồng độ lithi cao. Các sao màu cam này được tìm thấy có hàm lượng lithi cao hơn so với hàm lượng bình thường (chẳng hạn như Centaurus X-4) quay quanh các vật thể lớn (có thể là các sao neutron hoặc các lỗ đen) toàn bộ lực hấp dẫn rõ ràng đã kéo lithi nặng hơn lên bề mặt của các sao hydro-heli, làm cho lithi được quan sát có nhiều hơn.[20]
Trên Trái Đất
[sửa | sửa mã nguồn]| Quốc gia | Sản lượng | Trữ lượng[note 1] |
|---|---|---|
| 2.900 | 850.000 | |
| 13.000 | 1.500.000 | |
| 400 | 48,000 | |
| 480 | 180.000 | |
| 12.900 | 7.500.000 | |
| 5.000 | 3.500.000 | |
| 570 | 60.000 | |
| 1.000 | 23.000 | |
| Tổng thế giới | 36.000 | 13.500.000 |
Mặc dù lithi phân bố rộng rãi trên Trái Đất, nó không xuất hiện tự nhiên ở dạng nguyên tố do tính phản ứng cao của nó.[10] Tổng lượng lithi trong nước biển là rất lớn, ước tính khoảng 230 tỉ tấn, tức nồng độ ổn định khoảng 0,14 đến 0,25 ppm,[46][47] hay 25 micromol;[48] hàm lượng cao hơn đạt đến 7ppm được tìm thấy trong các mạch nhiệt dịch.[47]
Hàm lượng lithi trong vỏ Trái Đất ước tính dao động trong khoảng 20 đến 70 ppm.[21] Lithi là một thành phần phủ trong các đá magma với hàm lượng cao nhất trong các đá granit. Các đá pegmatit cũng có hàm lượng lithi lớn nhất ở dạng khoáng vật, với spodumene và petalite là các nguồn khai thác lithi thương mại phổ biến.[21] Khoáng vật lithi đáng kể khác là lepidolit.[49] Một nguồn lithi mới là sét hectorit, các hoạt động khai thác chủ yếu thông qua công ty Western Lithium Corporation ở Hoa Kỳ.[50] Với hàm lượng 20 mg lithi/kg trong vỏ Trái Đất,[51] lithi là nguyên tố phổ biến thứ 25.
Theo cẩm nang Lithi và Calci tự nhiên, "Lithi là một nguyên tố tương đối hiếm, mặc dù nó được tìm thấy trong nhiều khối đá và một vài vùng nước mặn, nhưng luôn ở nồng độ rất thấp. Có một số lượng khá lớn của cả khoáng lithi và mỏ muối nhưng chỉ một ít trong số chúng thực sự hoặc có tiềm năng giá trị thương phẩm.[52]
Trong những nơi có trữ lượng lithi lớn nhất[note 1] là Salar de Uyuni ở Bolivia, với trữ lượng 5,4 triệu tấn. USGS ước tính năm 2010, Chile có trữ lượng lớn nhất (7,5 triệu tấn)[53] và sản lượng hàng năm cao nhất (8.800 tấn). Các nhà cung cấp chính khác như Úc, Argentina và Trung Quốc.[45][54] Tính đến năm 2015, một Khảo sát địa chất tại cộng hòa Séc coi toàn bộ Dãy núi Quặng tại Cộng hòa Séc là khu vực lithi. Năm mỏ đã được đăng ký, một mỏ gần Cínovec được coi là mỏ kinh tế tiềm năng với 160 000 tấn lithi.[55]
Tháng 6 năm 2010, New York Times đưa ra thông báo rằng các nhà địa chất Hoa Kỳ đã tiến hành khảo sát vùng khô hạn của các hồ muối ở miền tây Afghanistan và tin rằng có trữ lượng lithi lớn nhất ở đây."Các quan chức Lầu Năm Góc cho rằng các phân tích ban đầu của họ tại một địa điểm ở tỉnh Ghazni cho thấy tiềm năng tạo mỏ lithi lớn cỡ mỏ ở Bolivia, mà mỏ này hiện có trữ lượng lithi lớn nhất đã được biết đến."[56] Các ước tính này "chỉ dựa trên dữ liệu cũ, được thu thập chủ yếu từ thời Liên Xô trong khi họ chiếm đóng Afghanistan giai đoạn 1979–1989" và "Stephen Peters, trưởng dự án khoáng sản Afghanistan của USGS, cho rằng ông ta không ông biết về mối liên quan của USGS đến bất kỳ cuộc thăm dò khoáng sản mới nào tại Afghanistan trong 2 năm qua. 'Chúng tôi cũng không chắc có bất kỳ phát hiện nào mới về lithi."[57]
Sinh học
[sửa | sửa mã nguồn]Lithi được tìm thấy ở dạng vết trong nhiều nhóm thực vật, thực vật phù du, và động vật không xương sống với hàm lượng 69 đến 5.760 ppb. Trong các động vật không xương sống thì hàm lượng hơi thấp hơn, và hầu như tất cả tế bào và chất dịch của động vật có xương sống có mặt lithi với mức dao động trong khoảng 21 đến 763 ppb.[47] Các sinh vật ở biển có khuynh hướng tích tụ sinh học lithi nhiều hơn các sinh vật trên cạn.[58] Hiện con người không rõ liệu lithi có vai trò sinh lý học như thế nào trong các sinh vật trên,[47] nhưng các nghiên cứu về dinh dưỡng ở các động vật có vú chỉ ra rằng lithi có vai trò quan trọng đối với sức khỏe của chúng, điều này cho thấy rằng lithi có thể được xếp vào nhóm nguyên tố vết thiết yếu với RDA of 1 mg/ngày.[59] Các nghiên cứu quan sát ở Nhật Bản thông báo năm 2011 cho rằng lithi tự nhiên có trong nước uống có thể giúp kéo dài tuổi thọ của con người.[60]
Lịch sử
[sửa | sửa mã nguồn]
Petalit (LiAlSi4O10) được một nhà hóa học người Brazil José Bonifácio de Andrada e Silva phát hiện năm 1800 trong một mỏ trên đảo Utö Thụy Điển.[61][62][63][64] Tuy nhiên mãi cho đến năm 1817, Johan August Arfwedson, làm việc trong một phòng thí nghiệm hóa của Jöns Jakob Berzelius, phát hiện sự có mặt của một nguyên tố mới trong khi phân tích quặng petalit.[65][66][67][68] Nguyên tố này tạo thành các hợp chất tương tự như các hợp chất của natri và kali, mặc dù hợp chất cacbonat và hydroxide của nó ít tan trong nước và có tính base hơn.[69] Berzelius đặt tên vật liệu kiềm này là "lithion/lithina", từ tiếng Hy Lạp λιθoς (nghĩa là đá), để chỉ trạng thái được phát hiện của nó là một khoáng chất rắn, trái với kali được phát hiện trong tro của thực vật, và natri được biết là một phần từ nồng độ của nó cao trong máu động vật. Ông đặt tên kim loại trong vật liệu này là "lithium".[10][63][68]
Arfwedson sau đó chỉ ra rằng nguyên tố cùng tên này có mặt trong các khoáng vật như spodumene và lepidolit.[63] Năm 1818, Christian Gmelin là người đầu tiên quan sát các muối lithi tạo ngọn lửa đỏ rực khi cháy.[63][70] Tuy nhiên, cả Arfwedson và Gmelin đã cố thử và thất bại về việc cô lập nguyên tố tinh khiết từ các muối của nó.[63][68][71] Nó không được tách ra mãi cho đến năm 1821, khi William Thomas Brande đã tách được lithi kim loại bằng phương pháp điện phân lithi hydroxide, một quá trình mà trước kia nhà hóa học Humphry Davy đã tách các kim loại kiềm natri và kali.[20][71][72][73][74] Brande cũng đã mô tả các muôi lithi tinh khiết, ở dạng chloride, và ước tính rằng lithia (lithi oxide) chứa khoảng 55% kim loại, ước tính khối lượng nguyên tử lithi khoảng 9,8 g/mol (giá trị ngày nayy là ~6,94 g/mol).[75] Năm 1855, Một lượng lớn hơn lithi được tạo ra bằng phương pháp điện phân lithi chloride do Robert Bunsen và Augustus Matthiessen thực hiện.[63][76] Việc phát hiện ra quy trình này đã dẫn đến việc sản xuất lithi thương mại kể từ năm 1923 do một công ty của Đức là Metallgesellschaft AG. Công ty này đã dùng phương pháp điện phân hỗn hợp lithi chloride và kali chloride.[63][77][78]
Việc sản xuất và sử dụng lithi đã trãi qua nhiều thay đổi mạnh mẽ về lịch sử. Ứng dụng quan trọng đầu tiên của lithi là chất bôi trơn lithi nhiệt độ cao cho các động cơ máy bay hay các ứng dụng tương tự trong thế chiến thứ 2 và một thời gian ngắn sau đó. Ứng dụng này được ủng hộ mạnh mẽ do xá phòng gốc lithi có điểm nóng chảy cao hơn các xà phòng nhóm kiềm khác, và ít bị ăn mòn hơn so với các xà phòng gốc calci. Thị trường nhỏ về các loại xà phòng lithi và dầu mỡ bôi trơn dựa vào lithi được hỗ trợ từ nhiều mỏ nhỏ chủ yếu ở Hoa Kỳ.
Nhu cầu lithi tăng mạnh trong suốt thời kỳ chiến tranh lạnh do cung cấp cho việc sản xuất vũ khí hạt nhân. Cả lithi-6 và lithi-7 đều tạo ra tritium khi chiếu các hạt neutron, và do đó nó rất hữu ích trong việc sản xuất tritium, cũng như ở dạng nhiên liệu nhiệt hạch rắn được dùng trong các bom hydro ở dạng lithium deuterua. Hoa Kỳ trở thành nhà sản xuất lithi chínhtrong giai đoạn cuối thập niên 1950 và giữa thập niên 1980. Vào Cuối cùng các do dự trữ lithi chứa gần 42.000 tấn lithi hydroxide. Lithi trong kho bị làm nghèo lithi-6 khoảng 75%, lượng này không đủ để ảnh hưởng đến khối lượng nguyên tử cần thiết về lithi trong các chất hóa học chuẩn, và thậm chí trọng lượng nguyên tử lithi trong một số ion "nguồn tự nhiên" đã bị "nhiễm" bởi các muối lithi từ các nhà máy tách đồng vị, các nguồn này cũng được tìm thấy trong nước dưới đất.[38][79]
Lithi đã được sử dụng để làm giảm nhiệt độ nóng chảy của thủy tinh và làm tăng nhiệt độ nóng chảy của nhôm oxide khi dùng công nghệ Hall-Héroult.[80][81] Hai ứng dụng này được sử dụng chính trên thị trường mãi cho đến giữa thập niên 1990. Vào cuối cuộc chạy đua vũ trang hạt nhân, nhu cầu lithi tăng và giá bán của Department of Energy stockpiles trên thị trường giảm mạnh.[79] Nhưng vào giữa thập niên 1990, nhiều công ty bắt đầu tách lithi từ nước biển - một phương pháp được cho là rẻ hơn việc khai thác hầm lò hoặc thậm chí là khai thác lộ thiên. Hầu hết các mỏ bị đóng cửa hoặc chuyển trọng tâm của họ các loại vật liệu khác trong khi đó chỉ có nguồn quặng khai thác từ các mạch pegmatit là có thể mang lại giá cạnh tranh.
Sự phát triển của pin lithi làm gia tăng nhu cầu lithi và trở thành đối tương sử dụng chính trong năm 2007.[82] Với dự dao động nhu cầu lithi làm pin trong thập nhiên 2000, các công ty mới đã mở rộng việc khai thác lithi từ nguồn nước biển để đáp ứng nhu cầu gia tăng này.[83][84]
Sản xuất
[sửa | sửa mã nguồn]
Từ cuối Chiến tranh thế giới thứ hai, sản xuất lithi đã tăng lên đáng kể. Kim loại này được tách ra từ khoáng sản liên quan đến các đá mácma như Lepidolit, spodumen, petalit và amblygonit. Các muối lithi được tách ra từ các suối nước khoáng, các hồ nước mặn và các mỏ trầm tích nguồn gốc biển. Kim loại được sản xuất bằng phương pháp điện phân hỗn hợp gồm 55% lithi chloride và 45% kali chloride ở khoảng 450 °C.[85] Năm 1998, kim loại này có giá khoảng 95 USD/kg.[86]
Việc tách lithi (* là đồng vị của lithi, ví dụ * bằng 7 hay 6) bằng điện phân được thực hiện như sau:
catốt:
anốt:
Dự trữ
[sửa | sửa mã nguồn]Trữ lượng lithi chắc chắn năm 2008 theo ước tính của USGS khoảng 13 triệu tấn,[45] nhưng cực kỳ khó để ước tính trữ lượng tài nguyên lithi trên toàn cầu.
Mỏ Lithi được tìm thấy ở Nam Mỹ trong suốt dãy núi Andes. Chile là nhà sản xuất hàng đầu, tiếp theo là Argentina. Cả hai nước thu hồi Lithi từ các hồ nước mặn. Ở Hoa Kỳ Lithi được thu hồi các hồ nước mặn ở Nevada.[18] Tuy nhiên, phân nửa trữ lượng trên thế giới phân bố ở Bolivia, một quốc gia nằm ở sườn phía đông trung tâm dãy Andes. Năm 2009, Bolivia đã thương lượng với Nhật Bản, Pháp, và Hàn Quốc để bắt đầu khai thác.[87] Theo USGS, sa mạc Uyuni của Bolivia có trữ lượng 5,4 triệu tấn lithi.[87][88] Một mỏ mới được phát hiện ở đới nâng Rock Springs ở Wyoming ước tính đạt 228.000 tấn. Những mỏ cùng thành tạo này được ngoại suy trữ lượng khoảng 18 triệu tấn.[89]
Sau dự tụt giảm giá quy mô công nghiệp của sản phẩm lithi cacbonat sau cuộc khủng hoảng kinh tế lớn, nhiều nhà cung cấp chính như Sociedad Química y Minera (SQM) họ đã giảm giá bán 20%[90] trong việc khai thác các nguồn tài nguyên lithi trong thời gian tới và cũng để giữ vững thị trường của họ, giá năm 2012 tăng lên do nhu cầu lithi tăng. Bài báo Business Week năm 2012 đã nêu ra sự độc quyền về lithi như sau: "SQM, được điều hành bởi tỉ phú Julio Ponce, đứng vị trí thứ hai, sau Rockwood được chống lưng bởi Henry Kravis thuộc KKR & Co., và FMC có trụ sở ở Philadelphia". Lượng tiêu thụ toàn cầu có thể tăng lên 300.000 tấn vào năm 2020 từ khoảng 150.000 tấn năm 2012, vì nhu cầu sản xuất pin lithi đã và đang tăng với tỉ lệ 25% mỗi năm, tăng nhanh hơn 4-5% trong overall gain in lithium[91]
Một nguồn lithi tiềm năng khác là từ các giếng địa nhiệt. Các dòng địa nhiệt cò thể mang các chất này lên trên bề mặt;[92] việc thu hồi lithi có thể được chứng minh trong lĩnh vực này.[93] Một khi lithi được tách ra bằng các kỹ thuật lọc đơn giản, chi phí xử lý và môi trường về cơ bản là đã bao gồm trong việc vận hành các giếng địa nhiệt này; do đó các tác động của hoạt động này là tích cực.[94]
Có nhiều quan điểm khác nhau về sản xuất tiềm năng tăng trưởng sản xuất lithi. Một nghiên cứu năm 2008 đã kết luận rằng "việc sản xuất lithicacbonat thực tế đạt được sẽ đủ chỉ cho một phần nhỏ nhu cầu thị trường PHEV và EV toàn cầu trong tương lai", và "nhu cầu từ phân khúc thị trường điện tử cầm tay sẽ tiêu thụ hầu hết trữ sản phẩm gia tăng trong kế hoạch trong thập niên tới", và "việc sản xuất hàng loạt lithi cacbonat không có vẻ thân thiện môi trường, nó sẽ gây ra thiệt hại không thể khắc phục các hệ sinh thái sinh thái cần được bảo vệ và các động cơ đẩy LiIon là không phù hợp với các khái niệm về "Green Car".[54]
Tuy nhiên, theo một nghiên cứu được tiến hành năm 2011 tại Phòng thí nghiệm Lawrence Berkeley, Hoa Kỳ và Đại học California Berkeley, trữ lượng ước tính hiện tại về lithi không thể là một yếu tố hạn chế cho việc sản xuất pin quy mô lớn cho các xe chạy điện, theo nghiên cứu chỉ ra rằng 1 tỉ pin Li 40 kWh có thể được sản xuất với trữ lượng hiện tại.[95] Một nghiên cứu khác được thực hiện năm 2011 bởi các nhà nghiên cứu từ đại học Michigan và Ford Motor cho thấy rằng có đủ tài nguyên lithi để cung cấp cho nhu cầu toàn cầu cho đến năm 2100, bao gồm lượng lithi cần cho các ứng dụng tiềm năng rộng rãi của các xe lai điện, plug-in hybrid electric và pin xe điện. Nghiên cứu đã ước tính trữ lượng lithi toàn cầu đạt khoảng 39 triệu tấn, và nhu cầu cho lithi trong chu kỳ 90 năm phân tích đạt 12-20 triệu tấn theo kịch bản phát triển kinh tế và tỷ lệ tái chế.[96]
Vào ngày 9 tháng 6 năm 2014, ấn phẩm Financialist đươợc xuất bản bởi Credit Suisse chỉ ra rằng nhu cầu lithi đang tăng trưởng với tốc độ 12% mỗi năm; theo Credit Suisse, tốc độ này vượt quá giá trị tính toán 25%. Bài báo so sánh tình trạng lithi 2014 với dầu, theo đó "giá dầu tăng cao đã thúc đẩu đầu tư vào các công nghệ sản xuất cát dầu và dầu trong vùng nước sâu tốn kém"; tức là giá lithi sẽ tiếp tục tăng cho đến khi các phương pháp sản xuất đắt tiền hơn có thể làm tăng tổng sản lượng đầu ra được sự chú ý của các nhà đầu tư.[97]
Giá cả
[sửa | sửa mã nguồn]Sau cuộc khủng hoảng tài chính toàn cầu 2008, những nhà cung cấp lớn như Sociedad Química y Minera (SQM) giảm giá Lithi cacbonat đến 20%.[90] Lượng tiêu tụ toàn cầu có thể tăng đến 300,000 tấn một năm vào năm 2020 so với 150,000 tấn năm 2012, nhằm đáp ứng nhu cầu sử dụng pin lithi tăng trưởng khoảng 25% một năm, nhanh hơn mức tăng trưởng chung từ 4-5% trong sản xuất lithi.[98]
Chiết xuất và nước biển
[sửa | sửa mã nguồn]Tính đến năm 2015 hầu hết lithi trên thế giới được sản xuất tại Nam Mỹ, nơi các mỏ chứa lithi được chiết xuất từ bể ngầm và tập trung bằng bốc hơi năng lượng mặt trời. Kĩ thuật khai thác tiêu chuẩn là làm bay hơi nước từ mỏ, mỗi lô hàng mất từ 18 đến 24 tháng.[99] Lithi hiện tại vẫn nằm trong nước biển, nhưng những cách thức khai thác thương mại khả thi vẫn chưa được phát triển.[99]
Ứng dụng
[sửa | sửa mã nguồn]
Vì nhiệt dung riêng lớn của nó (lớn nhất trong số các chất rắn), lithi được sử dụng trong các ứng dụng truyền nhiệt. Nó cũng là vật liệu quan trọng trong chế tạo anốt của pin vì khả năng điện hóa học cao của nó. Các ứng dụng khác còn có:
Sứ và thủy tinh
[sửa | sửa mã nguồn]Lithi oxide được sử dụng rộng rãi làm chất tẩy trong việc xử lý silica, giảm điểm nóng chảy và độ nhớt của vật liệu và làm men sứ trong việc cải thiện các tính chất vật lý bao gồm các hệ số giãn nở nhiệt thấp. Trên toàn cầu đây là ứng dụng đơn lớn nhất đối với hợp chất lithi.[100][101] Lithi cacbonat (Li2CO3) thường được sử dụng trong ứng dụng này vì nó chuyển đổi oxide khi nung nóng.[102]
Điện và điện tử
[sửa | sửa mã nguồn]Vào các năm cuối của thế kỷ XX, do sở hữu thế điện cao của nó, lithi trở thành một thành phần quan trọng trong các chất điện phân và một trong các thành phần quan trọng trong pin. Do có khối lượng nguyên tử thấp, lithi có tỉ lệ khối lượng tích điện và năng lượng cao. Loại pin ion lithi có thể tạo ra khoảng 3 vôn mỗi ô, so với 2,1 vôn đối với pin acid chì hay 1,5 vôn đối với pin kẽm-cacbon. Các pin ion lithi, có thể sạc được và có mật độ năng lượng cao, không thể nhầm lẫn với pin lithi không thể sạc được.[103][104] Các loại pin sạc khác sử dụng lithi như pin polymer ion lithi, pin lithi sắt phốtphat, và pin dây nano.
Chất bôi trơn
[sửa | sửa mã nguồn]Ứng dụng phổ biến thứ ba của lithi là làm các chất bôi trơn. Lithi hydroxide là một chất base mạnh và khi nung với mỡ, nó tạo ra một loại xà phòng lithi có tên là stearat. Xà phòng lithi có khả năng thicken oils, và nó được sử dụng để sản xuất các chất bôi trơn nhiệt độ cao nhiều mục đích.[18][105][106]
Luyện kim
[sửa | sửa mã nguồn]Lithi (cũng như lithi cacbonat) được dùng làm phụ gia trong hoạt động đúc liên tục trong xỉ làm tăng tính linh động,[107][108] chiếm khoảng 5% lượng lithi toàn cầu (2011).[45] Các hợp chất lithi cũng được sử dụng làm phụ gia trong cát đúc cho hoạt động đúc sắt nhằm giảm veining.[109]
Lithi (ở dạng lithi fluoride) được sử dụng làm phụ gia trong nấu chảy nhôm (công nghệ Hall–Héroult), làm giảm nhiệt độ nóng chảy và làm tăng điện trở suất,[110] nguồn này chiếm 3% sản lượng toàn cầu năm 2011.[45] Các hợp kim của lithi với nhôm, cadmi, đồng và mangan được sử dụng trong các bộ phần của máy bay (xem thêm hợp kim lithi-nhôm).[111] Lithi còn có hiệu quả trong việc hỗ trợ sự hoàn hảo của mối hàn silicon nano trong những thành phần điện tử cho pin điện và các thiết bị khác.[112]
Các ứng dụng công nghiệp và hóa học khác
[sửa | sửa mã nguồn]
- Các hợp chất lithi được sử dụng làm chất tạo màu và chất oxy hóa trong pháo hoa và pháo sáng.[18][114]
- Lithi peroxide (Li2O2) trong môi trường ẩm không chỉ phản ứng với cacbon dioxide tạo thành lithi cacbonat mà còn giải phóng oxy.[115][116] Phản ứng diễn ra theo phương trình:
- 2 Li2O2 + 2 CO2 → 2 Li2CO3 + O2.
Một số hợp chất aforementioned hay lithi perchlorat, được sử dụng làm nến oxy để cung cấp oxy cho các tàu ngầm. Loại này có thể chứa một lượng nhỏ boron, magie, nhôm, silicon, titan, mangan, và sắt.[117]
Quang học
[sửa | sửa mã nguồn]Lithi fluoride có một trong những chỉ số khúc xạ thấp nhất và phạm vi truyền dẫn xa nhất trong tia UV sâu của hầu hết các vật liệu thông thường.[118] Tính chia bột lithi fluoride đã được sử dụng cho Liều lượng phát quang (TLD): khi một mẫu như vậy tiếp xúc với bức xạ, nó tích lũy phần thiếu tinh thể khi nóng lên, phát ra một ánh sáng xanh có cường độ lớn tỉ lệ với độ hấp thụ, cho phép cách này định lượng.[119] Đôi khi lithi fluoride còn được sử dụng trong các ống tiêu cự của kính viễn vọng.[18][120] Ứng dụng lithi được sử dụng trong hơn 60% điện thoại di động.[121]
Hữu cơ và polyme hóa học
[sửa | sửa mã nguồn]Hợp chất Organolithium được sử dụng rộng rãi trong sản xuất polyme hóa học. Trong ngành công nghiệp polyme mà người tiêu dùng chi phối những hợp chất này, hợp chất lithi ankyl là chất xúc tác[122] trong trùng hợp anionic của nhóm chức Anken.[123][124][125] Hợp chất Organolithium được chuẩn bị từ lithi kim loại và alkyl halide.[126]
Ứng dụng quân sự
[sửa | sửa mã nguồn]
Lithi kim loại và hỗn hợp Hydride của nó như Li[AlH4] được sử dụng làm chất phụ năng lượng cao để đẩy tên lửa.[20] Li[AlH4] cũng có thể tự chế thành nhiên liệu rắn.[127] Một quả ngư lôi MK-50 chứa hệ thống năng lượng đẩy hóa học (SCEPS) sử dụng một chiếc xe tăng nhỏ chứa khí SF6 rải xuống một khối lithi rắn. Phản ứng sau đó sinh nhiệt, tạo ra hơi nước để đẩy ngư lôi trong một chu kì Rankine khép kín.[128] Hydride lithi chứa lithi-6 được sử dụng trong vũ khí nhiệt hạch để bọc thành lõi của bom hạt nhân.[129]
Hạt nhân
[sửa | sửa mã nguồn]
Lithi-6 có giá trị làm nguồn nguyên liệu để sản xuất Triti và chất hấp thụ neutron trong phản ứng tổng hợp hạt nhân. Lithi tự nhiên chứa khoảng 7.5% lithi-6, từ đó một lượng lớn lithi-6 được sản xuất bằng phép tách đồng vị để sử dụng trong vũ khí hạt nhân.[130] Lithi-7 cũng được quan tâm để sử dụng trong chất lỏng của lò phản ứng hạt nhân.[131] Tritium hòa lẫn với Hydro nặng trong phản ứng tổng hợp hạt nhân chỉ mang tính tương đối để sinh ra sản phẩm. Mặc dù các chi tiết được giữ bí mật, Hydro lithi-6 nặng dường như vẫn có một vai trò làm vật liệu nhiệt hạch trong các vũ khí hạt nhân hiện đại.[132]
Lithi fluoride có tính hóa học ổn định khác thường và hỗn hợp LiF-BeF2 đạt độ nóng chảy thấp. Ngoài ra, 7Li, Be và F là một trong số ít các nuclid với những mặt cắt ngang nhiệt neutron thấp vừa đủ để không đầu độc các phản ứng phân hạt nhân bên trong một lò phản ứng phân hạt nhân.[note 2][133] Lithi cũng được sử dụng làm nguyên liệu cho hạt alpha hoặc hạt nhân heli. Khi 7Li bởi các proton tăng tốc hình thành từ 8Be, nó trải qua quá trình phân hạch để tạo nên hai hạt alpha. Chiến công này do Cockroft và Walton phát hiện năm 1932, được gọi là "tách nguyên tử vào thời điểm đó, đồng thời là phản ứng hạt nhân đầu tiên hoàn toàn do con người thực hiện.[134][135] Các lò phản ứng sử dụng pin lithi để chống lại những tác động ăn mòn từ Acid boric, chất được đưa vào nước để hấp thụ neutron dư thừa.[136]
Y học
[sửa | sửa mã nguồn]Các muối lithi như cacbonat lithi (Li2CO3), citrat lithi và orotat lithi là các chất ổn định thần kinh được sử dụng để điều trị các rối loạn lưỡng cực,[137] vì không giống như phần lớn các loại thuốc ổn định thần kinh khác, chúng trung hòa cả hai sự cuồng và trầm cảm. Lithi có thể được sử dụng để tăng thêm hiệu quả của các thuốc chống trầm cảm khác. Lượng có ích của lithi trong việc này thấp hơn so với mức có độc tính chỉ một chút, vì thế các nồng độ của lithi trong máu phải được kiểm soát kỹ trong quá trình điều trị. Các muối lithi có thể cũng giúp ít trong việc chẩn đoán liên quan như rối loạn schizoaffective và trầm cảm có chu kỳ. Phần tác dụng của muối này là ion lithi Li+.[137] Chúng có thể làm tăng nguy cơ phát triển dị tật Ebstein ở trẻ sinh ra từ các phụ nữ uống lithi trong ba tháng đầu của thai kỳ.[138] Lithi cũng được nghiên cứu với khả năng trị bệnh đau đầu từng chùm.[139]
Cảnh báo
[sửa | sửa mã nguồn]| NFPA 704 "Biểu đồ cháy" |
|---|
| Dấu hiệu cháy kim cương gây nguy hiểm cho lithi kim loại[140] |
Giống như các kim loại kiềm khác, lithi trong dạng đơn chất là một chất dễ cháy và nổ khi để trần ngoài không khí và đặc biệt là trong nước. Lithi kim loại là một chất ăn mòn và yêu cầu có trang thiết bị bảo hộ lao động đặc biệt để chống tiếp xúc trực tiếp với da. Lithi có thể lưu giữ trong các hợp chất không có phản ứng như napta hay hydrocarbon.[141] Các hợp chất lithi không đóng vai trò sinh học tự nhiên gì và được coi là chất độc nhẹ. Khi sử dụng như thuốc, nồng độ Li+ trong máu phải được kiểm soát chặt chẽ.
Quy định
[sửa | sửa mã nguồn]Một số điều luật hạn chế việc bán pin lithi, nguồn có sẵn nhất của lithi dành cho người tiêu dùng bình thường. Lithi có thể được sử dụng để làm giảm Pseudoephedrine và Ephedrine đến ma túy đá trong phương pháp giảm Birch, trong đó sử dụng những giải pháp của kim loại kiềm hòa tan trong muối amonia khan.[142][143] Những thiếu hụt nội bộ từ khiếm khuyết trong sản xuất hoặc thiệt hại về vật lý có thể dẫn đến sự phát nổ tự phát.[144][145]
Tham khảo
[sửa | sửa mã nguồn]- ^ Conventional Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- ^ Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. tr. E110. ISBN 0-8493-0464-4.
- ^ Tổng cục Tiêu chuẩn Đo lường Chất lượng, Bộ Khoa học và Công nghệ (2010). Tiêu chuẩn quốc gia TCVN 5530:2010 về Thuật ngữ hóa học - Danh pháp các nguyên tố và hợp chất hóa học. tr. 29. Bản gốc lưu trữ ngày 14 tháng 7 năm 2020. Truy cập ngày 15 tháng 7 năm 2020.
- ^ FQA. “Lithium là chất gì? Tính chất hóa học, điều chế và ứng dụng của Liti”. fqa.vn.
- ^ a b Numerical data from: Lodders, Katharina (10 tháng 7 năm 2003). “Solar System Abundances and Condensation Temperatures of the Elements” (PDF). The Astrophysical Journal. The American Astronomical Society. 591 (2): 1220–1247. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492. ISSN 0004-637X. Bản gốc (PDF) lưu trữ ngày 7 tháng 11 năm 2015. Truy cập ngày 4 tháng 9 năm 2015. Graphed at File:SolarSystemAbundances.jpg
- ^ Nuclear Weapon Design. Lưu trữ Federation of American Scientists (1998-10-21). fas.org
- ^ Schrauzer, Gerhard N. (2002). “Lithium: occurrence, dietary intakes, nutritional essentiality”. Journal of the American College of Nutrition. 21 (1): 14–21. doi:10.1080/07315724.2002.10719188. PMID 11838882.
- ^ Marshall, Timothy M. (2015). “Lithium as a Nutrient” (PDF). Journal of American Physicians and Surgeons. 20 (4): 104–9.
- ^ a b c d e f g Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 0-313-33438-2.
- ^ Lide, D. R. biên tập (2005). CRC Handbook of Chemistry and Physics (ấn bản thứ 86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ “Nitrogen, N2, Physical properties, safety, MSDS, enthalpy, material compatibility, gas liquid equilibrium, density, viscosity, inflammability, transport properties”. Encyclopedia.airliquide.com. Bản gốc lưu trữ ngày 21 tháng 7 năm 2011. Truy cập ngày 29 tháng 9 năm 2010.
- ^ “Coefficients of Linear Expansion”. Engineering Toolbox.
- ^ Tuoriniemi, J; Juntunen-Nurmilaukas, K; Uusvuori, J; Pentti, E; Salmela, A; Sebedash, A (2007). “Superconductivity in lithium below 0.4 millikelvin at ambient pressure”. Nature. 447 (7141): 187–9. Bibcode:2007Natur.447..187T. doi:10.1038/nature05820. PMID 17495921.
- ^ Struzhkin, V. V.; Eremets, M. I.; Gan, W; Mao, H. K.; Hemley, R. J. (2002). “Superconductivity in dense lithium”. Science. 298 (5596): 1213–5. Bibcode:2002Sci...298.1213S. doi:10.1126/science.1078535. PMID 12386338.
- ^ Overhauser, A. W. (1984). “Crystal Structure of Lithium at 4.2 K”. Physical Review Letters. 53: 64–65. Bibcode:1984PhRvL..53...64O. doi:10.1103/PhysRevLett.53.64.
- ^ Schwarz, Ulrich (2004). “Metallic high-pressure modifications of main group elements”. Zeitschrift für Kristallographie. 219 (6–2004): 376–390. Bibcode:2004ZK....219..376S. doi:10.1524/zkri.219.6.376.34637.
- ^ a b c d e f Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics (ấn bản thứ 81). CRC press. ISBN 0-8493-0481-4.
- ^ THERMO
- ^ a b c d e f g Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. ISBN 0-19-850341-5.
- ^ a b c d Kamienski, Conrad W.; McDonald, Daniel P.; Stark, Marshall W.; Papcun, John R. (2004). “Lithium and lithium compounds”. Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.1209200811011309.a01.pub2.
- ^ “XXIV.—On chemical analysis by spectrum-observations”. Quarterly Journal of the Chemical Society of London. 13 (3): 270. 1861. doi:10.1039/QJ8611300270.
- ^ Krebs, Robert E. (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Publishing Group. tr. 47. ISBN 0-313-33438-2.
- ^ Institute, American Geological; Union, American Geophysical; Society, Geochemical (ngày 1 tháng 1 năm 1994). “Geochemistry international”. 31 (1–4): 115. Chú thích journal cần
|journal=(trợ giúp) - ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. tr. 97–99. ISBN 978-0-08-022057-4.
- ^ Beckford, Floyd. “University of Lyon course online (powerpoint) slideshow”. Bản gốc lưu trữ ngày 4 tháng 11 năm 2005. Truy cập ngày 27 tháng 7 năm 2008.
definitions:Slides 8–10 (Chapter 14)
Kiểm tra giá trị ngày tháng trong:|ngày truy cập=(trợ giúp) - ^ Sapse, Anne-Marie & von R. Schleyer, Paul (1995). Lithium chemistry: a theoretical and experimental overview. Wiley-IEEE. tr. 3–40. ISBN 0-471-54930-4.
- ^ Bretislav Friedrich (ngày 8 tháng 4 năm 2013). “APS Physics”. 6: 42. Chú thích journal cần
|journal=(trợ giúp) - ^ “Magnetism observed in a gas for the first time”. MIT News. Truy cập 29 tháng 9 năm 2015.
- ^ “Isotopes of Lithium”. Berkeley National Laboratory, The Isotopes Project. Bản gốc lưu trữ ngày 13 tháng 5 năm 2008. Truy cập ngày 21 tháng 4 năm 2008.
- ^ File:Binding energy curve - common isotopes.svg shows binding energies of stable nuclides graphically; the source of the data-set is given in the figure background.
- ^ Sonzogni, Alejandro. “Interactive Chart of Nuclides”. National Nuclear Data Center: Brookhaven National Laboratory. Bản gốc lưu trữ ngày 20 tháng 12 năm 2018. Truy cập ngày 6 tháng 6 năm 2008.
- ^ Asplund, M.; và đồng nghiệp (2006). “Lithium Isotopic Abundances in Metal-poor Halo Stars”. The Astrophysical Journal. 644: 229. arXiv:astro-ph/0510636. Bibcode:2006ApJ...644..229A. doi:10.1086/503538.
- ^ Chaussidon, M.; Robert, F.; McKeegan, K.D. (2006). “Li and B isotopic variations in an Allende CAI: Evidence for the in situ decay of short-lived 10Be and for the possible presence of the short−lived nuclide 7Be in the early solar system” (PDF). Geochimica et Cosmochimica Acta. 70 (1): 224–245. Bibcode:2006GeCoA..70..224C. doi:10.1016/j.gca.2005.08.016. Bản gốc (PDF) lưu trữ ngày 18 tháng 7 năm 2010. Truy cập ngày 4 tháng 9 năm 2015.
- ^ Denissenkov, P. A.; Weiss, A. (2000). “Episodic lithium production by extra-mixing in red giants”. Astronomy and Astrophysics. 358: L49–L52. arXiv:astro-ph/0005356. Bibcode:2000A&A...358L..49D.
- ^ Seitz, H.M.; Brey, G.P.; Lahaye, Y.; Durali, S.; Weyer, S. (2004). “Lithium isotopic signatures of peridotite xenoliths and isotopic fractionation at high temperature between olivine and pyroxenes”. Chemical Geology. 212 (1–2): 163–177. doi:10.1016/j.chemgeo.2004.08.009.
- ^ Duarte, F. J (2009). Tunable Laser Applications. CRC Press. tr. 330. ISBN 1-4200-6009-0.
- ^ a b Coplen, T.B.; Bohlke, J.K.; De Bievre, P.; Ding, T.; Holden, N.E.; Hopple, J.A.; Krouse, H.R.; Lamberty, A.; Peiser, H.S.; và đồng nghiệp (2002). “Isotope-abundance variations of selected elements (IUPAC Technical Report)”. Pure and Applied Chemistry. 74 (10): 1987. doi:10.1351/pac200274101987.
- ^ Boesgaard, A. M.; Steigman, G. (1985). “Big bang nucleosynthesis – Theories and observations”. Annual review of astronomy and astrophysics. Palo Alto, CA. 23: 319. Bibcode:1985ARA&A..23..319B. doi:10.1146/annurev.aa.23.090185.001535. A86-14507 04–90.
- ^ Cain, Fraser (ngày 16 tháng 8 năm 2006). “Why Old Stars Seem to Lack Lithium”.
- ^ “First Detection of Lithium from an Exploding Star”. Truy cập ngày 29 tháng 7 năm 2015.
- ^ “Element Abundances” (PDF). Bản gốc (PDF) lưu trữ ngày 1 tháng 9 năm 2006. Truy cập ngày 17 tháng 11 năm 2009.
- ^ Cain, Fraser. “Brown Dwarf”. Universe Today. Lưu trữ bản gốc ngày 25 tháng 2 năm 2011. Truy cập ngày 17 tháng 11 năm 2009.
- ^ Reid, Neill (ngày 10 tháng 3 năm 2002). “L Dwarf Classification”. Truy cập ngày 6 tháng 3 năm 2013.
- ^ a b c d e Lithium Statistics and Information, U.S. Geological Survey, 2015
- ^ “Lithium Occurrence”. Institute of Ocean Energy, Saga University, Japan. Bản gốc lưu trữ ngày 2 tháng 5 năm 2009. Truy cập ngày 13 tháng 3 năm 2009.
- ^ a b c d “Some Facts about Lithium”. ENC Labs. Bản gốc lưu trữ ngày 10 tháng 7 năm 2011. Truy cập ngày 15 tháng 10 năm 2010.
- ^ “Extraction of metals from sea water”. Springer Berlin Heidelberg. 1984. Bản gốc lưu trữ ngày 7 tháng 4 năm 2020. Truy cập ngày 4 tháng 9 năm 2015.
- ^ Atkins, Peter (2010). Shriver & Atkins' Inorganic Chemistry (ấn bản thứ 5). New York: W. H. Freeman and Company. tr. 296. ISBN 0199236178.
- ^ Moores, S. (tháng 6 năm 2007). “Between a rock and a salt lake”. Industrial Minerals. 477: 58.
- ^ Taylor, S. R.; McLennan, S. M.; The continental crust: Its composition and evolution, Blackwell Sci. Publ., Oxford, 330 pp. (1985). Cited in Abundances of the elements (data page)
- ^ Garrett, Donald (2004) Handbook of Lithium and Natural Calcium, Academic Press, cited in The Trouble with Lithium 2, Meridian International Research (2008)
- ^ Clarke, G.M. and Harben, P.W., "Lithium Availability Wall Map". Published June 2009. Referenced at International Lithium Alliance Lưu trữ 2012-10-20 tại Wayback Machine
- ^ a b “The Trouble with Lithium 2” (PDF). Meridian International Research. 2008. Truy cập ngày 29 tháng 9 năm 2010.
- ^ Czech Geological Survey (tháng 10 năm 2015). Mineral Commodity Summaries of the Czech Republic 2015 (PDF). Prague: Czech Geological Survey. tr. 373. ISBN 978-80-7075-904-2.
- ^ Risen, James (ngày 13 tháng 6 năm 2010). “U.S. Identifies Vast Riches of Minerals in Afghanistan”. The New York Times. Truy cập ngày 13 tháng 6 năm 2010.
- ^ Page, Jeremy; Evans, Michael (ngày 15 tháng 6 năm 2010). “Taleban zones mineral riches may rival Saudi Arabia says Pentagon”. The Times. Luân Đôn. Bản gốc lưu trữ ngày 14 tháng 5 năm 2011. Truy cập ngày 4 tháng 9 năm 2015.
- ^ Chassard-Bouchaud, C; Galle, P; Escaig, F; Miyawaki, M (1984). “Bioaccumulation of lithium by marine organisms in European, American, and Asian coastal zones: microanalytic study using secondary ion emission”. Comptes rendus de l'Academie des sciences. Serie III, Sciences de la vie. 299 (18): 719–24. PMID 6440674.
- ^ Schrauzer, GN (2002). “Lithium: Occurrence, dietary intakes, nutritional essentiality”. Journal of the American College of Nutrition. 21 (1): 14–21. doi:10.1080/07315724.2002.10719188. PMID 11838882.
- ^ Zarse, Kim; Terao, Takeshi; Tian, Jing; Iwata, Noboru; Ishii, Nobuyoshi; Ristow, Michael (2011). “Low-dose lithium uptake promotes longevity in humans and metazoans”. European Journal of Nutrition. 50 (5): 387–9. doi:10.1007/s00394-011-0171-x. PMC 3151375. PMID 21301855.
- ^ D'Andraba (1800). “Des caractères et des propriétés de plusieurs nouveaux minérauxde Suède et de Norwège, avec quelques observations chimiques faites sur ces substances”. Journal de chimie et de physique. 51: 239.
- ^ “Petalite Mineral Information”. Mindat.org. Truy cập ngày 10 tháng 8 năm 2009.
- ^ a b c d e f g “Lithium:Historical information”. Truy cập ngày 10 tháng 8 năm 2009.
- ^ Weeks, Mary (2003). Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. tr. 124. ISBN 0-7661-3872-0. Truy cập ngày 10 tháng 8 năm 2009.
- ^ Berzelius (1817). “Ein neues mineralisches Alkali und ein neues Metall” [A new mineral alkali and a new metal]. Journal für Chemie und Physik. 21: 44–48. From p. 45: "Herr August Arfwedson, ein junger sehr verdienstvoller Chemiker, der seit einem Jahre in meinem Laboratorie arbeitet, fand bei einer Analyse des Petalits von Uto's Eisengrube, einen alkalischen Bestandtheil, … Wir haben es Lithion genannt, um dadurch auf seine erste Entdeckung im Mineralreich anzuspielen, da die beiden anderen erst in der organischen Natur entdeckt wurden. Sein Radical wird dann Lithium genannt werden." (Mr. August Arfwedson, a young, very meritorious chemist, who has worked in my laboratory for a year, found during an analysis of petalite from Uto's iron mine, an alkaline component … We've named it lithion, in order to allude thereby to its first discovery in the mineral realm, since the two others were first discovered in organic nature. Its radical will then be named "lithium".)
- ^ “Johan August Arfwedson”. Periodic Table Live!. Bản gốc lưu trữ ngày 7 tháng 10 năm 2010. Truy cập ngày 10 tháng 8 năm 2009.
- ^ “Johan Arfwedson”. Bản gốc lưu trữ ngày 5 tháng 6 năm 2008. Truy cập ngày 10 tháng 8 năm 2009.
- ^ a b c van der Krogt, Peter. “Lithium”. Elementymology & Elements Multidict. Truy cập ngày 5 tháng 10 năm 2010.
- ^ Clark, Jim (2005). “Compounds of the Group 1 Elements”. Truy cập ngày 10 tháng 8 năm 2009.
- ^ C. G. Gmelin (1818) "Von dem Lithon" (On lithium) Annalen der Physik, 59: 238-241. From p. 238: "Es löste sich in diesem ein Salz auf, das an der Luft zerfloss, und nach Art der Strontiansalze den Alkohol mit einer purpurrothen Flamme brennen machte." (There dissolved in this [solvent; namely, absolute alcohol] a salt that deliquesced in air, and in the manner of strontium salts, caused the alcohol to burn with a purple-red flame.)
- ^ a b Enghag, Per (2004). Encyclopedia of the Elements: Technical Data – History –Processing – Applications. Wiley. tr. 287–300. ISBN 978-3-527-30666-4.
- ^ William Thomas Brande, A Manual of Chemistry, …, 2nd ed. (Luân Đôn, England: John Murray, 1821), vol. 2, pp. 57-58.
- ^ Various authors (1818). “The Quarterly journal of science and the arts” (PDF). The Quarterly Journal of Science and the Arts. Royal Institution of Great Britain. 5: 338. Truy cập ngày 5 tháng 10 năm 2010.
- ^ “Timeline science and engineering”. DiracDelta Science & Engineering Encyclopedia. Bản gốc lưu trữ ngày 12 tháng 10 năm 2018. Truy cập ngày 18 tháng 9 năm 2008.
- ^ Brande, William Thomas; MacNeven, William James (1821). A manual of chemistry. Long. tr. 191. Truy cập ngày 8 tháng 10 năm 2010.
- ^ R. Bunsen (1855) "Darstellung des Lithiums" (Preparation of lithium), Annalen der Chemie und Pharmacie, 94: 107-111.
- ^ Green, Thomas (ngày 11 tháng 6 năm 2006). “Analysis of the Element Lithium”. echeat.
- ^ Garrett, Donald E (ngày 5 tháng 4 năm 2004). Handbook of Lithium and Natural Calcium Chloride. tr. 99. ISBN 9780080472904.
- ^ a b Ober, Joyce A. (1994). “Commodity Report 1994: Lithium” (PDF). United States Geological Survey. Truy cập ngày 3 tháng 11 năm 2010.
- ^ Deberylitz, Jürgen; Boche, Gernot (2003). “Lithium und seine Verbindungen – Industrielle, medizinische und wissenschaftliche Bedeutung”. Chemie in unserer Zeit. 37 (4): 258–266. doi:10.1002/ciuz.200300264.
- ^ Bauer, Richard (1985). “Lithium – wie es nicht im Lehrbuch steht”. Chemie in unserer Zeit. 19 (5): 167–173. doi:10.1002/ciuz.19850190505.
- ^ Ober, Joyce A. (1994). “Minerals Yearbook 2007: Lithium” (PDF). United States Geological Survey. Truy cập ngày 3 tháng 11 năm 2010.
- ^ Kogel, Jessica Elzea (2006). “Lithium”. Industrial minerals & rocks: commodities, markets, and uses. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. tr. 599. ISBN 978-0-87335-233-8.
- ^ McKetta, John J. (ngày 18 tháng 7 năm 2007). Encyclopedia of Chemical Processing and Design: Volume 28 – Lactic Acid to Magnesium Supply-Demand Relationships. M. Dekker. ISBN 978-0-8247-2478-8. Truy cập ngày 29 tháng 9 năm 2010.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (ấn bản thứ 2), Oxford: Butterworth-Heinemann, tr. 73, ISBN 0-7506-3365-4
- ^ Ober, Joyce A. “Lithium” (PDF). United States Geological Survey. tr. 77–78. Truy cập ngày 19 tháng 8 năm 2007.
- ^ a b Romero, Simon (ngày 2 tháng 2 năm 2009). “In Bolivia, a Tight Grip on the Next Big Resource”. The New York Times.
- ^ “USGS Mineral Commodities Summaries 2009” (PDF). USGS.
- ^ Money Game Contributors (ngày 26 tháng 4 năm 2013). “New Wyoming Lithium Deposit”. Business Insider. Truy cập ngày 1 tháng 5 năm 2013.
- ^ a b “SQM Announces New Lithium Prices – SANTIAGO, Chile, September 30 /PRNewswire-FirstCall/”. PR Newswire. ngày 30 tháng 9 năm 2009. Truy cập ngày 1 tháng 5 năm 2013.
- ^ Riseborough, Jesse. “IPad Boom Strains Lithium Supplies After Prices Triple”. Bloomberg BusinessWeek. Truy cập ngày 1 tháng 5 năm 2013.
- ^ Parker, Ann. Mining Geothermal Resources Lưu trữ 2017-05-02 tại Wayback Machine. Lawrence Livermore National Laboratory
- ^ Patel, P. (2011-11-16) Startup to Capture Lithium from Geothermal Plants. technologyreview.com
- ^ Wald, M. (2011-09-28) Start-Up in California Plans to Capture Lithium, and Market Share. The New York Times
- ^ “Study finds resource constraints should not be a limiting factor for large-scale EV battery production”. Green Car Congress. ngày 17 tháng 6 năm 2011. Truy cập ngày 17 tháng 6 năm 2011.
- ^ “University of Michigan and Ford researchers see plentiful lithium resources for electric vehicles”. Green Car Congress. ngày 3 tháng 8 năm 2011. Truy cập ngày 11 tháng 8 năm 2011.
- ^ “The Precious Mobile Metal”. The Financialist. Credit Suisse. ngày 9 tháng 6 năm 2014. Truy cập ngày 19 tháng 6 năm 2014.
- ^ Riseborough, Jesse. “IPad Boom Strains Lithium Supplies After Prices Triple”. Bloomberg BusinessWeek. Lưu trữ bản gốc ngày 22 tháng 6 năm 2012. Truy cập ngày 1 tháng 5 năm 2013.Quản lý CS1: bot: trạng thái URL ban đầu không rõ (liên kết)
- ^ a b Martin, Richard (8 tháng 6 năm 2015). “Quest to Mine Seawater for Lithium Advances”. MIT Technology Review. Truy cập ngày 10 tháng 2 năm 2016.
- ^ a b USGS (2011). “Lithium” (PDF). Truy cập ngày 3 tháng 11 năm 2012.
- ^ “Worldwide demand by sector” (PDF). Bản gốc (PDF) lưu trữ ngày 7 tháng 9 năm 2014. Truy cập ngày 13 tháng 9 năm 2015.
- ^ Clark, Jim (2005). “Some Compounds of the Group 1 Elements”. chemguide.co.uk. Truy cập ngày 8 tháng 8 năm 2013.
- ^ “Disposable Batteries - Choosing between Alkaline and Lithium Disposable Batteries”. Batteryreview.org. Truy cập ngày 10 tháng 10 năm 2013.
- ^ “Battery Anodes > Batteries & Fuel Cells > Research > The Energy Materials Center at Cornell”. Emc2.cornell.edu. Truy cập ngày 10 tháng 10 năm 2013.
- ^ Totten, George E.; Westbrook, Steven R. & Shah, Rajesh J. (2003). Fuels and lubricants handbook: technology, properties, performance, and testing. 1. ASTM International. tr. 559. ISBN 0-8031-2096-6.
- ^ Rand, Salvatore J. (2003). Significance of tests for petroleum products. ASTM International. tr. 150–152. ISBN 0-8031-2097-4.
- ^ The Theory and Practice of Mold Fluxes Used in Continuous Casting: A Compilation of Papers on Continuous Casting Fluxes Given at the 61st and 62nd Steelmaking Conference, Iron and Steel Society
- ^ Lu, Y. Q.; Zhang, G. D.; Jiang, M. F.; Liu, H. X.; Li, T. (2011). “Effects of Li2CO3 on Properties of Mould Flux for High Speed Continuous Casting”. Materials Science Forum. 675–677: 877–880. doi:10.4028/www.scientific.net/MSF.675-677.877.
- ^ “Testing 1-2-3: Eliminating Veining Defects”, Modern Casting, tháng 7 năm 2014, Bản gốc lưu trữ ngày 2 tháng 4 năm 2015, truy cập ngày 13 tháng 9 năm 2015
- ^ Haupin, W (1987), Mamantov, Gleb; Marassi, Roberto (biên tập), “Chemical and Physical Properties of the Hall-Héroult Electrolyte”, Molten Salt Chemistry: An Introduction and Selected Applications, Springer, tr. 449
- ^ Davis, Joseph R. ASM International. Handbook Committee (1993). Aluminum and aluminum alloys. ASM International. tr. 121–. ISBN 978-0-87170-496-2. Truy cập ngày 16 tháng 5 năm 2011.
- ^ Karki, Khim; Epstein, Eric; Cho, Jeong-Hyun; Jia, Zheng; Li, Teng; Picraux, S. Tom; Wang, Chunsheng; Cumings, John (2012). “Lithium-Assisted Electrochemical Welding in Silicon Nanowire Battery Electrodes”. Nano Letters. 12 (3): 1392–7. doi:10.1021/nl204063u. PMID 22339576.
- ^ Ernst-Christian, K. (2004). “Special Materials in Pyrotechnics: III. Application of Lithium and its Compounds in Energetic Systems”. Propellants, Explosives, Pyrotechnics. 29 (2): 67–80. doi:10.1002/prep.200400032.
- ^ Wiberg, Egon; Wiberg, Nils and Holleman, Arnold Frederick Inorganic chemistry, Academic Press (2001) ISBN 0-12-352651-5, p. 1089
- ^ Mulloth, L.M. & Finn, J.E. (2005). “Air Quality Systems for Related Enclosed Spaces: Spacecraft Air”. The Handbook of Environmental Chemistry. 4H. tr. 383–404. doi:10.1007/b107253.
- ^ “Application of lithium chemicals for air regeneration of manned spacecraft”. Lithium Corporation of America & Aerospace Medical Research Laboratories. 1965. Bản gốc lưu trữ ngày 7 tháng 10 năm 2012. Truy cập ngày 15 tháng 9 năm 2015.
- ^ “Lithium Perchlorate Oxygen Candle. Pyrochemical Source of Pure Oxygen - I&EC Product Research and Development (ACS Publications)”. Pubs.acs.org. ngày 1 tháng 5 năm 2002. Truy cập ngày 10 tháng 10 năm 2013.
- ^ Hobbs, Philip C. D. (2009). Building Electro-Optical Systems: Making It All Work. John Wiley and Sons. tr. 149. ISBN 0-470-40229-6.
- ^ Point Defects in Lithium Fluoride Films Induced by Gamma Irradiation. Proceedings of the 7th International Conference on Advanced Technology & Particle Physics: (ICATPP-7): Villa Olmo, Como, Italy. 2001. World Scientific. 2002. tr. 819. ISBN 981-238-180-5.
- ^ Sinton, William M. (1962). “Infrared Spectroscopy of Planets and Stars”. Applied Optics. 1 (2): 105. Bibcode:1962ApOpt...1..105S. doi:10.1364/AO.1.000105.
- ^ “You've got the power: the evolution of batteries and the future of fuel cells” (PDF). Toshiba. Bản gốc (PDF) lưu trữ ngày 17 tháng 7 năm 2011. Truy cập ngày 17 tháng 5 năm 2009.
- ^ “Organometallics”. IHS Chemicals. tháng 2 năm 2012.
- ^ Yurkovetskii, A. V.; Kofman, V. L.; Makovetskii, K. L. (2005). “Polymerization of 1,2-dimethylenecyclobutane by organolithium initiators”. Russian Chemical Bulletin. 37 (9): 1782–1784. doi:10.1007/BF00962487.
- ^ Quirk, Roderic P.; Cheng, Pao Luo (1986). “Functionalization of polymeric organolithium compounds. Amination of poly(styryl)lithium”. Macromolecules. 19 (5): 1291–1294. Bibcode:1986MaMol..19.1291Q. doi:10.1021/ma00159a001.
- ^ Stone, F. G. A.; West, Robert (1980). Advances in organometallic chemistry. Academic Press. tr. 55. ISBN 0-12-031118-6.
- ^ Bansal, Raj K. (1996). Synthetic approaches in organic chemistry. tr. 192. ISBN 0-7637-0665-5.
- ^ “an experimental investigation of a lithium akuminum hydride-Hydrogen peroxide hybrid rocket” (PDF). Bản gốc (PDF) lưu trữ ngày 10 tháng 11 năm 2006. Truy cập ngày 10 tháng 11 năm 2006.
- ^ Hughes, T.G.; Smith, R.B. & Kiely, D.H. (1983). “Stored Chemical Energy Propulsion System for Underwater Applications”. Journal of Energy. 7 (2): 128–133. doi:10.2514/3.62644.
- ^ Emsley, John (2011). Nature's Building Blocks.
- ^ Makhijani, Arjun & Yih, Katherine (2000). Nuclear Wastelands: A Global Guide to Nuclear Weapons Production and Its Health and Environmental Effects. MIT Press. tr. 59–60. ISBN 0-262-63204-7.
- ^ National Research Council (U.S.). Committee on Separations Technology and Transmutation Systems (1996). Nuclear wastes: technologies for separations and transmutation. National Academies Press. tr. 278. ISBN 0-309-05226-2.
- ^ Barnaby, Frank (1993). How nuclear weapons spread: nuclear-weapon proliferation in the 1990s. Routledge. tr. 39. ISBN 0-415-07674-9.
- ^ Baesjr, C (1974). “The chemistry and thermodynamics of molten salt reactor fuels”. Journal of Nuclear Materials. 51: 149–162. Bibcode:1974JNuM...51..149B. doi:10.1016/0022-3115(74)90124-X.
- ^ Agarwal, Arun (2008). Nobel Prize Winners in Physics. APH Publishing. tr. 139. ISBN 81-7648-743-0.
- ^ "'Splitting the Atom': Cockcroft and Walton, 1932: 9. Rays or Particles?" Lưu trữ 2012-09-02 tại Wayback Machine Department of Physics,University of Cambridge
- ^ Wald, Matthew L. (ngày 8 tháng 10 năm 2013). “Report Says a Shortage of Nuclear Ingredient Looms”. The New York Times.
- ^ a b Kean, Sam (2011). The Disappearing Spoon.
- ^ Yacobi S; Ornoy A (2008). “Is lithium a real teratogen? What can we conclude from the prospective versus retrospective studies? A review”. Isr J Psychiatry Relat Sci. 45 (2): 95–106. PMID 18982835.
- ^ Lieb, J; Zeff (1978). “Lithium treatment of chronic cluster headaches”. The British Journal of Psychiatry. 133 (133): 556–558. doi:10.1192/bjp.133.6.556. Truy cập ngày 24 tháng 2 năm 2014.
- ^ Technical data for Lithium. periodictable.com
- ^ Furr, A. K. (2000). CRC handbook of laboratory safety. Boca Raton: CRC Press. tr. 244–246. ISBN 978-0-8493-2523-6.
- ^ “Illinois Attorney General – Basic Understanding Of Meth”. Illinoisattorneygeneral.gov. Bản gốc lưu trữ ngày 10 tháng 9 năm 2010. Truy cập ngày 6 tháng 10 năm 2010.
- ^ Harmon, Aaron R. (2006). “Methamphetamine remediation research act of 2005: Just what the doctor ordered for cleaning up methfields—or sugar pill placebo?” (PDF). North Carolina Journal of Law & Technology. 7. Bản gốc (PDF) lưu trữ ngày 1 tháng 12 năm 2008. Truy cập ngày 5 tháng 10 năm 2010.
- ^ Bro, Per & Levy, Samuel C. (1994). Battery hazards and accident prevention. New York: Plenum Press. tr. 15–16. ISBN 978-0-306-44758-7.
- ^ “TSA: Safe Travel with Batteries and Devices”. Tsa.gov. ngày 1 tháng 1 năm 2008. Bản gốc lưu trữ ngày 4 tháng 1 năm 2012.
Ghi chú
[sửa | sửa mã nguồn]- ^ a b Apendixes. By USGS definitions, the reserve base "may encompass those parts of the resources that have a reasonable potential for becoming economically available within planning horizons beyond those that assume proven technology and current economics. The reserve base includes those resources that are currently economic (reserves), marginally economic (marginal reserves), and some of those that are currently subeconomic (subeconomic resources)."
- ^ Beryllium and fluorine occur only as one isotope, 9Be and 19F respectively. These two, together with 7Li, as well as 2H, 11B, 15N, 209Bi, and the stable isotopes of C, and O, are the only nuclides with low enough thermal neutron capture cross sections aside from actinides to serve as major constituents of a molten salt breeder reactor fuel.
Liên kết ngoài
[sửa | sửa mã nguồn]- Lithium (Li) (chemical element) tại Encyclopædia Britannica (tiếng Anh)
- Lithi tại Từ điển bách khoa Việt Nam
- USGS: Lithium Statistics and Information
- WebElements.com – Lithium
- EnvironmentalChemistry.com – Lithium
- It's Elemental – Lithium
- Los Alamos National Laboratory – Lithium Lưu trữ 2008-12-23 tại Wayback Machine
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
 GIẢM
32%
GIẢM
32%
 GIẢM
14%
GIẢM
14%
 GIẢM
21%
GIẢM
21%
 GIẢM
30%
GIẢM
30%














