Chì
| Chì, 82Pb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất chung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tên, ký hiệu | Chì, Pb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phiên âm | /ˈlɛd/ led | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hình dạng | Ánh kim xám | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chì trong bảng tuần hoàn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số nguyên tử (Z) | 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Khối lượng nguyên tử chuẩn (Ar) | 207,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phân loại | kim loại yếu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhóm, phân lớp | 14, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chu kỳ | Chu kỳ 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu hình electron | [Xe] 4f14 5d10 6s2 6p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
mỗi lớp | 2, 8, 18, 32, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất vật lý | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Màu sắc | Ánh kim xám | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái vật chất | Chất rắn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ nóng chảy | 600,61 K (327,46 °C, 621,43 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ sôi | 2022 K (1749 °C, 3180 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ | 11,34 g·cm−3 (ở 0 °C, 101.325 kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ ở thể lỏng | ở nhiệt độ nóng chảy: 10,66 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt lượng nóng chảy | 4,77 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt bay hơi | 179,5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt dung | 26,650 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Áp suất hơi
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất nguyên tử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái oxy hóa | 4, 2 Lưỡng tính | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ âm điện | 2,33 (Thang Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Năng lượng ion hóa | Thứ nhất: 715,6 kJ·mol−1 Thứ hai: 1450,5 kJ·mol−1 Thứ ba: 3081,5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính cộng hoá trị | thực nghiệm: 175 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính liên kết cộng hóa trị | 146±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính van der Waals | 202 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thông tin khác | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu trúc tinh thể | Lập phương tâm mặt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ giãn nở nhiệt | 28,9 µm·m−1·K−1 (ở 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ dẫn nhiệt | 35,3 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điện trở suất | ở 20 °C: 208 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất từ | Nghịch từ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun Young | 16 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun cắt | 5,6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun khối | 46 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hệ số Poisson | 0,44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Mohs | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Brinell | 38,3 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số đăng ký CAS | 7439-92-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đồng vị ổn định nhất | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bài chính: Đồng vị của Chì | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chì là một nguyên tố hóa học trong bảng tuần hoàn hóa học viết tắt là Pb (Latin: Plumbum) và có số nguyên tử là 82. Chì có hóa trị phổ biến là II, có khi là IV. Chì là một kim loại mềm, nặng, độc hại và có thể tạo hình. Chì có màu trắng xanh khi mới cắt nhưng bắt đầu xỉn màu thành xám khi tiếp xúc với không khí. Chì dùng trong xây dựng, pin sạc, đạn, và là một phần của nhiều hợp kim. Chì có số nguyên tố cao nhất trong các nguyên tố bền.
Khi tiếp xúc ở một mức độ nhất định, chì là chất độc đối với động vật cũng như con người. Nó gây tổn thương cho hệ thần kinh và gây ra rối loạn não. Tiếp xúc ở mức cao cũng gây ra rối loạn máu ở động vật. Giống với thủy ngân, chì là chất độc thần kinh tích tụ trong mô mềm và trong xương. Nhiễm độc chì đã được ghi nhận từ thời La Mã cổ đại, Hy Lạp cổ đại, và Trung Quốc cổ đại.
Lịch sử
[sửa | sửa mã nguồn]

Chì từng được sử dụng phổ biến hàng ngàn năm trước do sự phân bố rộng rãi của nó, dễ chiết tách và dễ gia công. Nó dễ dát mỏng và dễ uốn cũng như dễ nung chảy. Các hạt chì kim loại có tuổi 6400 TCN đã được tìm thấy ở Çatalhöyük, Thổ Nhĩ Kỳ ngày nay.[6] Vào đầu thời kỳ đồ đồng, chì được sử dụng cùng với antimon và asen.
Nhà sản xuất chì lớn nhất trước thời kỳ công nghiệp là nền kinh tế La Mã, với sản lượng hàng năm 80.000 tấn, đặc biệt chúng là phụ phẩm của quá trình nung chảy bạc.[5][7][8] Hoạt động khai thác mỏ của La Mã diễn ra ở Trung Âu, Anh thuộc La Mã, Balkans, Hy Lạp, Tiểu Á; riêng ở Hispania chiếm 40% sản lượng toàn cầu.[5]
Các ống chì La Mã thường khảm lên phù hiệu của các hoàng đế La Mã. Đường ống dẫn nước bằng chì ở Tây Latin có thể đã được duy trì vượt qua thời kỳ Theodoric Đại đế tới tận thời Trung Cổ.[9] Một số thỏi chì La Mã tượng trưng cho lịch sử khai thác chì Derbyshire và trong lịch sử công nghiệp của các trung tâm kinh tế ở Anh khác. Người La Mã cũng sử dụng chì nóng chảy để giữ các chân trụ sắt gắn kết với các khối đá vôi lớn ở các nhà thờ nhất định. Trong giả kim thuật, chì từng được cho là kim loại cổ nhất và liên quan đến Sao Thổ. Các nhà giả kim thuật sử dụng biểu tượng của Sao Thổ (♄) để ám chỉ chì.
Ký hiệu của chì Pb là chữ viết tắt từ tên tiếng Latin plumbum nghĩa là kim loại mềm; có nguồn gốc từ plumbum nigrum ("plumbum màu đen"), trong khi plumbum candidum (nghĩa là "plumbum sáng màu") là thiếc.
Tính chất vật lý
[sửa | sửa mã nguồn]Chì có màu trắng bạc và sáng, bề mặt cắt còn tươi của nó xỉ nhanh trong không khí tạo ra màu tối. Nó là kim loại màu trắng xanh, rất mềm, dễ uốn và nặng, và có tính dẫn điện kém so với các kim loại khác. Chì có tính chống ăn mòn cao, và do thuộc tính này, nó được sử dụng để chứa các chất ăn mòn (như acid sulfuric). Do tính dễ dát mỏng và chống ăn mòn, nó được sử dụng trong các công trình xây dựng như trong các tấm phủ bên ngoài các khới lợp. Chì kim loại có thể làm cứng bằng cách thêm vào một lượng nhỏ antimon, hoặc một lượng nhỏ các kim loại khác như calci.
Chì dạng bột cháy cho ngọn lửa màu trắng xanh. Giống như nhiều kim loại, bộ chì rất mịn có khả năng tự cháy trong không khí.[10] Khói độc phát ra khi chì cháy.
Tính chất hóa học
[sửa | sửa mã nguồn]Các dạng oxy hóa khác nhau của chì dễ dàng bị khử thành kim loại. Ví dụ như khi nung PbO với các chất khử hữu cơ như glucose. Một hỗn hợp oxide và sulfide chì nung cùng nhau cũng tạo thành kim loại.[11]
- 2 PbO + PbS → 3 Pb + SO2
Chì kim loại chỉ bị oxy hóa ở bề ngoài trong không khí tạo thành một lớp chì oxide mỏng, chính lớp oxide này lại là lớp bảo vệ chì không bị oxy hóa tiếp. Chì kim loại không phản ứng với các acid sulfuric hoặc clohydric. Nó hòa tan trong acid nitric giải phóng khí nitơ oxide và tạo thành dung dịch chứa Pb(NO3)2.
- 3 Pb + 8 H+ + 8 NO−
3 → 3 Pb2+ + 6 NO−
3 + 2 NO + 4 H2O
Khi nung với các nitrat của kim loại kiềm, chì bị oxy hóa thành PbO, và kim loại kiềm nitrat. PbO đặc trưng cho mức oxy hóa +2 của chì. Nó hòa tan trong acid nitric và acetic tạo thành các dung dịch có khả năng kết tủa các muối của chì sulfat, Chromiat, cacbonat (PbCO3), và Pb3(OH)2(CO3)2. Chì sulfide cũng có thể được kết tủa từ các dung dịch acetat. Các muối này đều rất kém hòa tan trong nước. Trong số các muối halide, iodide là ít hòa tan hơn bromide, và bromide ít hòa tan hơn chloride.[12]
Chì(II) oxide cũng hòa tan trong các dung dịch hydroxide kim loại kiềm để tạo thành muối plumbit tương ứng.[11]
- PbO + 2 OH− + H2O → Pb(OH)2−
4
Clo hóa các dung dịch muối trên sẽ tạo ra chì có trạng thái oxy hóa +4.
- Pb(OH)2−
4 + Cl2 → PbO2 + 2 Cl− + 2 H2O
Chì dioxide là một chất oxy hóa mạnh. Muối clo ở trạng thái oxy hóa này khó được tạo ra và dễ bị phân hủy thành chì(II) chloride và khí clo. Muối iodide và bromide của chì(IV) không tồn tại.[12] Chì dioxide hòa tan trong các dung dịch hydroxide kim loại kiềm để tạo ra các muối plumbat tương ứng.[11]
- PbO2 + 2 OH− + 2 H2O → Pb(OH)2−
6
Chì cũng có trạng thái oxy hóa trộn lẫn giữa +2 và +4, đó là chì đỏ (Pb
3O
4).
Chì dễ dàng tạo thành hợp kim đồng mol với kim loại natri, hợp kim này phản ứng với các alkyl halide tạo thành các hợp chất hữu cơ kim loại của chì như tetraethyl chì.[13]
Các phức chất với clo
[sửa | sửa mã nguồn]Các hợp chất chì(II) tạo một loạt các phức chất với ion chloride, với sự hình thành của chúng làm thay đổi sự ăn mòn hóa học của chì. Quá trình này sẽ hạn chế khả năng hòa tan của chì trong môi trường mặn.
| Pb2+ + Cl− → PbCl+ | K1 = 12,59 |
| PbCl+ + Cl− → PbCl2 | K2 = 14,45 |
| PbCl2 + Cl− → PbCl3− | K3 = 3,98 ×10−1 |
| PbCl3− + Cl− → PbCl42− | K4 = 8,92 × 10−2 |
Các biểu đồ pha hòa tan của chì
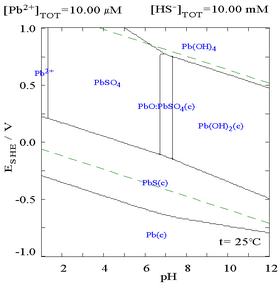
[sửa | sửa mã nguồn]Chì(II) sulfat có khả năng hòa tan kém, như thể hiện trên biểu đồ pha khi thêm SO42− vào dung dịch 0,1 M Pb2+. pH của dung dịch là 4,5, và khi lớn hơn giá trị đó, nồng độ Pb2+ có thể không bao giờ đạt đến 0,1 M do sự tạo thành Pb(OH)2. Quan sát sự hòa tan của Pb2+ giảm 10.000 lần khi SO42− đạt đến 0,1 M.

|
|
| Đồ thị biểu diễn nồng độ dung dịch của Pb2+ hòa tan biến thiên theo SO42− | Biểu đồ biểu diễn chì trong dung dịch sulfat |
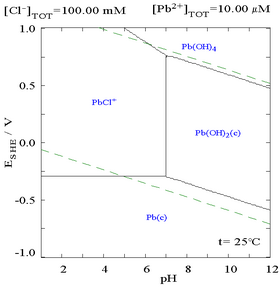
Khi thêm chloride vào có thể làm giảm khả năng hòa tan của chì, mặc dù trong dung dịch giàu chloride (như aqua regia) thì chì có thể hòa tan trở lại ở dạng anion phức-clo.

|
|
| Đồ thị biểu diễn khả năng hòa tan của chì trong dung dịch cloura. Các giá trị nồng độ chì được biểu diễn theo tổng chloride. |
Biểu đồ biểu diễn chì trong dung dịch chloride (0,1 M) |
Đồng vị
[sửa | sửa mã nguồn]Một đồng vị phân rã từ phóng xạ phổ biến là 202Pb, có chu kỳ bán rã là 53.000 năm.[15]
Tất cả các đồng vị của chì, trừ chì 204, có thể được tìm thấy ở dạng các sản phẩm cuối của quá trình phân rã phóng xạ của các nguyên tố nặng hơn như urani và thori.
Phân bố
[sửa | sửa mã nguồn]
Chì kim loại có tồn tại trong tự nhiên nhưng ít gặp. Chì thường được tìm thấy ở dạng quặng cùng với kẽm, bạc, và (phổ biến nhất) đồng, và được thu hồi cùng với các kim loại này. Khoáng chì chủ yếu là galena (PbS), trong đó chì chiếm 86,6% khối lượng. Các dạng khoáng chứa chì khác như cerussite (PbCO3) và anglesite (PbSO4).
Chế biến quặng
[sửa | sửa mã nguồn]
Hầu hết quặng chì chứa ít hơn 10% chì, và các quặng chứa ít nhất 3% chì có thể khai thác có hiệu quả kinh tế. Quặng được nghiền và cô đặc bằng tuyển nổi bọt thông thường đạt đến 70% hoặc hơn. Các quặng sulfide được thiêu kết chủ yếu tạo ra chì oxide và một hỗn hợp sulfat và silicat của chì và các kim loại khác có trong quặng.[16]
Chì oxide từ quá trình thiêu kết được khử trong lò cao bằng than cốc.[17] Quá trình này chuyển hầu hết chì thành dạng kim loại. Ba lớp khác tách biệt nhau trong quá trình này và nổi lên đỉnh của chì kim loại. Chúng là xỉ (silicat chứa 1,5% chì), matte (sulfide chứa 15% chì), và speiss (asenua của sắt và đồng). Các chất thải này chứa chì, kẽm, cadmi, và bismuth ở các mức hàm lượng có thể được thu hồi một cách có kinh tế.[16]
Chì kim loại tạo ra từ các quá trình thiêu kết và lò cao vẫn chứa một hàm lượng đáng kể các tạp chất asen, antimon, bismuth, kẽm, đồng, bạc và vàng. Dung dịch nóng chảy được xử lý trong lò lửa quặt với không khí, hơi nước và lưu huỳnh để oxy hóa các tạp chất, trừ bạc, vàng và bismuth. Các tạp chất đã bị oxy hóa sẽ bị loại bỏ khi chúng nổi lên đỉnh.[16][18]
Hầu hết các quặng chì chứa một lượng đáng kể bạc, và kim loại nóng chảy cũng chứa bạc ở dạng tạp chất. Bạc kim loại cũng như vàng bị loại ra và được thu hồi bằng phương pháp Parkes.[11][16][18]
Chì sau khi được tách bạc ra sẽ tiếp tục loại bỏ bismuth bằng phương pháp Betterton-Kroll bằng cách xử lý hỗn hợp chì với calci và magnesi kim loại để loại bỏ bismuth.[16][18]
Chì rất tinh khiết có thể được thu hồi bằng quá trình điện phân chì nóng chảy theo phương pháp Betts. Phương pháp điện phân này sử dụng anốt là chì không tinh khiết và catốt là chì tinh khiết trong một bể điện phân với chất điện li là chì fluorosilicat (PbSiF6) và acid hexafluorosilicic (H2SiF6).[16][18]
Sản xuất và tái chế
[sửa | sửa mã nguồn]
Sản xuất và tiêu thụ chì đang tăng trên toàn thế giới. Tổng sản lượng hàng năm vào khoảng 8 triệu tấn; khoảng phân nửa được sản xuất từ tái chế. Đến năm 2008, các nước sản xuất chì dẫn đầu là Úc, Trung Quốc, Việt Nam, Vương Quốc Anh, Na Uy, Hoa Kỳ, Peru, Canada, Mexico, Thụy Điển, Morocco, Ai Cập, Nam Phi, Hi Lạp, Iceland, Đức, Hàn Quốc, Nga, Áo, Phần Lan, Đan Mạch, Israel, Ấn Độ, Ireland, Nhật Bản, Guatemala, Bỉ, Ý, Pháp, Tây Ban Nha, Bồ Đào Nha, Brazil. Trung Quốc và Hoa Kỳ chiếm hơn phân nửa sản lượng nguyên thủy (không tính tái chế).[19]
Đến năm 2010, 9,6 triệu tấn chì đã được sản xuất, trong đó 4,1 triệu tấn từ khai thác mỏ.[20]
Với tốc độ sử dụng hiện tại, nguồn cung ứng chì ước tính sẽ cạn kiệt trong vòng 42 năm nữa.[21] Theo phân tích của Lester Brown thì ông cho rằng chì có thể cạn kiệt trong vòng 18 năm nữa nếu tốc độ sử dụng gia tăng 2% mỗi năm.[22] Điều này có thể cần được xem xét lại khi tính tới sự quan tâm mới được phục hồi trong việc tái chế, và tiến bộ nhanh trong công nghệ tế bào nhiên liệu.
Ứng dụng
[sửa | sửa mã nguồn]- Chì là thành phần chính tạo nên ắc quy, sử dụng cho xe.
- Chì được sử dụng như chất nhuộm trắng trong sơn.
- Chì sử dụng như thành phần màu trong tráng men đặc biệt là tạo màu đỏ và vàng.[23]
- Chì dùng làm các tấm ngăn để chống phóng xạ hạt nhân.
- Chì thường được sử dụng trong nhựa PVC[24][25]
Ảnh hưởng đến sức khỏe
[sửa | sửa mã nguồn]Chì là một kim loại độc có thể gây tổn hại cho hệ thần kinh, đặc biệt là ở trẻ em và có thể gây ra các chứng rối loạn não và máu. Ngộ độc chì chủ yếu từ đường thức ăn hoặc nước uống có nhiễm chì; nhưng cũng có thể xảy ra sau khi vô tình nuốt phải các loại đất hoặc bụi nhiễm chì hoặc sơn gốc chì.[26] Tiếp xúc lâu ngày với chì hoặc các muối của nó hoặc các chất oxy hóa mạnh như PbO2) có thể gây bệnh thận, và các cơn đau bất thường giống như đau bụng. Đối với phụ nữ mang thai, khi tiếp xúc với chì ở mức cao có thể bị sẩy thai. Tiếp xúc lâu dài và liên tục với chì làm giảm khả năng sinh sản và sinh dục ở nam giới.[27] Thuốc giải hoặc điều trị nhiễm độc chì là dimercaprol và succimer.
| NFPA 704 "Biểu đồ cháy" |
|---|
| "Hình thoi cháy" của hạt chì |
Sự quan tâm đến vai trò của chì trong việc giảm nhận thức ở trẻ em đã phổ biến rộng rãi việc giảm sử dụng nó (tiếp xúc với chì liên quan đến giảm khả năng học).[28] Hầu hết các trường hợp hàm lượng chì trong máu cao ở người lớn liên quan đến nơi làm việc.[29] Hàm lượng chì trong máu cao liên quan với tuổi dậy thì ở bé gái.[30] Ảnh hưởng của chì cũng làm giảm vĩnh viễn khả năng nhận thức của trẻ em khi tiếp xúc ở mức cực kỳ thấp.[31]
Trong suốt thế kỷ XX, việc sử dụng chì làm chất tạo màu trong sơn đã giảm mạnh do những mối nguy hiểm từ ngộ độc chì, đặc biệt là ở trẻ em.[32][33] Vào giữa thập niên 1980, có sự thay đổi đáng kể trong cách thức chấm dứt sử dụng chì. Hầu hết sự thay đổi này là kết quả của sự tuân thủ của người tiêu dùng Mỹ với cách quy tắc môi trường đã làm giảm đáng kể hoặc loại hẳn việc sử dụng chì trong các sản phẩm khác pin như xăng, sơn, chì hàn, và hệ thống nước. Sử dụng chì đang được Liên minh châu Âu cắt giảm theo chỉ thị RoHS. Chì vẫn có thể được tìm thấy với lượng có thể gây hại trong gốm làm từ cát, vinyl (sử dụng làm ống và phần cách điện của dây điện), và đồng được sản xuất tại Trung Quốc. Giữa năm 2006 và 2007, các đồ chơi trẻ em sản xuất tại Trung Quốc đã bị thu hồi, nguyên nhân cơ bản là sơn chứa chì được sử dụng để tạo màu cho sản phẩm.[34][35]
Các muối chì được sử dụng trong men gốm đôi khi gây ngộ độc, khi các nước uống có tính acid như nước ép trái cây, đã làm rò rỉ các ion chì ra khỏi men.[36] Chì(II) axetat đã từng được đế quốc La Mã sử dụng để làm cho rượu ngọt hơn, và một số người xem đây là nguyên nhân của chứng mất trí của một số hoàng đế La Mã.[37]
Chì làm ô nhiễm đất cũng là một vấn đề cần quan tâm, vì chì có mặt trong các mỏ tự nhiên và cũng có thể đi vào đất thông qua sự rò rỉ từ gasoline của các bồn chứa dưới mặt đất hoặc các dòng thảy của sơn chứa chì hoặc từ các nguồn của các ngành công nghiệp sử dụng chì.
Chì trong không khí có thể bị hít vào hoặc ăn sau khi nó lắng đọng. Nó bị hấp thụ nhanh chóng vào máu và được tin là có ảnh hưởng đến hệ thần kinh trung ương, tim mạch, thận, và hệ miễn dịch.[38]
Đặc điểm sinh hóa của ngộ độc chì
[sửa | sửa mã nguồn]Trong cơ thể người, chì ức chế tổng hợp porphobilinogen synthase và ferrochelatase, chống lại sự hình thành cả hai chất porphobilinogen và kết hợp với sắt tạo thành protoporphyrin IX, giai đoạn cuối cùng trong sự tổng hợp heme. Quá trình này làm cho sự tổng hợp heme không hiệu quả và sau đó làm microcytic anemia.[39] Ở các mức thấp hơn, nó có vai trò tương tự như calci, can thiệp vào các kênh ion trong quá trình truyền dẫn thần kinh. Đây là một trong những cơ chế mà theo đó nó can thiệp vào nhận thức. Nhiễm độc chì cấp tính được chữa trị bằng cách sử dụng dinatri calci edetat: là calci chelat của muối dinatri của acid ethylene-diamine-tetracetic (EDTA). Chất này có ái lực lớn với chì hơn là calci và do đó tạo ra chì chelat bằng các trao đổi ion. Chất này sau đó được bài tiết qua đường tiểu, trong khi calci còn lại là vô hại.[40]
Rò rỉ chì từ các bề mặt kim loại
[sửa | sửa mã nguồn]Biểu đồ Pourbaix bên dưới cho thấy chì dễ ăn mòn trong môi trường citrat hơn trong môi trường không tạo phức. Phần trung tâm của biểu đồ cho thấy rằng kim loại chì bị oxy hóa dễ dàng trong môi trường citrat hơn là trong nước thông thường.
Tham khảo
[sửa | sửa mã nguồn]- ^ Được cho là trải qua quá trình phân rã alpha thành 200Hg với chu kỳ bán rã hơn 1,4×1020 năm.
- ^ Giới hạn dưới thực nghiệm là t1/2 > 2,5×1021 năm; thời gian tồn tại lý thuyết cho sự phân rã alpha thành 202Hg là > 1065 năm.
- ^ Giới hạn dưới thực nghiệm là t1/2 > 1,9×1021> năm; thời gian tồn tại lý thuyết cho sự phân rã alpha thành 203Hg là > 10152 năm.
- ^ Giới hạn dưới thực nghiệm là t1/2 > 2,6×1021 năm; thời gian tồn tại lý thuyết cho sự phân rã alpha thành 204Hg là > 10124 năm.
- ^ a b c Hong, Sungmin; Candelone, Jean-Pierre; Patterson, Clair Cameron; Boutron, Claude F. (1994). “Greenland Ice Evidence of Hemispheric Lead Pollution Two Millennia Ago by Greek and Roman Civilizations”. Science. 265 (5180): 1841–1843. Bibcode:1994Sci...265.1841H. doi:10.1126/science.265.5180.1841. PMID 17797222.
- ^ Heskel, Dennis L. (1983). “A Model for the Adoption of Metallurgy in the Ancient Middle East”. Current Anthropology. 24 (3): 362–366. doi:10.1086/203007.
- ^ Callataÿ, François de (2005). “The Graeco-Roman Economy in the Super Long-Run: Lead, Copper, and Shipwrecks”. Journal of Roman Archaeology. 18: 361–372 (361–365).
- ^ Settle, Dorothy M.; Patterson, Clair C. (1980). “Lead in Albacore: Guide to Lead Pollution in Americans”. Science. 207 (4436): 1167–1176. Bibcode:1980Sci...207.1167S. doi:10.1126/science.6986654. PMID 6986654. see 1170f.
- ^ Squatriti, Paolo biên tập (2000). Working with water in medieval Europe: technology and resource use. Leiden: Brill. tr. 134 ff. ISBN 9789004106802.
- ^ Charles, J.; Kopf, P. W.; Toby, S. (1966). “The Reaction of Pyrophoric Lead with Oxygen”. Journal of Physical Chemistry. 70: 1478. doi:10.1021/j100877a023.
- ^ a b c d Linus, Pauling (1947). General Chemistry. W.H. Freeman. ISBN 0486656225.
- ^ a b Brady, James E.; Holum, John R. (1996). Descriptive Chemistry of the Elements. John Wiley and Sons. ISBN 0-471-13557-7.
- ^ Windholz, Martha (1976). Merck Index of Chemicals and Drugs, 9th ed., monograph 8393. Merck. ISBN 0911910263.
- ^ Ward, C. H.; Hlousek, Douglas A.; Phillips, Thomas A.; Lowe, Donald F. (2000). Remediation of Firing Range Impact Berms. CRC Press. ISBN 1566704626.
- ^ Georges, Audi (2003). “The NUBASE Evaluation of Nuclear and Decay Properties”. Nuclear Physics A. Atomic Mass Data Center. 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ a b c d e f Samans, Carl H. (1949). Engineering Metals and their Alloys. MacMillan.
- ^ “Primary Extraction of Lead Technical Notes”. LDA International. Bản gốc lưu trữ ngày 22 tháng 3 năm 2007. Truy cập ngày 7 tháng 4 năm 2007.
- ^ a b c d “Primary Lead Refining Technical Notes”. LDA International. Lưu trữ bản gốc ngày 22 tháng 3 năm 2007. Truy cập ngày 7 tháng 4 năm 2007.
- ^ “Lead Information”. LDA International. Lưu trữ bản gốc ngày 27 tháng 8 năm 2007. Truy cập ngày 5 tháng 9 năm 2007.
- ^ "Mine Production: 4,117, 000 tonnes; Metal Production: 9,604,000 tonnes; Metal Usage: 9,569,000 tonnes" from “Lead and Zinc Statistics”. International Lead and Zinc Study Group. Bản gốc lưu trữ ngày 26 tháng 1 năm 2012. Truy cập ngày 26 tháng 9 năm 2011. (See also their definitions of terms Lưu trữ 2012-01-21 tại Wayback Machine.)
- ^ “How Long Will it Last?”. New Scientist. 194 (2605): 38–39. ngày 26 tháng 5 năm 2007. Bibcode:2007NewSc.194...38R. doi:10.1016/S0262-4079(07)61508-5. ISSN 0262-4079.
- ^ Brown, Lester (2006). Plan B 2.0: Rescuing a Planet Under Stress and a Civilization in Trouble. New York: W.W. Norton. tr. 109. ISBN 0393328317.
- ^ Leonard, Alvin R.; Lynch, Glenn (1958). “Dishware as a Possible Source for Lead Poisoning”. Calif. Med. 89 (6): 414–416. PMC 1512529. PMID 13608300.
- ^ Zweifel, Hans (2009). Plastics Additives Handbook. Hanser Verlag. tr. 438. ISBN 9783446408012.
- ^ Wilkes, C. E.; Summers, J. W.; Daniels, C. A.; Berard, M. T. (2005). PVC handbook. München: Hanser. tr. 106. ISBN 9781569903797.
- ^ “ToxFAQs: CABS/Chemical Agent Briefing Sheet: Lead” (PDF). Agency for Toxic Substances and Disease Registry/Division of Toxicology and Environmental Medicine. 2006. Lưu trữ bản gốc ngày 4 tháng 3 năm 2010. Truy cập ngày 3 tháng 3 năm 2012.Quản lý CS1: bot: trạng thái URL ban đầu không rõ (liên kết)
- ^ Golub, Mari S. biên tập (2005). “Summary”. Metals, fertility, and reproductive toxicity. Boca Raton, Fla.: Taylor and Francis. tr. 153. ISBN 9780415700405.
- ^ Hu, Howard (1991). “Knowledge of diagnosis and reproductive history among survivors of childhood plumbism”. American Journal of Public Health. 81 (8): 1070–1072. doi:10.2105/AJPH.81.8.1070. PMC 1405695. PMID 1854006.
- ^ “NIOSH Adult Blood Lead Epidemiology and Surveillance”. United States National Institute for Occupational Safety and Health. Truy cập ngày 4 tháng 10 năm 2007.
- ^ Schoeters, Greet; Den Hond, Elly; Dhooge, Willem; Van Larebeke, Nik; Leijs, Marike (2008). “Endocrine Disruptors and Abnormalithies of Pubertal Development”. Basic & Clinical Pharmacology & Toxicology. 102 (2): 168–175. doi:10.1111/j.1742-7843.2007.00180.x. PMID 18226071.
- ^ Needleman, Herbert L.; Schell, Alan; Bellinger, David; Leviton, Alan; Allred, Elizabeth N. (1990). “The long-term effects of exposure to low doses of lead in childhood. An 11-year follow-up report”. New England Journal of Medicine. 322 (2): 83–88. doi:10.1056/NEJM199001113220203. PMID 2294437.
- ^ “Download: Lead paint: Cautionary note” (PDF). Queensland Government. Truy cập ngày 7 tháng 4 năm 2007.[liên kết hỏng]
- ^ “Lead Paint Information”. Master Painters, Australia. Lưu trữ bản gốc ngày 12 tháng 2 năm 2008. Truy cập ngày 7 tháng 4 năm 2007.Quản lý CS1: bot: trạng thái URL ban đầu không rõ (liên kết)
- ^ Mattel issues new massive China toy recall - Business - Consumer news - msnbc.com
- ^ Lead Paint Prompts Mattel to Recall 967,000 Toys - New York Times
- ^ “CPG Sec. 545.450 Pottery (Ceramics); Import and Domestic – Lead Contamination”. U.S. Food and Drug Administration. Truy cập ngày 2 tháng 2 năm 2010.
- ^ Angier, Natalie (ngày 21 tháng 8 năm 2007). “The Pernicious Allure of Lead”. New York Times. Truy cập ngày 7 tháng 5 năm 2010.
- ^ Bergeson, Lynn L. (2008). “The proposed lead NAAQS: Is consideration of cost in the clean air act's future?”. Environmental Quality Management. 18: 79. doi:10.1002/tqem.20197.
- ^ Cohen, Alan R.; Trotzky, Margret S.; Pincus, Diane (1981). “Reassessment of the Microcytic Anemia of Lead Poisoning”. Pediatrics. 67 (6): 904–906. PMID 7232054.
- ^ Laurence, D. R. (1966). Clinical Pharmacology(Third Edition).
Đọc thêm
[sửa | sửa mã nguồn]- Keisch, B.; Feller, R. L.; Levine, A. S.; Edwards, R. R. (1967). “Dating and Authenticating Works of Art by Measurement of Natural Alpha Emitters”. Science. 155 (3767): 1238–1242. Bibcode:1967Sci...155.1238K. doi:10.1126/science.155.3767.1238. PMID 17847535.
- Keisch, B (1968). “Dating Works of Art Through their Natural Radioactivity: Improvements and Applications”. Science. 160 (3826): 413–415. Bibcode:1968Sci...160..413K. doi:10.1126/science.160.3826.413. PMID 17740234.
- Keisch, B (1968). “Discriminating Radioactivity Measurements of Lead: New Tool for Authentication”. Curator. 11 (1): 41–52. doi:10.1111/j.2151-6952.1968.tb00884.x.
- Casas, Jose S.; Sordo, Jose biên tập (2006). Lead Chemistry, Analytical Aspects. Environmental Impacts and Health Effects. Elsevier. ISBN 0-444-52945-4.
Liên kết ngoài
[sửa | sửa mã nguồn]- Chì tại Từ điển bách khoa Việt Nam
- Lead tại Encyclopædia Britannica (tiếng Anh)
- Toxicological Profile for Lead (Update) Agency for Toxic Substances and Disease Registry (ATSDR). 2007. Atlanta, GA: U.S. Department of Health and Human Services, Public Health Service.
- Chì trên DMOZ
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Lead
- Lead-Free Wheels Lưu trữ 2010-08-30 tại Wayback Machine
- National Lead Free Wheel Weight Initiative| Waste Minimization|Wastes|US EPA
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
 GIẢM
15%
GIẢM
15%
 GIẢM
26%
GIẢM
26%
 GIẢM
20%
GIẢM
20%
 GIẢM
26%
GIẢM
26%
 GIẢM
30%
GIẢM
30%





![[Preview] Koigoku No Toshi – Thành phố chúng ta đang sống là giả?](https://thumbnail.komiku.id/wp-content/uploads/2022/08/Koi-Goku-no-Toshi-Panjang.png)
