Simeprevir
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Phát âm | /sɪˈmɛprəvɪər/ si-MEP-rə-veer |
| Tên thương mại | Olysio, Sovriad, Galexos, others |
| Đồng nghĩa | TMC435; TMC435350 |
| AHFS/Drugs.com | Chuyên khảo |
| MedlinePlus | a614013 |
| Giấy phép | |
| Danh mục cho thai kỳ | |
| Dược đồ sử dụng | Qua đường miệng (viên con nhộng) |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Sinh khả dụng | 62% (trong điều kiện no) |
| Liên kết protein huyết tương | >99.9% |
| Chuyển hóa dược phẩm | Gan (CYP3A, CYP2C8, CYP2C19) |
| Chu kỳ bán rã sinh học | 10–13 giờ (không nhiễm HCV), 41 giờ (nhiễm HCV) |
| Bài tiết | Phân (91%), nước tiểu(<1%) |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEMBL | |
| NIAID ChemDB | |
| ECHA InfoCard | 100.215.933 |
| Dữ liệu hóa lý | |
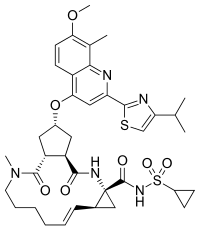
| Công thức hóa học | C38H47N5O7S2 |
| Khối lượng phân tử | 749.94 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
Simeprevir, được bán dưới tên thương mại là Olysio cùng một số tên khác, là một loại thuốc được sử dụng kết hợp với các thuốc khác để điều trị viêm gan C.[1] Thuốc được đặc biệt được sử dụng cho viêm gan kiểu gen C1 và 4.[1] Các loại thuốc được sử dụng kết hợp bao gồm sofosbuvir hoặc ribavirin và peginterferon-alfa.[1] Tỷ lệ chữa bệnh là từ 80 đến 90%.[2][3][4] Chúng cũng có thể được sử dụng ở những người đang nhiễm HIV/AIDS.[1] Chúng được dùng bằng đường uống một lần mỗi ngày trong thời gian là 12 tuần.[1]
Các tác dụng phụ thường gặp bao gồm cảm thấy mệt mỏi, nhức đầu, phát ban, ngứa ngáy và nhạy cảm với ánh sáng mặt trời. [1] Ở những người bị nhiễm viêm gan B trước đó, bệnh có thể diễn biến trở lại.[1] Thuốc không được khuyến cáo ở những người đang có vấn đề đáng kể về gan.[1] Nếu sử dụng cùng với ribavirin trong khi mang thai thì có thể gây hại cho em bé, trường hợp dùng với sofosbuvir thì vẫn chưa rõ ràng.[1][5] Simeprevir là một chất ức chế protease HCV.[1]
Simeprevir được phát triển bởi Medivir AB và Janssen Pharmaceutica.[6] Thuốc đã được chấp thuận cho sử dụng y tế tại Hoa Kỳ vào năm 2013.[7] Simeprevir nằm trong danh sách các thuốc thiết yếu của Tổ chức Y tế Thế giới, tức là nhóm các loại thuốc hiệu quả và an toàn nhất cần thiết trong một hệ thống y tế.[8] Chúng không có sẵn dưới dạng thuốc gốc tính đến năm 2015.[5] Tại Vương quốc Anh, một đợt điều trị kết hợp với ribavirin và peginterferon-alfa có giá khoảng £ 29.700 vào năm 2015.[9] Tại Hoa Kỳ, một đợt điều trị với sofosbuvir là hơn 171.000 đô la Mỹ vào năm 2015 với simeprevir thành phần có giá là 66.360 đô la Mỹ.[10]
Chú thích
[sửa | sửa mã nguồn]- ^ a b c d e f g h i j “Simeprevir”. The American Society of Health-System Pharmacists. Lưu trữ bản gốc ngày 1 tháng 12 năm 2016. Truy cập ngày 30 tháng 11 năm 2016.
- ^ “Initial treatment of HCV infection”. www.hcvguidelines.org. tháng 10 năm 2016. Lưu trữ bản gốc ngày 7 tháng 12 năm 2016. Truy cập ngày 1 tháng 12 năm 2016.
- ^ Majumdar, A; Kitson, MT; Roberts, SK (tháng 6 năm 2016). “Systematic review: current concepts and challenges for the direct-acting antiviral era in hepatitis C cirrhosis”. Alimentary Pharmacology & Therapeutics. 43 (12): 1276–92. doi:10.1111/apt.13633. PMID 27087015.
- ^ Brochot, E; Helle, F; François, C; Castelain, S; Capron, D; Nguyen-Khac, E; Duverlie, G (tháng 4 năm 2015). “Which therapeutic option for hepatitis C virus genotype 1?”. Scandinavian journal of gastroenterology. 50 (4): 470–8. doi:10.3109/00365521.2014.978364. PMID 25396710.
- ^ a b Hamilton, Richart (2015). Tarascon Pocket Pharmacopoeia 2015 Deluxe Lab-Coat Edition. Jones & Bartlett Learning. tr. 80. ISBN 9781284057560.
- ^ Grubbs, Robert H.; O'Leary, Daniel J. (2015). Handbook of Metathesis, Volume 2: Applications in Organic Synthesis (bằng tiếng Anh). John Wiley & Sons. tr. 699. ISBN 9783527694020.
- ^ DUGUM, M.; O'SHEA, R. “Hepatitis C virus: Here comes all-oral treatment”. Cleveland Clinic Journal of Medicine. 81 (3): 159–172. doi:10.3949/ccjm.81a.13155. PMID 24591471.[liên kết hỏng]
- ^ “WHO Model List of Essential Medicines (19th List)” (PDF). World Health Organization. tháng 4 năm 2015. Lưu trữ (PDF) bản gốc ngày 13 tháng 12 năm 2016. Truy cập ngày 8 tháng 12 năm 2016.
- ^ “Janssen will cover cost of unsuccessful hepatitis C treatment”. PMLive. ngày 16 tháng 1 năm 2015. Lưu trữ bản gốc ngày 2 tháng 12 năm 2016. Truy cập ngày 1 tháng 12 năm 2016.
- ^ Smith, Michael (ngày 28 tháng 2 năm 2015). “HCV Drugs Costly but Cure Might Not Be”. MedPageToday. Lưu trữ bản gốc ngày 1 tháng 12 năm 2016. Truy cập ngày 1 tháng 12 năm 2016.
![[Review sách] Normal people - Sally Rooney](https://down-bs-vn.img.susercontent.com/sg-11134201-22090-edroebrkpwhvaf.webp) GIẢM
16%
GIẢM
16%
 GIẢM
15%
GIẢM
15%
 GIẢM
11%
GIẢM
11%
![[Review sách] Tàn ngày để lại: Còn lại gì sau một quá khứ huy hoàng đã mất](https://down-tx-vn.img.susercontent.com/sg-11134201-7rdx5-lxqgdohyz3nse3.webp) GIẢM
27%
GIẢM
27%





