Acid hydrocyanic
| Acid hydrocyanic | |||
|---|---|---|---|
| |||
| Danh pháp IUPAC | |||
| Tên khác |
| ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| Số EINECS | |||
| KEGG | |||
| MeSH | |||
| ChEBI | |||
| Số RTECS | MW6825000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| 3DMet | |||
| UNII | |||
| Thuộc tính | |||
| Công thức phân tử | HCN | ||
| Khối lượng mol | 27,0253 g/mol | ||
| Bề ngoài | Colorless liquid or gas[3] | ||
| Mùi | Oil of bitter almond | ||
| Khối lượng riêng | 0,6876 g cm−3[3] | ||
| Điểm nóng chảy | −13,29 °C (259,86 K; 8,08 °F)[3] | ||
| Điểm sôi | 26 °C (299 K; 79 °F)[3] | ||
| Độ hòa tan trong nước | Miscible | ||
| Độ hòa tan trong ethanol | Miscible | ||
| Áp suất hơi | 100 kPa (25 °C)[4] | ||
| kH | 75 μmol Pa−1 kg−1 | ||
| Độ axit (pKa) | 9.21[5] | ||
| Độ bazơ (pKb) | 4.79 (cyanide anion) | ||
| Chiết suất (nD) | 1,2675 [6] | ||
| Độ nhớt | 0,183 mPa·s (25 °C)[7] | ||
| Acid liên hợp | Hydrocyanonium | ||
| Base liên hợp | Cyanide | ||
| Cấu trúc | |||
| Hình dạng phân tử | Linear | ||
| Mômen lưỡng cực | 2.98 D | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH | 135,1 kJ mol−1 | ||
| Entropy mol tiêu chuẩn S | 201,8 J K−1 mol−1 | ||
| Nhiệt dung | 35,9 J K−1 mol−1 (gas)[8] | ||
| Các nguy hiểm | |||
| NFPA 704 |
| ||
| Giới hạn nổ | 5.6% – 40.0%[9] | ||
| PEL | TWA 10 ppm (11 mg/m³) [skin][9] | ||
| LC50 | 501 ppm (rat, 5 min) 323 ppm (mouse, 5 min) 275 ppm (rat, 15 min) 170 ppm (rat, 30 min) 160 ppm (rat, 30 min) 323 ppm (rat, 5 min)[10] | ||
| REL | ST 4.7 ppm (5 mg/m³) [skin][9] | ||
| IDLH | 50 ppm[9] | ||
| Ký hiệu GHS |    | ||
| Báo hiệu GHS | Danger | ||
| Chỉ dẫn nguy hiểm GHS | H225, H319, H336 | ||
| Chỉ dẫn phòng ngừa GHS | P210, P261, P305+P351+P338 | ||
| Các hợp chất liên quan | |||
| Nhóm chức liên quan | |||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
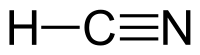
Hydro cyanide, còn được biết đến là acid hydrocyanic là hợp chất vô cơ có công thức hóa học là HCN và công thức cấu trúc là H−C≡N. Muối tạo thành gọi là muối cyanide. Đây là một loại acid rất độc, tất cả các muối của nó cũng rất độc, độc như nicotin (từ 2 đến 3 giọt có thể giết chết một con chó). Tuy nhiên về mặt hóa học, đây là một loại acid rất yếu, yếu hơn acid silicic (H2SiO3). Thế nhưng acid này có thể tạo phức với nhiều kim loại nhóm d như Fe, Cu, Ag, Au,... là chất trung gian để điều chế natri cyanide (một dung môi để điều chế các kim loại hoạt động yếu như vàng, bạc, đồng, thủy ngân,... Ngoài ra acid này có thể tác dụng với các chất hữu cơ và acid này cũng tính khử mạnh.
Các ứng dụng quy mô lớn của HCN là sản xuất kali cyanide và adiponitril, lần lượt được sử dụng trong khai thác mỏ và nhựa.[11]
Tính chất vật lý
[sửa | sửa mã nguồn]Acid hydrocyanic có công thức hóa học là HCN, khối lượng phân tử 27. Ở thể khan là chất lỏng linh động, không màu, rất dễ tan trong nước, rượu và dễ hóa rắn, dễ bay hơi (nhiệt độ nóng chảy là −15 °C, nhiệt độ sôi là 25,6 °C), tỷ trọng d= 0.696. Hơi của HCN có tỷ trọng d = 0,968 và là một loại acid rất yếu. Acid hydrocyanic cực kì độc. Ở dạng khí (hydro cyanide), ta chỉ có thể nhận biết được mùi của nó khi nồng độ đã đạt đến mức gây tử vong. [12]
Điều chế
[sửa | sửa mã nguồn]Acid hydrocyanic được điều chế bằng cách cho amonia tác dụng với carbon monoxide ở nhiệt độ cao có xúc tác ThO2:
HCN là một chất khí có tên là hydro cyanide, khi tan vào nước sẽ tạo thành dung dịch acid hydrocyanic. HCN là hợp chất cộng hóa trị như HCl, phân tử có cấu tạo đường thẳng với độ dài liên kết H–C là 1,05, ångström = 1,05 x 10⁸cm và liên kết C–N là 1,54 Å = 1,54 x 10⁸cm.
HCN là chất hết sức độc, hàm lượng được phép ở trong không khí là dưới 3 x 10⁻⁴ mg/l. Ngoài các đường hô hấp và tiêu hóa, HCN có thể đi vào cơ thể người ta bằng cách thấm qua da. Khi bị nhiễm độc nhẹ, người cảm thấy nhức đầu, nôn mửa, tim đập mạnh. Khi bị nhiễm độc nặng, người mất cảm giác, bị ngạt thở, có thể đi đến ngừng hô hấp và chết vì tim ngừng đập. Có thể phát hiện khí HCN trong khí quyển nhờ khói thuốc lá, khi có mặt HCN khói thuốc lá sẽ trở nên cay. Những trường hợp bị say hay chết vì ăn sắn là do trong sắn có một lượng rất nhỏ HCN.
Hydro cyanide tan trong nước, rượu và ether theo bất cứ tỷ lệ nào. Trong dung dịch nước, HCN là một acid (acid hydrocyanic) rất yếu, yếu hơn cả acid carbonic (H2CO3). Trong dung dịch cồn xảy ra phản ứng thủy phân acid tạo thành amoni format:
Ở trạng thái khan và trạng thái dung dịch, hydrocyanide chỉ bền khi có mặt một lượng nhỏ acid vô cơ làm chất ổn định. Nếu không có những chất đó, nó sẽ trùng hợp lại thành những sản phẩm rắn, màu đen và đôi khi có thể gây nổ.
Khi được đốt nóng trong không khí, HCN cháy với ngọn lửa màu tím và giải phóng H2O, CO2 và N2:
Hydrocyanide được dùng chủ yếu trong những tổng hợp hữu cơ. Nó được điều chế bằng cách đun nóng ở 500 °C và dưới áp suất một hỗn hợp gồm CO và NH3 với chất xúc tác là thori(IV) oxide (ThO2):
Trong phòng thí nghiệm, HCN có thể điều chế bằng cách nhỏ từng giọt dung dịch natri cyanide NaCN xuống dung dịch acid sulfuric H2SO4 nóng và có nồng độ vừa phải:
Tham khảo
[sửa | sửa mã nguồn]- ^ “Hydrogen Cyanide – Compound Summary”. PubChem Compound. United States: National Center for Biotechnology Information. ngày 16 tháng 9 năm 2004. Identification. Truy cập ngày 4 tháng 6 năm 2012.
- ^ “hydrogen cyanide (CHEBI:18407)”. Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. ngày 18 tháng 10 năm 2009. Main. Truy cập ngày 4 tháng 6 năm 2012.
- ^ a b c d Haynes, 4.67
- ^ Haynes, 6.94
- ^ Haynes, 5.92
- ^ Patnaik, P. (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 978-0-07-049439-8.
- ^ Haynes, 6.231
- ^ Haynes, 5.19
- ^ a b c d “NIOSH Pocket Guide to Chemical Hazards #0333”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ Lỗi chú thích: Thẻ
<ref>sai; không có nội dung trong thẻ ref có tênIDLH - ^ Gail, E.; Gos, S.; Kulzer, R.; Lorösch, J.; Rubo, A.; Sauer, M. “Cyano Compounds, Inorganic”. Bách khoa toàn thư Ullmann về Hóa chất công nghiệp. Weinheim: Wiley-VCH. doi:10.1002/14356007.a08_159.pub2. ISBN 978-3-527-30673-2.
- ^ Đặng, Như Tại; Ngô, Thị Thuận (2023). Hóa học hữu cơ - Tập hai. Nhà xuất bản Giáo dục Việt Nam. ISBN 978-604-0-37519-3.
 GIẢM
30%
GIẢM
30%
 GIẢM
50%
GIẢM
50%
 GIẢM
17%
GIẢM
17%
 GIẢM
37%
GIẢM
37%













