Metaraminol
| |||
| (IUPAC) ime | |||
|---|---|---|---|
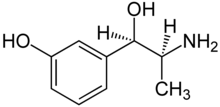
| (1R,2S)-3-[-2-amino-1-hidroksi-propil]fenol | |||
| Klinički podaci | |||
| AHFS/Drugs.com | Internacionalno ime leka | ||
| Identifikatori | |||
| CAS broj | 54-49-9 33402-03-8 (bitartrat) | ||
| ATC kod | C01CA09 | ||
| PubChem[1][2] | 5906 | ||
| DrugBank | DB00610 | ||
| ChemSpider[3] | 5695 | ||
| UNII | 818U2PZ2EH | ||
| KEGG[4] | D08192 | ||
| ChEBI | CHEBI:6794 | ||
| ChEMBL[5] | CHEMBL1201319 | ||
| Hemijski podaci | |||
| Formula | C9H13NO2 | ||
| Mol. masa | 167,205 g/mol | ||
| SMILES | eMolekuli & PubHem | ||
| |||
| Farmakokinetički podaci | |||
| Bioraspoloživost | n/a | ||
| Vezivanje za proteine plazme | ~45% | ||
| Metabolizam | Hepatički | ||
| Farmakoinformacioni podaci | |||
| Trudnoća | C(AU) C(US) | ||
| Pravni status | POM (UK) | ||
| Način primene | Intravenozno | ||
Metaraminol (Aramine, Metaramin, Presoneks, metaradrin) stereoizomer meta-hidroksinorefedrin (3,β-dihidroksiamfetamin), je potentan simpatomimetički amin koji se koristi u sprečavanju i tretmanu hipotenzije, posebno usled komplikacija proizvedenih anestezijom. On je agonist α1-adrenergičkog receptora sa delimičnim β efektom.
Metaraminol se takođe koristi u tretmanu prijapizma, mada nije odobren za tu indikaciju.[6][7][8]
Metaraminol, L-1-(3-hidroksifenil)-2-aminopropan-1-ol, se može sintetisati na dva načina. Prvi način je sinteza počevši od 3-hidroksipropiofenona. Hidroksilna grupa se zaštiti alkilacijom sa benzil hloridom, dajući 3-benziloksipropiofenon. Nakon reakcije sa butil nitritom, dolazi do nitrozilacije u izonitrozoketon, koji se redukcijom vodonikom na Rejnijevem niklu pretvara u 1-(3-benziloksifenil)-2-aminopropan-1-ol, i zatim se zaštitna benzil grupa uklanja redukcijom koristeći vodonik sa paladijumskim katalizatorom, čime se formira racemski metaraminol. Željeni L-izomer se izoluje uz pomoć (+)-tartarinske kiseline.[9][10]
Drugi pristup je polusintetički. On se sastoji od fermentacije D-glukoze u prisustvu 3-acetoksibenzaldehida, čime se formira (–)-1-hidroksi-1-(3-hidroksifenil)-aceton, njegova karbonilna grupa se redukuje vodonikom paladijumskom katalizatoru u prisustvu amonijaka, i time se formira metaraminol.[11][12][13][14]
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Joanne Wixon, Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast 17 (1): 48–55. DOI:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594.
- ↑ McDonald M, Santucci R (2004). „Successful management of stuttering priapism using home self-injections of the alpha-agonist metaraminol.”. Int Braz J Urol 30 (2): 121–2. DOI:10.1590/S1677-55382004000200007. PMID 15703094.
- ↑ Koga S, Shiraishi K, Saito Y (1990). „Post-traumatic priapism treated with metaraminol bitartrate: case report.”. J Trauma 30 (12): 1591–3. DOI:10.1097/00005373-199012000-00029. PMID 2258979.
- ↑ Block T, Sturm W, Ernst G, Staehler G, Schmiedt E (1988). „[Metaraminol in therapy of various forms of priapism]”. Urologe A 27 (4): 225–9. PMID 3140463.
- ↑ G. Erhart, L. Stein, DE 555404 (1930).
- ↑ E. W. Zeh, U.S. Patent 1.951.229 (1934).
- ↑ G. Erhart, L. Stein, DE 571229 (1930)
- ↑ G. Erhart, L. Stein, U.S. Patent 1.948.162 (1934)
- ↑ W. H. Hartung, U.S. Patent 1.995.709 (1935)
- ↑ I. G. Farbenindustrie AG, GB 396951 (1932)

