Hồng cầu
| Hồng cầu | |
|---|---|
 Hình chụp 3D của tế bào hồng cầu ở người (đường kính k. 6–8 μm) | |
| Chi tiết | |
| Chức năng | Vận chuyển oxy |
| Định danh | |
| Từ viết tắt từ chữ đầu | RBC |
| MeSH | D004912 |
| TH | TH {{{2}}}.html HH2.00.04.1.01001 .{{{2}}}.{{{3}}} |
| FMA | 62845 |
| Thuật ngữ mô học | |
Hồng cầu (tiếng Anh: Red blood cells, hay gọi là erythrocytes từ tiếng Hi Lạp cổ erythros 'đỏ', và kytos 'mạch rỗng', còn -cyte được dịch là 'tế bào' theo cách dùng hiện đại trong tài liệu khoa học; ngoài ra có các tên tiếng Anh khác là red cells,[1] erythroid cells và đôi khi là haematids) là loại tế bào máu phổ biến nhất và là phương tiện chính cung cấp oxy (O
2) cho các mô của cơ thể động vật có xương sống—thông qua dòng máu chảy qua hệ tuần hoàn.[2] Hồng cầu lấy oxy ở phổi (hoặc mang của cá, da ở lưỡng cư) và giải phóng oxy vào các mô thông qua mao mạch của hệ tuần hoàn.
Tế bào chất của hồng cầu rất giàu hemoglobin (phân tử sinh học chứa sắt có thể liên kết với oxy và tạo màu đỏ cho tế bào và máu). Mỗi tế bào hồng cầu ở người chứa khoảng 270 triệu phân tử hemoglobin.[3] Màng tế bào hồng cầu được cấu thành từ protein và lipid, cấu trúc này cung cấp đặc tính cần thiết cho chức năng sinh lý của tế bào như độ biến dạng (tiếng Anh: deformability) và sức bền (tiếng Anh: fragility) của tế bào máu khi nó đi qua hệ tuần hoàn và đặc biệt là mạng lưới mao mạch.
Ở người, hồng cầu trưởng thành có dạng hình đĩa lõm hai mặt linh hoạt. Chúng thiếu nhân tế bào (bị loại bỏ trong giai đoạn hình thành) và bào quan nhằm tận dụng tối đa không gian cho hemoglobin; có thể xem chúng là bao chứa hemoglobin với bao là màng huyết tương. Khoảng 2,4 ngàn tỷ hồng cầu ra đời tính theo từng giây ở người trưởng thành. Tế bào phát triển trong tủy xương và lưu thông trong cơ thể trong khoảng 100–120 ngày trước khi đại thực bào tái chế các thành phần của chúng. Một lần lưu thông của hồng cầu mất khoảng 60 giây (một phút).[4] Khoảng 84% tế bào trong cơ thể người có tới 20–30 ngàn tỷ hồng cầu.[5][6][7][8] Gần nửa thể tích máu (40% đến 45%) là hồng cầu.
Hồng cầu đóng gói là những tế bào hồng cầu có thể được hiến tặng, xử lý và lưu trữ trong ngân hàng máu để truyền máu.
Cấu trúc
[sửa | sửa mã nguồn]Động vật có xương sống
[sửa | sửa mã nguồn]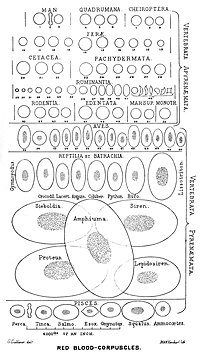
Đa số loài động vật có xương sống (kể cả lớp thú và người) đều có hồng cầu. Hồng cầu là tế bào có trong máu để vận chuyển oxy. Loài động vật có xương duy nhất mà người ta biết đến không có hồng cầu là cá sấu băng (crocodile icefish) hay cá máu trắng (white-blooded fish) họ Channichthyidae thuộc lớp Cá vây tia; chúng ở môi trường nước lạnh cực kỳ nhiều oxy và tự do vận chuyển oxy hòa tan trong máu.[10] Tuy chúng không sử dụng hemoglobin nhưng có thể tìm thấy vết tích của gen hemoglobin ở bộ gen.[11]
Hồng cầu ở động vật có xương chủ yếu gồm hemoglobin - metalloprotein chứa các nhóm hem mang nguyên tử sắt liên kết tạm thời với phân tử oxy (O2) ở phổi, mang và/hoặc da rồi vận chuyển oxy đi khắp cơ thể. Oxy dễ dàng khuếch tán qua màng tế bào của hồng cầu. Hemoglobin ở hồng cầu còn mang một vài sản phẩm thải carbon dioxide từ các mô; tuy nhiên, đa số carbon dioxide thải được vận chuyển trở về mao mạch của phổi dưới dạng bicarbonate (HCO3−) hòa tan trong huyết tương. Myoglobin (hợp chất liên quan đến hemoglobin) có chức năng lưu trữ oxy ở tế bào cơ.[12]
Màu của hồng cầu là do nhóm hem của hemoglobin tạo ra. Riêng huyết tương có màu vàng nhạt, còn hồng cầu thì đổi màu phụ thuộc vào trạng thái của hemoglobin: khi kết hợp với oxy thì sẽ cho ra oxyhemoglobin màu đỏ tươi, còn khi oxy được giải phóng sẽ cho ra deoxyhemoglobin màu đỏ sẫm. Tuy nhiên, máu có thể hơi ngả màu xanh khi nhìn chúng qua thành mạch và da.[13] Việc đo độ bão hòa oxy trong máu (tiếng Anh: pulse oximetry) tận dụng sự đổi màu của hemoglobin để đo trực tiếp oxy hòa tan trong động mạch máu nhờ sử dụng kỹ thuật đo màu (tiếng Anh: colorimetry). Hemoglobin còn mang ái lực lớn với carbon monoxide, tạo thành carboxyhemoglobin có màu đỏ tươi. Những bệnh nhân mặt đỏ bừng, lú lẫn có kết quả đo độ bão hòa oxy trong máu là 100% là một biểu hiện của ngộ độc carbon monoxide.
Việc tế bào chuyên biệt mang protein chứa oxy (trái ngược chất mang oxy bị hòa tan trong dịch cơ thể) là một bước quan trọng trong quá trình tiến hóa của động vật có xương sống, tạo điều kiện cho máu của chúng ít nhớt hơn, nồng độ oxy cao hơn và khuếch tán oxy tốt hơn từ máu sang mô. Kích thước của hồng cầu thay đổi nhiều ở loài động vật có xương; chiều rộng trung bình của hồng cầu lớn hơn khoảng 25% so với đường kính của mao mạch; có giả thuyết cho rằng đặc điểm này cải thiện khâu vận chuyển oxy từ hồng cầu sang mô.[14]
Lớp Thú
[sửa | sửa mã nguồn]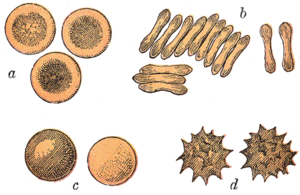
Hồng cầu của lớp Thú thường có hình dạng đĩa hai mặt lõm: dẹt và lõm ở giữa, mặt cắt hình quả tạ và vành xuyến ở gờ đĩa. Hình dạng này giúp cho tỷ lệ diện-tích-bề-mặt-trên-thể-tích (S/V) đạt mức cao, tạo điều kiện khuếch tán khí.[15] Tuy nhiên, có một vài trường hợp ngoại lệ đối với hình dạng của hồng cầu trong cơ thể bộ Guốc chẵn (các loài có móng guốc chẵn gồm gia súc, hươu và họ hàng của chúng): tế bào nhỏ và giống hình quả trứng ở lạc đà không bướu và lạc đà (họ Lạc đà); tế bào hình cầu nhỏ ở họ Cheo cheo; tế bào có hình thoi, hình mác, hình lưỡi liềm và đa giác không đều, cùng các hình dạng góc cạnh khác ở hươu đỏ và nai sừng xám (họ Hươu nai). Những thành viên của bộ này đã tiến hóa rõ ràng một phương thức phát triển hồng cầu, khác biệt đáng kể so với tiêu chuẩn của lớp Thú.[9][16] Nhìn chung, hồng cầu ở lớp Thú rất linh hoạt và dễ đổi hình dạng để có thể chui qua các mao mạch nhỏ, cũng tăng tối đa bề mặt đối diện bằng cách tạo hình điếu xì gà - đây là nơi chúng giải phóng hiệu quả lượng oxy của mình.[17]
Hồng cầu ở lớp Thú trở nên đặc biệt trong giới động vật có xương vì chúng không có nhân khi trưởng thành. Chúng có nhân trong những pha đầu tiên của quá trình hình thành hồng cầu (tiếng Anh: erythropoiesis), nhưng nhân bị loại bỏ khi tế bào rưởng thành; quá trình này tạo thêm nhiều chỗ cho hemoglobin. Sau đó hồng cầu không nhân (được gọi là hồng cầu lưới) mất toàn bộ các bào quan khác như ty thể, bộ máy Golgi và mạng lưới nội chất.
Lách có chức năng như kho chứa hồng cầu, điều này có phần hạn chế ở người. Ở một vài động vật thuộc lớp Thú như chó và ngựa thì lách tách biệt một lượng lớn hồng cầu - chúng được đẩy vào máu trong giai đoạn gắng sức cao độ, tạo nên khả năng vận chuyển oxy cao hơn.

Người
[sửa | sửa mã nguồn]

Một hồng cầu điển hình ở người có đường kính đĩa vào khoảng 6,2–8,2 μm[18], độ dày ở điểm dày nhất là 2–2,5 μm, còn độ dày tối thiếu ở tâm là 0,8–1 μm, tức nhỏ hơn nhiều so với đa số tế bào ở người khác. Những tế bào này có thể tích trung bình khoảng 90 fL[19] với diện tích bề mặt khoảng 136 μm2, và có thể phồng lên thành hình cầu chứa 150 fL mà không giãn màng.
Người trưởng thành có khoảng 20–30 ngàn tỷ hồng cầu ở bất kỳ lúc nào, chiếm khoảng 70% tổng số lượng tế bào.[20] Phụ nữ có khoảng 4–5 triệu hồng cầu trên một mm khối máu, còn đàn ông có khoảng 5–6 triệu hồng cầu trên một mm khối máu; con người sống ở vùng cao có huyết áp oxy thấp hơn. Do đó hồng cầu phổ biến hơn nhiều so với các tế bào máu khác: có khoảng 4.000–11.000 bạch cầu và khoảng 150.000–400.000 tiểu cầu trên mỗi mm3.
Hồng cầu ở người mất trung bình 60 giây để hoàn thành một chu kỳ tuần hoàn.[4][8][21]
Màu đỏ của hồng cầu là do các đặc tính quang phổ của ion sắt trong nhóm hem ở hemoglobin gây ra. Mỗi phân tử hemoglobin chứa bốn nhóm hem; hemoglobin chiếm khoảng một phần tổng thể tích tế bào. Hemoglobin chịu trách nhiệm vận chuyển hơn 98% lượng oxy trong cơ thể (phần oxy còn lại được vận chuyển hòa tan trong huyết tương). Hồng cầu ở đàn ông trưởng thành lưu trữ trung bình khoảng 2,5 gram sắt, chiếm khoảng 65% tổng lượng sắt chứa trong cơ thể.[22]
Cấu trúc vi mô
[sửa | sửa mã nguồn]Nhân
[sửa | sửa mã nguồn]Hồng cầu ở lớp Thú không có nhân lúc trưởng thành, hay có thể nói là chúng thiếu nhân tế bào. Để so sánh, hồng cầu của các động vật có xương khác đều có nhân; ngoại lệ duy nhất là Bộ Có đuôi của họ Plethodontidae; năm phân nhánh khác nhau của họ này đã phát triển ở nhiều mức độ hồng cầu không nhân (phần lớn phát triển ở một số loài của chi Batrachoseps) và cá của chi Maurolicus.[23][24][25]
Hồng cầu có nhân ở lớp Thú gồm hai dạng: nguyên bào hồng cầu (normoblast), tức tiền thân dạng bình thường của hồng cầu trưởng thành; và nguyên hồng cầu khổng lồ (megaloblast), tức tiền thân có kích thước lớn bất thường xảy ra ở thiếu máu nguyên hồng cầu khổng lồ (megaloblastic anemias).
Thành phần màng
[sửa | sửa mã nguồn]Hồng cầu có tính biến hình, linh hoạt, có thể bám vào tế bào khác và tương tác với tế bào miễn dịch. Màng của chúng đóng nhiều vai trò trong các chức năng ấy. Những chức năng này phụ thuộc lớn vào thành phần màng. Màng của hồng cầu gồm ba lớp: glycocalyx giàu carbohydrat nằm ở ngoài màng; lớp lipid kép chứa nhiều protein xuyên màng, cùng các thành phần chính lipid của nó; và bộ khung màng - mạng lưới cấu trúc của các protein nằm ở mặt trong của lớp lipid kép. Nửa khối lượng màng hồng cầu ở người và đa số động vật thuộc lớp Thú là protein. Nửa còn lại là các lipid, mà cụ thể là phospholipid và cholesterol.[26]
Lipid màng
[sửa | sửa mã nguồn]
Màng hồng cầu gồm một lớp lipid kép điển hình, tương tự như ở hầu hết tế bào của người. Nói đơn giản thì lớp lipid kép này gồm cholesterol và phospholipid với tỷ lệ trọng lượng bằng nhau. Thành phần lipid có vai trò quan trọng vì nó xác định nhiều đặc tính vật lý như tính thấm và độ lỏng của màng. Ngoài ra, hoạt động của nhiều protein màng do tương tác với lipid trong lớp kép điều phối.
Không như cholesterol được phân bố đều giữa cả lớp trong và lớp ngoài, năm phospholipid chính được phân bố không đều như sau:
Lớp đơn ngoài
- Phosphatidylcholine (PC);
- Sphingomyelin (SM).
Lớp đơn trong
- Phosphatidylethanolamine (PE);
- Phosphoinositol (PI) (số lượng nhỏ).
- Phosphatidylserine (PS);
Sự phân bố phospholipid không đều giữa lớp kép là do chức năng của nhiều protein vận chuyển phospholipid độc lập/phụ thuộc vào năng lượng. Protein (có tên gọi là "Flippase") vận chuyển phospholipid từ lớp đơn ngoài vào lớp đơn trong, còn những protein khác (có tên "floppase") vận hành ngược lại, kháng gradient nồng độ theo phương thức phụ thuộc năng lượng. Ngoài ra còn có các protein ("scramblase") vận chuyển phospholipid theo cả hai hướng cùng lúc, giảm các gradient nồng độ theo phương thức độc lập với năng lượng. Giới khoa học vẫn còn tranh luận liên quan đến đặc tính của những protein duy trì màng ở màng hồng cầu này.
Sự duy trì phân bố phospholipid không đều ở lớp kép (như định vị PS và PI độc nhất ở lớp đơn trong) có ý nghĩa quan trọng với tính toàn vẹn và chức năng của tế bào vì một số lý do:
- Đại thực bào nhận diện và thực bào các hồng cầu trình diện PS ở mặt ngoài. Do đó việc hạn chế PS ở lớp đơn trong là cần thiết nếu tế bào muốn sống sót qua những lần chạm mặt với đại thực bào của hệ lưới-nội mô, đặc biệt là ở lá lách.
- Sự phá hủy sớm hồng cầu hình liềm và thiếu máu có liên quan đến phá vỡ phân bố không đều lipid, dẫn đến PS tiếp xúc trên lớp đơn ngoài.
- Sự tiếp xúc của PS có thể làm hồng cầu thêm bám dính với tế bào nội mô mạch máu, ngăn ngừa hiệu quả khâu vận chuyển thông thường thông qua sắp xếp mạch máu nhỏ nhất (microvasculature). Thế nên quan trọng là PS được duy trì chỉ ở lá con bên trong của lớp kép, nhằm đảm bảo lưu thông máu bình thường ở các mạch máu nhỏ nhất (microcirculation).
- Cả PS lẫn phosphatidylinositol 4,5-bisphosphat (PIP2) đều có thể điều chỉnh chức năng cơ học của màng, do chúng tương tác với các protein xương như spectrin và protein 4.1R. R Những nghiên cứu gần đây chỉ ra rằng liên kết của spectrin với PS làm thúc đẩy độ ổn định cơ học của màng. PIP2 tăng cường liên kết của protein band 4.1R với glycophorin C, song giảm tương tác của nó với protein band 3, vì vậy có thể điều chỉnh liên kết của lớp kép với khung màng.
Các nghiên cứu gần đây mô tả sự hiện diện của các cấu trúc chuyên biệt có tên "mảng lipid" (lipid raft) ở màng hồng cầu. Chúng là những cấu trúc giàu cholesterol và sphingolipid liên kết với protein màng cụ thể, gồm flotillin, STOMatin (band 7), G-protein, và thụ quan β-adrenergic. Mảng lipid có liên quan đến các sự việc truyền tín hiệu tế bào ở tế bào không phải hồng cầu, chúng đã được chứng minh có vai trò truyền tín hiệu trung gian thụ quan β2-adregenic và tăng cường mức độ cAMP ở tế bào hồng cầu, vì thế mà điều phối sự xâm nhập của ký sinh sốt rét vào hồng cầu bình thường.[27][28]
Protein màng
[sửa | sửa mã nguồn]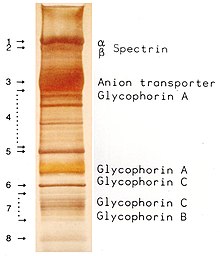
Protein của khung màng có đặc tính là tính biến hình, linh hoạt và độ bền của hồng cầu, tạo điều kiện cho nó lọt vào những mao mạch có đường kính hồng cầu chưa đầy (7–8 μm) và phục hồi hình dạng đĩa ngay khi những tế bào này ngừng chịu lực nén, tương tự như một vật thể làm bằng cao su.
Hiện có hơn 50 protein màng được biết tới, chúng có thể tồn tại ở hàng trăm đến hàng triệu bản sao cho mỗi hồng cầu. Khoảng 25 protein màng trong số này mang theo nhiều kháng nguyên nhóm máu như kháng nguyên A, B và Rh. Những protein màng có thể thực hiện hàng loạt chức năng, chẳng hạn như vận chuyển ion và phân tử qua màng hồng cầu, bám dính và tương tác với tế bào khác như tế bào nội mô, thụ quan truyền tín hiệu cũng như các chức năng vô danh khác. Nhóm máu ở người do sự thay đổi ở glycoprotein bề mặt của hồng cầu. Những bệnh ở protein trong các màng này liên quan đến nhiều chứng bệnh nữa, như hereditary spherocytosis, hereditary elliptocytosis, hereditary stomatocytosis, and paroxysmal nocturnal hemoglobinuria.[26][27]
Chức năng
[sửa | sửa mã nguồn]Vai trò trong vận chuyển CO2
[sửa | sửa mã nguồn]Quá trình hô hấp (theo như minh họa trong sơ đồ dưới đây với đơn vị carbohydrat) tạo ra số phân tử carbon dioxide CO2 tương đương với số lượng oxy (O2) dùng để hô hấp.[30]
Vì thế mà chức năng của hệ tuần hoàn chủ yếu là vận chuyển carbon dioxide cũng như vận chuyển oxy. Đa số carbon dioxide trong máu nằm ở dạng ion bicarbonat. Bicarbonat cung cấp chất đệm pH quan trọng.[31] Do đó, không như vận chuyển O2 ở hemoglobin, việc không có một phân tử cụ thể vận chuyển CO2 là một lợi thế về mặt sinh lý học.
Tuy nhiên, hồng cầu đóng một vai trò quan trọng trong quá trình vận chuyển CO2 vì hai lý do. Đầu tiên, vì bên cạnh hemoglobin, hồng cầu chứa một lượng lớn bản sao của enzym carbonic anhydrase ở bên trong màng tế bào.[32] Carbonic anhydrase (là anhydride của acid carbonic) có chức năng làm chất xúc tác trao đổi giữa acid carbonic và carbon dioxide. Vì là chất xúc tác, nó có thể tác động lên nhiều phân tử CO2, thế nên chất hóa học này thực hiện vai trò thiết yếu mà không cần nhiều bản sao như hemoglobin để vận chuyển O2. Với sự tham gia của chất xúc tác này, carbon dioxide và acid carbonic đạt trạng thái cân bằng rất nhanh, trong khi hồng cầu vẫn đang di chuyển qua mao mạch. Do đó chính hồng cầu mới là nhân tố đảm bảo rằng phần lớn CO2 được vận chuyển dưới dạng bicarbonat.[33][34] Ở độ pH sinh lý, trạng thái cân bằng cực kỳ có lợi cho acid carbonic - đa số chất này được phân ly thành ion bicarbonat.[35]
Nhờ phản ứng này (còn gọi là hiệu ứng Bohr) mà ion H+ được giải phóng trong hồng cầu dù vẫn nằm trong mao mạch, có chức năng giảm ái lực liên kết với oxy của hemoglobin.
Hồng cầu còn có đóng góp lớn khác vào vận chuyển carbon dioxide, đó là carbon dioxide phản ứng trực tiếp với thành phần globin protein của hemoglobin để tạo nên hợp chất carbaminohemoglobin. Khi oxy được giải phóng trong mô, nhiều CO2 liên kết với hemoglobin hơn và khi oxy liên kết ở phổi nó thay thế hemoglobin liên kết với CO2. Đây gọi là hiệu ứng Haldane. Bất chấp thực tế là chỉ có một lượng nhỏ CO2 trong máu liên kết với hemoglobin trong máu tĩnh mạch, song hàm lượng thay đổi CO2 lớn hơn giữa máu tĩnh mạch và động mạch đến từ sự thay đổi trong liên kết CO2 này.[36] Tức là luôn có một lượng bicarbonat dồi dào trong máu (cả động mạch lẫn tĩnh mạch), bởi vai trò là chất đệm pH nhóm nguyên tử này trong hồng cầu.
Tóm lại, carbon dioxide tạo ra bởi hô hấp tế bào thì khuếch tán rất nhanh sang các khu vực có nồng độ thấp hơn, cụ thể là gần mao mạch.[37][38] Khi chất này đi vào hồng cầu, CO2 nhanh chóng được carbonic anhydrase chuyển đổi bên trong màng của hồng cầu dưới dạng bicarbonat. Ion bicarbonat lần lượt tách khỏi hồng cầu nhằm đổi lấy ion chlor từ huyết tương rồi được protein vận chuyển band 3 anion nằm cùng vị trí trong màng hồng cầu đồng vận chuyển xuyên màng. Ion bicarbonat không khuếch tán khỏi mao mạch và được vận chuyển đến phổi. Ở phổi, áp suất riêng phần carbon dioxide thấp hơn trong túi phổi làm cho carbon dioxide khuếch tán nhanh từ mao mạch vào phế nang. Carbonic anhydrase trong hồng cầu giữ cho ion bicarbonat ở trạng thái cân bằng với carbon dioxide. Vì thế khi carbon dioxide rời khỏi mao mạch và CO2 bị O2 thay thế ở hemoglobin, lượng ion bicarbonat vừa đủ để chuyển đổi nhanh chóng sang carbon dioxide nhằm duy trì độ cân bằng.[32][39][40][41]
Chức năng thứ cấp
[sửa | sửa mã nguồn]Khi hồng cầu trải qua ứng suất cắt ở mạch máu bị co thắt, chúng giải phóng ATP, làm cho thành mạch giãn và mở rộng nhằm thúc đẩy lưu lượng máu bình thường.[42]
Khi phân tử hemoglobin bị khử oxy, hồng cầu giải phóng S-nitrosothiol - chất cũng có tác dụng làm giãn mạch máu,[43] thế nên đưa được nhiều máu hơn tới những vùng bị thiếu oxy trên cơ thể.
Hồng cầu còn có thể tổng hợp nitơ monoxide theo phương thức enzym, tức sử dụng L-arginine làm chất nền như đã làm với tế bào nội mô.[44] Sự tiếp xúc của hồng cầu với mức độ sinh lý của ứng suất cắt làm kích hoạt nitric oxide synthase và xuất ra nitơ monoxide,[45] có thể góp phần điều chỉnh sức trương của mạch máu.
Hồng cầu cũng có thể sản xuất hydro sulfide - một loại khí báo hiệu có chức năng làm giãn thành mạch. Một nghiên cứu tin rằng tác dụng bảo vệ tim của tỏi là do hồng cầu chuyển đổi hợp chất lưu huỳnh của tỏi thành hydro sulfide.[46]
Hồng cầu còn đóng vai trò trong phản ứng miễn dịch của cơ thể: khi hồng cầu bị các mầm bệnh như vi khuẩn phân giải, hemoglobin sẽ giải phóng gốc tự do phá vỡ thành tế bào và màng của mầm bệnh để tiêu diệt vi khuẩn.[47][48]
Quá trình tế bào
[sửa | sửa mã nguồn]Do không chứa ty thể, hồng cầu không sử dụng chút oxy nào mà chúng vận chuyển, mà chúng tạo ra năng lượng chứa ATP bằng đường phân glucose và lên men acid lactic, thu được pyruvic.[49][50] Ngoài ra, con đường pentose phosphat đóng vai trò quan trọng trong hồng cầu.
Vì hồng cầu không chứa nhân nên hiện nay sinh tổng hợp protein được cho là không có ở những tế bào này.
Vì thiếu nhân và bào quan, hồng cầu trưởng thành không chứa DNA và không thể tổng hợp bất kỳ RNA nào (dù có chứa RNA),[51][52] nên sau đó không thể phân chia và có khả năng sửa chữa hạn chế.[53] Việc không thể tiến hành tổng hợp protein tức là chẳng virus nào có thể tiến hóa để nhắm vào hồng cầu của lớp Thú.[54] Tuy nhiên, sự lây nhiễm parvoviruses (như virus parvovirus B19 ở người) có thể ảnh hưởng đến tiền chất của hồng cầu trong khi chúng vẫn mang DNA; có thể nhận diện sự lây nhiễm bằng sự có mặt của tiền nguyên hồng cầu (tiếng Anh: proerythroblast) khổng lồ với các hạt virus và thể vùi (tiếng Anh: inclusion bodies), do đó tạm thời làm cạn kiệt hồng cầu lưới trong máu và gây thiếu máu.[55]
Vòng đời
[sửa | sửa mã nguồn]Hồng cầu ở người được tạo ra thông qua quá trình gọi là hình thành hồng cầu (erythropoiesis), phát triển từ tế bào gốc cố định thành hồng cầu trưởng thành trong khoảng bảy ngày. Khi đã trưởng thành, ở một cá thể khỏe mạnh, những tế bào này sống trong tuần hoàn máu trong khoảng 100 đến 120 ngày (và 80 đến 90 ngày ở trẻ sơ sinh đủ tháng).[56] Ở cuối vòng đời, chúng bị loại trừ khỏi tuần hoàn. Ở nhiều bệnh mãn tính, vòng đời của hồng cầu bị giảm đi.
Hình thành
[sửa | sửa mã nguồn]Sự hình thành hồng cầu là quá trình tạo thành các hồng cầu mới, kéo dài khoảng bảy ngày. Suốt quá trình này, hồng cầu liên tục được tạo nên ở tủy xương đỏ của xương lớn. Ở phôi, gan là nơi sản sinh chính của hồng cầu. Sự hình thành hồng cầu có thể do hormone erythropoietin (EPO) kích thích và được thận tổng hợp. Ngay trước và sau khi rời tủy xương, tế bào đang phát triển được gọi là hồng cầu lưới; chúng chiếm khoảng 1% lượng hồng cầu đang tuần hoàn.
Tuổi thọ chức năng
[sửa | sửa mã nguồn]Tuổi thọ chức năng của hồng cầu là vào khoảng 100–120 ngày, trong thời gian này hồng cầu liên tục di chuyển do lực đẩy (ở động mạch), lực kéo (ở tĩnh mạch) của dòng máu và kết hợp giữa hai loại lực này khi chúng thâm nhập qua mạch máu nhỏ như mao mạch. Chúng cũng được tái chế trong tủy xương.[57]
Lão hóa
[sửa | sửa mã nguồn]Hồng cầu lão hóa trải qua thay đổi ở màng huyết tương, làm nó dễ bị đại thực bào và sau là thực bào nhận dạng chọn lọc trong hệ thống thực bào đơn nhân (lách, gan và hạch bạch huyết), do đó vừa loại trừ tế bào cũ và mang khiếm khuyết, vừa liên tục thanh lọc máu. Quá trình này được gọi là chết hồng cầu theo chương trình (tiếng Anh: eryptosis).[58] Quá trình này thường diễn ra với cùng tỷ lệ sản xuất của hình thành hồng cầu, cân bằng tổng số lượng hồng cầu tuần hoàn. Chết hồng cầu theo chương trình tăng lên ở hàng loạt bệnh khác nhau gồm nhiễm trùng huyết, hội chứng ure huyết tán huyết, sốt rét, hồng cầu hình liềm, tan máu bẩm sinh beta, thiếu glucose-6-phosphat dehydrogenase, suy giảm phosphat, thiếu sắt và bệnh Wilson. Hình thành hồng cầu có thể do sốc thẩm thấu, stress oxy hóa và thuyên giảm năng lượng, cũng như do hàng loạt chất trung gian nội sinh và xenobiotic gây nên. Sự hình thành hồng cầu dư thừa được quan sát ở hồng cầu thiếu protein kinase cGMP-độc lập loại I hoặc protein kinase AMP-hoạt hóa AMPK. Chất ức chế hình thành hồng cầu gồm erythropoietin, nitơ monoxide, catecholamine và nồng độ ure cao.
Phần lớn các sản phẩm phân hủy được tái lưu thông trong cơ thể. Thành phần hem của hemoglobin bị phân hủy thành sắt (Fe3+) và biliverdin. Biliverdin bị giảm thành bilirubin, chất này được giải phóng vào huyết tương và tái lưu thông đến gan dưới dạng liên kết với albumin. Gan sau đó giải phóng bilirubin vào ruột thông qua mật, chất này thải qua phân, là một nguyên nhân làm phân thường có màu vàng nghệ. Sắt được giải phóng vào huyết tương để được một chất mang protein gọi là transferrin tái lưu thông. Gần như mọi hồng cầu bị loại bỏ khỏi hệ tuần hoàn theo cách này, trước khi chúng đủ trưởng thành để tiêu máu (tiếng Anh: Hemolysis). Hemoglobin tiêu máu được liên kết với một protein ở huyết tương là haptoglobin, chất này không bị thận đào thải.[59]
Tham khảo
[sửa | sửa mã nguồn]- ^ Kumar V, Abbas AK, Fausto N, Mitchell RN (2007). Robbins Basic Pathology (ấn bản thứ 8). Saunders.
- ^ “Blood Cells”. Bản gốc lưu trữ ngày 23 tháng 7 năm 2016.
- ^ D'Alessandro A, Dzieciatkowska M, Nemkov T, Hansen KC (tháng 3 năm 2017). “Red blood cell proteomics update: is there more to discover?”. Blood Transfusion = Trasfusione del Sangue. 15 (2): 182–187. doi:10.2450/2017.0293-16. PMC 5336341. PMID 28263177.
- ^ a b Blom JA (2003). Monitoring of Respiration and Circulation. CRC Press. tr. 27. ISBN 978-0-203-50328-7.
- ^ Hatton IA, Galbraith ED, Merleau NS, Miettinen TP, Smith BM, Shander JA (tháng 9 năm 2023). “The human cell count and size distribution”. Proceedings of the National Academy of Sciences of the United States of America. 120 (39): e2303077120. Bibcode:2023PNAS..12003077H. doi:10.1073/pnas.2303077120. PMC 10523466. PMID 37722043.
- ^ Sender R, Fuchs S, Milo R (tháng 8 năm 2016). “Revised Estimates for the Number of Human and Bacteria Cells in the Body”. PLOS Biology. 14 (8): e1002533. doi:10.1371/journal.pbio.1002533. PMC 4991899. PMID 27541692.
- ^ Dean L (2005). Blood Groups and Red Cell Antigens. National Center for Biotechnology Information (US).
- ^ a b Pierigè F, Serafini S, Rossi L, Magnani M (tháng 1 năm 2008). “Cell-based drug delivery”. Advanced Drug Delivery Reviews. 60 (2): 286–295. doi:10.1016/j.addr.2007.08.029. PMID 17997501.
- ^ a b Gulliver G (1875). “On the size and shape of red corpuscles of the blood of vertebrates, with drawings of them to a uniform scale, and extended and revised tables of measurements”. Proceedings of the Zoological Society of London. 1875: 474–495.
- ^ Ruud JT (tháng 5 năm 1954). “Vertebrates without erythrocytes and blood pigment”. Nature. 173 (4410): 848–850. Bibcode:1954Natur.173..848R. doi:10.1038/173848a0. PMID 13165664.
- ^ Carroll S (2006). The Making of the Fittest. W.W. Norton. ISBN 978-0-393-06163-5.
- ^ Maton A, Hopkins J, McLaughlin CW, Johnson S, Warner MQ, LaHart D, Wright JD (1993). Human Biology and Health. Englewood Cliffs, New Jersey: Prentice Hall. ISBN 978-0-13-981176-0.
- ^ “Why Are Veins Blue?”. Scienceblogs. 17 tháng 4 năm 2008. Truy cập ngày 23 tháng 4 năm 2015.
- ^ Snyder GK, Sheafor BA (1999). “Red Blood Cells: Centerpiece in the Evolution of the Vertebrate Circulatory System”. Integrative and Comparative Biology. 39 (2): 189–198. doi:10.1093/icb/39.2.189.
- ^ “BBC Bitesize – GCSE Biology – Blood – Revision 2”. www.bbc.co.uk (bằng tiếng Anh). Truy cập ngày 26 tháng 11 năm 2017.
- ^ Gregory TR (2001). “The bigger the C-value, the larger the cell: genome size and red blood cell size in vertebrates”. Blood Cells, Molecules & Diseases. 27 (5): 830–843. CiteSeerX 10.1.1.22.9555. doi:10.1006/bcmd.2001.0457. PMID 11783946.
- ^ Goodman SR, Kurdia A, Ammann L, Kakhniashvili D, Daescu O (tháng 12 năm 2007). “The human red blood cell proteome and interactome”. Experimental Biology and Medicine. 232 (11): 1391–1408. doi:10.3181/0706-MR-156. PMID 18040063.
- ^ Turgeon ML (2004). Clinical Hematology: Theory and Procedures. Lippincott Williams & Wilkins. tr. 100. ISBN 9780781750073.
- ^ McLaren CE, Brittenham GM, Hasselblad V (tháng 4 năm 1987). “Statistical and graphical evaluation of erythrocyte volume distributions”. The American Journal of Physiology. 252 (4 Pt 2): H857–H866. CiteSeerX 10.1.1.1000.348. doi:10.1152/ajpheart.1987.252.4.H857. PMID 3565597.
- ^ Bianconi E, Piovesan A, Facchin F, Beraudi A, Casadei R, Frabetti F, và đồng nghiệp (1 tháng 11 năm 2013). “An estimation of the number of cells in the human body”. Annals of Human Biology. 40 (6): 463–471. doi:10.3109/03014460.2013.807878. PMID 23829164.
- ^ Hillman RS, Ault KA, Rinder HM (2005). Hematology in Clinical Practice: A Guide to Diagnosis and Management (ấn bản thứ 4). McGraw-Hill Professional. tr. 1. ISBN 978-0-07-144035-6.
- ^ “Transferrin and Iron Transport Physiology”. Information Center for Sickle Cell and Thalassemic Disorders. Truy cập ngày 26 tháng 3 năm 2023.
- ^ Cohen WD (1982). “The cytomorphic system of anucleate non-mammalian erythrocytes”. Protoplasma. 113: 23–32. doi:10.1007/BF01283036.
- ^ Wingstrand KG (1956). “Non-nucleated erythrocytes in a teleostean fish Maurolicus mülleri (Gmelin)”. Zeitschrift für Zellforschung und Mikroskopische Anatomie. 45 (2): 195–200. doi:10.1007/BF00338830. PMID 13402080.
- ^ Mueller, R. L.; Gregory, T. R.; Gregory, S. M.; Hsieh, A.; Boore, J. L. (2008). “Genome size, cell size, and the evolution of enucleated erythrocytes in attenuate salamanders”. Zoology. 111 (3): 218–230. Bibcode:2008Zool..111..218M. doi:10.1016/j.zool.2007.07.010. PMC 2435017. PMID 18328681.
- ^ a b Yazdanbakhsh K, Lomas-Francis C, Reid ME (tháng 10 năm 2000). “Blood groups and diseases associated with inherited abnormalities of the red blood cell membrane”. Transfusion Medicine Reviews. 14 (4): 364–374. doi:10.1053/tmrv.2000.16232. PMID 11055079.
- ^ a b Mohandas N, Gallagher PG (tháng 11 năm 2008). “Red cell membrane: past, present, and future”. Blood. 112 (10): 3939–3948. doi:10.1182/blood-2008-07-161166. PMC 2582001. PMID 18988878.
- ^ Rodi PM, Trucco VM, Gennaro AM (tháng 6 năm 2008). “Factors determining detergent resistance of erythrocyte membranes”. Biophysical Chemistry. 135 (1–3): 14–18. doi:10.1016/j.bpc.2008.02.015. PMID 18394774.
|hdl-access=cần|hdl=(trợ giúp) - ^ Hempelmann E, Götze O (1984). “Characterization of membrane proteins by polychromatic silver staining”. Hoppe-Seyler's Z Physiol Chem. 365: 241–42.
- ^ Guyton AC (1976). “Ch. 41 Transport of Oxygen and Carbon Dioxide in the Blood and Body Fluids”. Textbook of Medical Physiology . Philadelphia, PA: W. B. Saunders. tr. 556. ISBN 0-7216-4393-0.
The Respiratory Exchange Ratio is 1:1 when carbohydrate is consumed, it is as low as 0.7 when fat is consumed.
- ^ West JB (1974). “Gas Transport to the Periphery”. Respiratory Physiology – the essentials. Baltimore, MD: Williams & Wilkens. tr. 80. ISBN 0-683-08932-3.
Acid Base Status: The transport of CO2 has a profound effect on the acid-base status of blood and the body as a whole. The lung excretes over 10,000 mEq of carbonic acid per day compared to less than 100 mEq of fixed acids by the kidney.
- ^ a b Guyton AC (1976). “Ch. 41 Transport of Oxygen and Carbon Dioxide in the Blood and Body Fluids”. Textbook of Medical Physiology . Philadelphia, PA: W. B. Saunders. tr. 553–554. ISBN 0-7216-4393-0.
Reaction of Carbon Dioxide with Water in the Red Blood Cells - Effect of Carbonic Anhydrase
- ^ Guyton AC (1976). “Ch. 41 Transport of Oxygen and Carbon Dioxide in the Blood and Body Fluids”. Textbook of Medical Physiology . Philadelphia, PA: W. B. Saunders. tr. 553–554. ISBN 0-7216-4393-0.
carbonic anhydrase catalyzes the reaction between carbon dioxide and water.
- ^ Comroe Jr JH (1965). “Transport and elimination of carbon dioxide”. Physiology of Respiration (ấn bản thứ 1971). Chicago, IL: Year Book Medical Publishers. tr. 176. ISBN 0-8151-1824-4.
[carbonic anhdrase] makes the reaction go to the right about 13000 times as fast
- ^ Diem K, Lentner C biên tập (1970). “Blood Gasses”. Documenta Geigy Scientific Tables (ấn bản thứ 7). Basle, Switzerland: Ciba-Geigy Limited. tr. 570–571.
In plasma about 5% of CO2 is in physical solution 94% as bicarbonate and 1% as carbamino compounds; in the erythrocytes the corresponding figures are 7%, 82% and 11%.
- ^ Guyton AC (1976). “Ch. 41 Transport of Oxygen and Carbon Dioxide in the Blood and Body Fluids”. Textbook of Medical Physiology . Philadelphia, PA: W. B. Saunders. tr. 554. ISBN 0-7216-4393-0.
from figure 41-5 Hgb.CO2 is about 23% and bicarbonate is about 70% of the total carbon dioxide transported to the lungs.
- ^ Comroe J (1965). “Pulmonary Gas Diffusion”. Physiology of Respiration (ấn bản thứ 1971). Chicago, IL: Year Book Medical Publishers. tr. 140. ISBN 0-8151-1824-4.
Despite being a heavier molecule, because it is more soluble, the relative rate of diffusion of CO2 is about 20 times the rate of O2
- ^ Guyton AC (1976). “Ch. 41 Transport of Oxygen and Carbon Dioxide in the Blood and Body Fluids”. Textbook of Medical Physiology . Philadelphia, PA: W. B. Saunders. tr. 553. ISBN 0-7216-4393-0.
carbon dioxide diffuses out of the tissue cells in the gaseous form (but not to a significant effect in the bicarbonate form because the cell membrane is far less permeable to bicarbonate than to the dissolved gas.
- ^ Comroe Jr JH (1965). “Transport and elimination of carbon dioxide”. Physiology of Respiration (ấn bản thứ 1971). Chicago, IL: Year Book Medical Publishers. tr. 175–177. ISBN 0-8151-1824-4.
the buffering occurred in the red cell
- ^ West JB (1974). “Gas Transport to the Periphery”. Respiratory Physiology – the essentials. Baltimore, MD: Williams & Wilkens. tr. 77–79. ISBN 0-683-08932-3.
CO2 Transport
- ^ Stone WE (1973). “Ch. 6-1 Uptake and Delivery of the Respiratory Gasses”. Trong Brobeck JR (biên tập). Best & Taylor's Physiological basis of medical practice (ấn bản thứ 9). Baltimore, MD: Williams & Wilkins. tr. 6.16–6.18. ISBN 0-683-10160-9.
Transport of CO2 as Bicarbonate
- ^ Wan J, Ristenpart WD, Stone HA (tháng 10 năm 2008). “Dynamics of shear-induced ATP release from red blood cells”. Proceedings of the National Academy of Sciences of the United States of America. 105 (43): 16432–16437. Bibcode:2008PNAS..10516432W. doi:10.1073/pnas.0805779105. PMC 2575437. PMID 18922780.
- ^ Diesen DL, Hess DT, Stamler JS (tháng 8 năm 2008). “Hypoxic vasodilation by red blood cells: evidence for an s-nitrosothiol-based signal”. Circulation Research. 103 (5): 545–553. doi:10.1161/CIRCRESAHA.108.176867. PMC 2763414. PMID 18658051.
- ^ Kleinbongard P, Schulz R, Rassaf T, Lauer T, Dejam A, Jax T, và đồng nghiệp (tháng 4 năm 2006). “Red blood cells express a functional endothelial nitric oxide synthase”. Blood. 107 (7): 2943–2951. doi:10.1182/blood-2005-10-3992. PMID 16368881.
- ^ Ulker P, Sati L, Celik-Ozenci C, Meiselman HJ, Baskurt OK (2009). “Mechanical stimulation of nitric oxide synthesizing mechanisms in erythrocytes”. Biorheology. 46 (2): 121–132. doi:10.3233/BIR-2009-0532. PMID 19458415.
- ^ Benavides GA, Squadrito GL, Mills RW, Patel HD, Isbell TS, Patel RP, và đồng nghiệp (tháng 11 năm 2007). “Hydrogen sulfide mediates the vasoactivity of garlic”. Proceedings of the National Academy of Sciences of the United States of America. 104 (46): 17977–17982. Bibcode:2007PNAS..10417977B. doi:10.1073/pnas.0705710104. PMC 2084282. PMID 17951430.
- ^ “Red blood cells do more than just carry oxygen; New findings by NUS team show they aggressively attack bacteria too” (PDF). The Straits Times. 1 tháng 9 năm 2007. Truy cập ngày 26 tháng 3 năm 2013.
- ^ Jiang N, Tan NS, Ho B, Ding JL (tháng 10 năm 2007). “Respiratory protein-generated reactive oxygen species as an antimicrobial strategy”. Nature Immunology. 8 (10): 1114–1122. doi:10.1038/ni1501. PMID 17721536.
- ^ Berg JM, Tymoczko JL, Stryer L (2012). Biochemistry (ấn bản thứ 7). New York: W.H. Freeman. tr. 455, 609. ISBN 9781429229364.
- ^ Tilton WM, Seaman C, Carriero D, Piomelli S (tháng 8 năm 1991). “Regulation of glycolysis in the erythrocyte: role of the lactate/pyruvate and NAD/NADH ratios”. The Journal of Laboratory and Clinical Medicine. 118 (2): 146–152. PMID 1856577.
- ^ Kabanova S, Kleinbongard P, Volkmer J, Andrée B, Kelm M, Jax TW (2009). “Gene expression analysis of human red blood cells”. International Journal of Medical Sciences. 6 (4): 156–159. doi:10.7150/ijms.6.156. PMC 2677714. PMID 19421340.
- ^ Jain V, Yang WH, Wu J, Roback JD, Gregory SG, Chi JT (2022). “Single Cell RNA-Seq Analysis of Human Red Cells”. Frontiers in Physiology. 13: 828700. doi:10.3389/fphys.2022.828700. PMC 9065680. PMID 35514346.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). “Erythropoiesis Depends on the Hormone Erythropoietin”. Molecular biology of the cell (ấn bản thứ 4). New York: Garland. ISBN 0-8153-4072-9. Truy cập ngày 30 tháng 11 năm 2023.
- ^ “Scientists Explore Ways to Lure Viruses to Their Death”. The New York Times. 27 tháng 3 năm 2007. Truy cập ngày 26 tháng 3 năm 2013.
- ^ Heegaard ED, Brown KE (tháng 7 năm 2002). “Human parvovirus B19”. Clinical Microbiology Reviews. 15 (3): 485–505. doi:10.1128/CMR.15.3.485-505.2002. PMC 118081. PMID 12097253.
- ^ Harrison KL (tháng 6 năm 1979). “Fetal erythrocyte lifespan”. Australian Paediatric Journal. 15 (2): 96–97. doi:10.1111/j.1440-1754.1979.tb01197.x. PMID 485998.
- ^ Higgins JM (tháng 3 năm 2015). “Red blood cell population dynamics”. Clinics in Laboratory Medicine. 35 (1): 43–57. doi:10.1016/j.cll.2014.10.002. PMC 4717490. PMID 25676371.
- ^ Lang F, Lang E, Föller M (tháng 10 năm 2012). “Physiology and pathophysiology of eryptosis”. Transfusion Medicine and Hemotherapy. 39 (5): 308–314. doi:10.1159/000342534. PMC 3678267. PMID 23801921.
- ^ Föller M, Huber SM, Lang F (tháng 10 năm 2008). “Erythrocyte programmed cell death”. IUBMB Life. 60 (10): 661–668. doi:10.1002/iub.106. PMID 18720418.
Liên kết ngoài
[sửa | sửa mã nguồn]- Blood Groups and Red Cell Antigens by Laura Dean. Searchable and downloadable online textbook in the public domain.
- Database of vertebrate erythrocyte sizes.
- Red Gold, PBS site containing facts and history
![[Review sách] Atomic Habits - Hiểu đúng về thói quen](https://down-bs-vn.img.susercontent.com/sg-11134201-22110-rq2ijer9fyjv18.webp) GIẢM
26%
GIẢM
26%
 GIẢM
18%
GIẢM
18%
 GIẢM
17%
GIẢM
17%
![[Review sách] Bay trên tổ cúc cu - Ken Kesey](https://down-tx-vn.img.susercontent.com/079e668073f965ecde883224be898386.webp) GIẢM
20%
GIẢM
20%







