Kim loại nặng
Một số nội dung trong bài không khớp hoặc viết sai so với thông tin trong nguồn. (tháng 9 năm 2024) |

| Một phần của loạt bài về |
| Bảng tuần hoàn |
|---|
|
Các tập hợp nguyên tố |
Kim loại nặng (tiếng Anh: heavy metal) thường được định nghĩa là kim loại có khối lượng riêng, khối lượng nguyên tử hoặc số hiệu nguyên tử lớn. Tiêu chí phân loại cụ thể, cũng như việc liệu có thể xếp á kim vào nhóm kim loại nặng hay không, khác nhau tùy thuộc vào tác giả và phạm vi áp dụng. Ví dụ, trong luyện kim, một kim loại nặng có thể được xác định dựa vào khối lượng riêng, trong khi tiêu chí phân loại trong vật lý có thể là số hiệu nguyên tử, còn ở hóa học, người ta thường chú ý đến tính chất hóa học của kim loại đó. Một số cách định nghĩa khác cũng đã được công bố, nhưng hiện chưa có cách nào trong số đó được chấp nhận rộng rãi. Các cách định nghĩa trong bài viết dưới đây bao hàm tối đa 96 trong 118 nguyên tố hóa học đã biết; chỉ có thủy ngân, chì và bismuth thỏa mãn tất cả các tiêu chí trong đó. Mặc dù chưa có sự thống nhất về mặt khái niệm, nhưng thuật ngữ "kim loại nặng" vẫn được dùng phổ biến trong khoa học. Khối lượng riêng từ 5 g/cm3 trở lên đôi lúc được xem là một tiêu chí thường dùng, và đây cũng là tiêu chí sẽ được áp dụng trong phần dưới của bài viết này.
Những kim loại mà người ta đã biết sớm nhất—kim loại thường gặp như sắt, đồng, thiếc và kim loại quý như bạc, vàng và platin—đều là kim loại nặng. Từ năm 1809 trở đi, các kim loại nhẹ như magnesi, nhôm và titani lần lượt được phát hiện, cùng với một số kim loại nặng ít gặp hơn như gali, thali và hafni.
Một số kim loại nặng đóng vai trò là chất dinh dưỡng thiết yếu (điển hình như sắt, cobalt và kẽm), hoặc tương đối vô hại (như rutheni, bạc và indi), nhưng có thể gây độc ở lượng lớn hơn hoặc ở một số dạng nhất định. Các kim loại nặng khác như cadmi, thủy ngân và chì có độc tính cao. Một số nguồn tiềm ẩn nguy cơ gây ngộ độc kim loại nặng bao gồm chất thải từ mỏ khai thác, đuôi quặng, chất thải công nghiệp, dòng chảy mặt, phơi nhiễm nghề nghiệp, sơn và gỗ chế biến.
Cần chú ý kỹ khi khảo sát tính chất vật lý và hóa học của kim loại nặng, do tính chất của các kim loại liên quan không phải lúc nào cũng được xác định một cách thống nhất. Ngoài việc có khối lượng riêng tương đối lớn, kim loại nặng thường có khả năng phản ứng thấp hơn kim loại nhẹ và có số lượng hợp chất sulfide và hydroxide tan ít hơn nhiều. Mặc dù có thể dễ dàng phân biệt một kim loại nặng như wolfram với một kim loại nhẹ như natri, nhưng một vài kim loại nặng như kẽm, thủy ngân và chì có một số tính chất đặc trưng của kim loại nhẹ, trong khi một vài kim loại nhẹ như beryli, scandi và titani có một số tính chất đặc trưng của kim loại nặng.
Kim loại nặng tương đối hiếm trên vỏ Trái Đất nhưng vẫn xuất hiện trong nhiều khía cạnh của đời sống. Một số ứng dụng của chúng bao gồm trong gậy đánh golf, ô tô, chất sát trùng, lò nướng tự làm sạch, chất dẻo, tấm quang năng, điện thoại di động và máy gia tốc hạt.
Định nghĩa
[sửa | sửa mã nguồn]| Kim loại nặng trong bảng tuần hoàn | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||
| 1 | H | He | ||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||
| 6 | Cs | Ba | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | |||||||||||||||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | |||||||||||||||
| ||||||||||||||||||||||||||||
| Bảng trên liệt kê số tiêu chí kim loại nặng mà mỗi kim loại thỏa mãn trong 10 tiêu chí được liệt kê trong mục này, gồm hai tiêu chí về khối lượng riêng, ba tiêu chí về khối lượng nguyên tử, hai tiêu chí về số hiệu nguyên tử và ba tiêu chí về đặc tính hóa học.[n 1] Bảng này cho thấy không có sự thống nhất xung quanh khái niệm kim loại nặng, ngoại trừ ở thủy ngân, chì và bismuth. Sáu nguyên tố gần cuối chu kỳ (hàng) 4 đến 7 (thỉnh thoảng được cho là á kim), gồm germani (Ge), arsenic (As), seleni (Se), antimon (Sb), teluri (Te) và astatin (At) đều được xem là kim loại.[15][n 2] Oganesson (Og) được xem là phi kim.
| ||||||||||||||||||||||||||||
Hiện nay vẫn chưa có định nghĩa nào về kim loại nặng được chấp thuận rộng rãi. Thuật ngữ này có thể mang nhiều ý nghĩa khác nhau, tùy theo phạm vi áp dụng.[16] Ví dụ, trong luyện kim, một kim loại nặng có thể được xác định dựa vào khối lượng riêng,[17] trong khi tiêu chí phân loại trong vật lý có thể là số hiệu nguyên tử,[18] còn ở hóa học và sinh học, người ta thường chú ý đến tính chất hóa học của kim loại đó.[9]
Tiêu chí về khối lượng riêng là từ trên 3,5 g/cm3 đến trên 7 g/cm3, tùy trường hợp.[2] Tiêu chí về khối lượng nguyên tử có thể là lớn hơn natri (khối lượng nguyên tử 22,98);[2] lớn hơn 40 (ngoại trừ kim loại khối s và khối f, chỉ tính từ scandi);[3] hoặc lớn hơn 200, tức là từ thủy ngân trở đi.[4] Tiêu chí về số hiệu nguyên tử của kim loại nặng thường là trên 20 (calci),[2] và thỉnh thoảng có giới hạn trên là 92 (urani).[5] Cách định nghĩa theo số hiệu nguyên tử gặp phải một vấn đề là liệt kê cả các kim loại có khối lượng riêng thấp. Chẳng hạn, rubidi trong nhóm (cột) 1 của bảng tuần hoàn có số hiệu nguyên tử là 37 nhưng chỉ có khối lượng riêng là 1,532 g/cm3, thấp hơn mức giới hạn dưới mà nhiều tác giả khác đặt ra.[19] Vấn đề tương tự cũng có thể xảy ra đối với cách định nghĩa theo khối lượng nguyên tử.[20]
Một tiêu chí khác được đề xuất là dựa vào đặc tính hóa học hoặc vị trí của kim loại trong bảng tuần hoàn. Dược điển Mỹ đưa ra một tiêu chí để phân biệt kim loại nặng nhờ thí nghiệm tạo kết tủa muối sulfide có màu từ tạp chất kim loại.[6][n 3] Năm 1997, Stephen Hawkes, một giáo sư hóa học viết dựa trên 50 năm kinh nghiệm về thuật ngữ, nói rằng thuật ngữ này áp dụng được cho "kim loại có hợp chất sulfide và hydroxide không tan, có muối tan trong nước tạo thành dung dịch màu và phức chất thường có màu". Trên cơ sở các kim loại mà ông nhận thấy thường gọi là kim loại nặng, ông cho rằng có thể định nghĩa kim loại nặng (nói chung) là tất cả các kim loại trong bảng tuần hoàn ở cột 3 đến 16 và hàng 4 trở xuống, hay nói cách khác, chính là các kim loại chuyển tiếp và hậu chuyển tiếp.[9][n 4] Toàn bộ nguyên tố họ Lanthan thỏa mãn đúng theo mô tả gồm ba phần của Hawkes; đặc tính này đối với các nguyên tố họ Actini vẫn chưa được xác định hoàn toàn.[n 5][n 6]
Ở lĩnh vực hóa sinh, trên cơ sở các ion của chúng hoạt động theo đặc trưng acid Lewis (chất nhận một cặp electron) trong dung dịch nước, kim loại nặng đôi khi được định nghĩa là kim loại loại B hoặc kim loại trung gian.[41] Trong hệ thống phân loại này, ion kim loại loại A ưa chất cho oxy; ion loại B ưa chất cho nitơ hoặc lưu huỳnh; ion kim loại trung gian thể hiện đặc trưng loại A hoặc loại B tùy trường hợp.[n 7] Kim loại loại A, vốn thường có độ âm điện thấp cùng khả năng tạo liên kết có độ ion cao, bao gồm các kim loại kiềm và kiềm thổ, nhôm, kim loại nhóm 3, cùng kim loại họ Lanthan và Actini.[n 8] Kim loại loại B thường có độ âm điện cao hơn và khả năng tạo liên kết với đặc trưng cộng hóa trị đáng kể, chủ yếu gồm các kim loại chuyển tiếp và hậu chuyển tiếp nặng hơn. Nhóm kim loại trung gian phần lớn bao gồm các kim loại chuyển tiếp và hậu chuyển tiếp nhẹ hơn (cùng với arsenic và antimon). Sự khác biệt giữa kim loại nhóm A với hai nhóm còn lại rất rõ ràng.[45] Một đề xuất được trích dẫn nhiều trong các bài báo khoa học[46] đề nghị áp dụng hệ thống phân loại như trên thay vì tên gọi trừu tượng hơn kim loại nặng,[10] nhưng hiện nay vẫn chưa nhận được sự đồng thuận.[47]
Danh sách kim loại nặng theo khối lượng riêng
[sửa | sửa mã nguồn]Khối lượng riêng từ 5 g/cm3 trở lên đôi lúc được xem là yếu tố xác định kim loại nặng thường dùng,[48] và do hiện vẫn chưa có cách định nghĩa thống nhất, nên tiêu chí này được sử dụng để thiết lập danh sách và (nếu không nói gì thêm) sẽ là tiêu chí định hướng cho phần còn lại của bài viết. Á kim đáp ứng các tiêu chí áp dụng—chẳng hạn như arsenic và antimon—đôi khi được xếp vào nhóm kim loại nặng, đặc biệt trong hóa học môi trường[49] như trường hợp ở đây. Seleni (khối lượng riêng 4,8 g/cm3)[50] cũng được liệt kê trong danh sách. Nó có khối lượng riêng thấp một chút so với tiêu chí đặt ra và thỉnh thoảng được phân loại là á kim,[15] nhưng có tính chất hóa học trong nước tương đồng ở một số phương diện với arsenic và antimon.[51] Một số kim loại khác vốn đôi khi được xếp vào nhóm kim loại "nặng", như beryli[52] (khối lượng riêng 1,8 g/cm3),[53] nhôm[52] (2,7 g/cm3),[54] calci[55] (1,55 g/cm3),[56] và bari[55] (3,6 g/cm3)[57] trong trường hợp này sẽ được xem là kim loại nhẹ và nói chung sẽ không được khảo sát thêm nữa.
| Kim loại sản xuất chủ yếu qua khai thác thương mại (phân loại theo ý nghĩa kinh tế) | |||||||||
| |||||||||
| |||||||||
| Kim loại sản xuất chủ yếu qua biến đổi hạt nhân (phân loại theo tính bền) | |||||||||
| |||||||||
Nguồn gốc và sử dụng thuật ngữ
[sửa | sửa mã nguồn]Độ nặng của các kim loại thiên nhiên như vàng, đồng và sắt có thể đã được nhận thấy từ thời tiền sử và từ đó dẫn đến những nỗ lực đầu tiên để chế tạo đồ trang trí, công cụ và vũ khí bằng kim loại nhờ tính dễ uốn của chúng.[64] Tất cả các kim loại được tìm thấy từ thời điểm đó cho đến năm 1809 đều có khối lượng riêng tương đối lớn; độ nặng của chúng được xem là một tiêu chí phân loại độc nhất.[65]
Từ năm 1809 trở đi, những kim loại nhẹ như natri, kali và stronti bắt đầu lần lượt được phân lập thành công. Khối lượng riêng thấp của chúng đã thách thức những hiểu biết thông thường trước đây và người ta đã đề xuất gọi tên chúng là á kim (metalloid, có nghĩa là "giống với kim loại về hình thức hoặc vẻ ngoài").[66] Đề xuất này bị bỏ qua; các nguyên tố mới này đều được công nhận là kim loại và thuật ngữ á kim từ đó được dùng để chỉ các nguyên tố phi kim và sau này là những nguyên tố khó xác định là kim loại hay phi kim.[67]
Thuật ngữ "kim loại nặng" được sử dụng sớm nhất là vào năm 1817, khi nhà hóa học người Đức Leopold Gmelin chia các nguyên tố thành phi kim, kim loại nhẹ và kim loại nặng.[68] Kim loại nhẹ có khối lượng riêng 0,860–5 g/cm3; kim loại nặng 5,308–22,000.[69][n 9] Thuật ngữ đó về sau gắn liền với nguyên tố có khối lượng nguyên tử lớn hoặc số hiệu nguyên tử lớn.[19] Đôi khi nó được sử dụng thay cho thuật ngữ nguyên tố nặng. Ví dụ, khi bàn về lịch sử hóa học hạt nhân, Magee[70] viết rằng họ Actini từng được cho là chỉ một nhóm chuyển tiếp nguyên tố nặng trong khi Seaborg và cộng sự "ưu tiên ... một dãy kim loại nặng giống đất hiếm ...". Tuy vậy, trong thiên văn học, nguyên tố nặng là bất kỳ nguyên tố nào nặng hơn hydro và heli.[71]
Chỉ trích
[sửa | sửa mã nguồn]Năm 2002, nhà độc chất học John Duffus nhìn lại những khái niệm được sử dụng trong 60 năm qua và kết luận rằng chúng đa dạng đến mức làm thuật ngữ trở nên vô nghĩa.[72] Cùng với phát hiện trên, việc xếp một số kim loại vào nhóm kim loại nặng cũng gây tranh cãi với lý do rằng chúng quá nhẹ, có tham gia vào quá trình sinh học, hoặc hiếm khi tạo nên chất độc đối với môi trường. Một số ví dụ bao gồm scandi (quá nhẹ);[19][73] vanadi đến kẽm (quá trình sinh học);[74] rhodi, iridi và osmi (quá hiếm).[75]
Tính phổ biến
[sửa | sửa mã nguồn]Bất chấp việc mang nghĩa đáng nghi ngờ, thuật ngữ kim loại nặng vẫn xuất hiện nhiều trong các tài liệu khoa học. Một nghiên cứu năm 2010 cho thấy nó ngày càng được sử dụng nhiều hơn và dường như đã trở thành một phần của ngôn ngữ khoa học.[76] Nó được cho là một thuật ngữ chấp nhận được nhờ tính tiện lợi và dễ dùng, miễn rằng nó phải đi kèm với một định nghĩa chặt chẽ.[41] Trái ngược với kim loại nặng là kim loại nhẹ, mà theo ám chỉ của Hiệp hội Khoáng sản, Kim loại và Vật liệu thì bao gồm "nhôm, magnesi, beryli, titani, lithi và các kim loại hoạt động khác."[77] Các kim loại nói trên có khối lượng riêng từ 0,534 đến 4,54 g/cm3.
Vai trò sinh học
[sửa | sửa mã nguồn]| Nguyên tố | Miligam[78] | |
|---|---|---|
| Sắt | 4000 | |
| Kẽm | 2500 | |
| Chì[n 10] | 120 | |
| Đồng | 70 | |
| Thiếc[n 11] | 30 | |
| Vanadi | 20 | |
| Cadmi | 20 | |
| Nickel[n 12] | 15 | |
| Seleni | 14 | |
| Mangan | 12 | |
| Khác[n 13] | 200 | |
| Tổng | 7000 | |
Một lượng nhỏ một số kim loại nặng, phần lớn ở chu kỳ 4, rất cần thiết cho một số quá trình sinh học nhất định. Chúng gồm có sắt và đồng (vận chuyển oxy và electron); cobalt (tổng hợp phức chất và trao đổi chất tế bào); kẽm (hydroxyl hóa);[83] vanadi và mangan (điều hòa hoặc vận hành enzym); chromi (sử dụng glucose); nickel (tăng sinh tế bào); arsenic (tăng sinh trao đổi chất ở một số động vật và có thể ở người) và seleni (hoạt động chống oxy hóa và tổng hợp nội tiết tố).[84] Chu kỳ 5 và 6 chứa ít kim loại nặng thiết yếu hơn, phù hợp với xu hướng chung rằng nguyên tố nặng hơn thường có độ phong phú thấp hơn và nguyên tố hiếm hơn thì càng ít có khả năng là chất khoáng thiết yếu.[85] Ở chu kỳ 5, molybden là nguyên tố cần thiết để làm xúc tác cho các phản ứng oxy hóa khử; cadmi được một số loại tảo silic biển dùng với cùng mục đích trên; thiếc cần có cho sự sinh trưởng của một số loài.[86] Ở chu kỳ 6, wolfram là nguyên tố thiết yếu cho các quá trình trao đổi chất đối với một số cổ khuẩn và vi khuẩn.[87] Trung bình trong một cơ thể người trọng lượng 70 kg có khoảng 0,01% kim loại nặng (~7 g, tương đương với khối lượng hai hạt đậu khô, trong đó ba thành phần chính là sắt với 4 g, kẽm 2,5 g và chì 0,12 g), 2% kim loại nhẹ (~1,4 kg, khối lượng một chai rượu) và gần 98% là phi kim (phần lớn là nước).[88][n 14]
Thiếu đi bất kỳ kim loại nặng thiết yếu nào thuộc chu kỳ 4–6 nói trên có thể làm tăng tính mẫn cảm với ngộ độc kim loại nặng (ngược lại, dùng quá nhiều có thể gây tác dụng sinh học bất lợi).[89] Một số ít kim loại nặng vi lượng được ghi nhận có tác dụng sinh học. Gali, germani (một á kim), indi và phần lớn nguyên tố họ Lanthan có thể kích thích trao đổi chất và titani giúp đẩy mạnh sinh trưởng ở thực vật[90] (dù không phải lúc nào cũng được xem là kim loại nặng).
Độc tính
[sửa | sửa mã nguồn]- Trọng tâm của phần này chủ yếu là về tác hại nghiêm trọng nhất của kim loại nặng, bao gồm ung thư, chấn thương não và tử vong, thay vì tác hại đối với da, phổi, dạ dày, thận, gan và tim. Đối với thông tin chi tiết, xem bài Độc tính kim loại, Kim loại nặng độc hại, hoặc bài viết về các nguyên tố hoặc hợp chất tương ứng.
Kim loại nặng thường được cho là có độc tính cao hoặc gây hại với môi trường.[91] Một số thì như vậy, trong khi số khác chỉ gây độc nếu dùng quá mức hoặc dùng ở một số dạng nhất định.
Kim loại nặng môi trường
[sửa | sửa mã nguồn]Chromi, arsenic, cadmi, thủy ngân và chì có khả năng gây hại cao nhất do việc được sử dụng rộng rãi, độc tính của một số kim loại trong đó dưới dạng hợp chất hoặc nguyên tố, cùng với sự phân bố rộng rãi trong môi trường.[92] Chẳng hạn, chromi hóa trị VI có độc tính cao như hơi thủy ngân và nhiều hợp chất của thủy ngân.[93] Năm nguyên tố trên tạo ái lực mạnh với lưu huỳnh; trong cơ thể người chúng thường liên kết, thông qua nhóm thiol (–SH), đến các enzym đóng vai trò kiểm soát tốc độ phản ứng trao đổi chất. Liên kết lưu huỳnh-kim loại tạo thành sẽ làm ức chế hoạt động bình thường của enzym liên quan, làm sức khỏe con người suy giảm, đôi khi gây tử vong.[94] Chromi (ở dạng hóa trị VI) và arsenic là tác nhân gây ung thư;[95] cadmi gây một căn bệnh thoái hóa xương;[96] thủy ngân và chì làm tổn hại hệ thần kinh trung ương.[97]
Chì là tạp chất kim loại nặng phổ biến nhất.[98] Hàm lượng chì trong môi trường nước của các quốc gia công nghiệp hóa được ước tính bằng khoảng hai đến ba lần so với thời tiền công nghiệp.[99] Là một thành phần của tetraethyl chì, (CH3CH2)4Pb, nó được dùng rộng rãi trong xăng vào những năm 1930–1970.[100] Mặc dù việc sử dụng xăng pha chì đã gần như bị loại bỏ tại Bắc Mỹ đến năm 1996, nhưng đất bên cạnh đường sá xây dựng trước thời điểm này vẫn còn có nồng độ chì cao.[101] Các nghiên cứu sau này đã chứng tỏ sự tồn tại mối tương quan mang ý nghĩa thống kê giữa tỉ lệ dùng xăng pha chì với tội phạm bạo lực tại Mỹ; khi xét đến độ trễ thời gian 22 năm (đối với tuổi trung bình của tội phạm bạo lực), đường cong tỉ lệ tội phạm bạo lực hầu như đi đúng theo đường cong tỉ lệ phơi nhiễm chì.[102]
Một số kim loại nặng khác với tính nguy hại tiềm ẩn, thường dưới dạng tạp chất môi trường gây độc, bao gồm mangan (tổn thương hệ thần kinh trung ương);[103] cobalt và nickel (chất gây ung thư);[104] đồng,[105] kẽm,[106] seleni[107] và bạc[108] (rối loạn nội tiết, bất thường bẩm sinh, hoặc ảnh hưởng nói chung đối với cá, thực vật, chim và các sinh vật sống dưới nước khác); thiếc, ở dạng hợp chất hữu cơ (tổn thương hệ thần kinh trung ương);[109] antimon (được cho là chất gây ung thư);[110] và thali (tổn thương hệ thần kinh trung ương).[105][n 15][n 16]
Kim loại nặng đa lượng
[sửa | sửa mã nguồn]Kim loại nặng thiết yếu cho sự sống có thể gây độc nếu dùng lượng quá nhiều; một số kim loại có dạng gây độc đáng chú ý. Vanadi pentoxide (V2O5) là chất gây ung thư ở động vật và gây hư hại DNA khi hít phải.[105] Ion permanganat tím MnO–
4 là chất gây độc cho gan và thận.[114] Ăn uống nhiều hơn 0,5 gam sắt có thể gây trụy tim; hiện tượng quá liều như vậy xảy ra phổ biến nhất ở trẻ em và có thể gây tử vong trong vòng 24 giờ.[105] Nickel carbonyl (Ni(CO)4), ở mật độ 30 phần triệu, có khả năng gây suy hô hấp, chấn thương não và tử vong.[105] Uống một gam đồng(II) sulfat (CuSO4) trở lên có thể gây chết, hoặc ít nhất là tổn thương nghiêm trọng đến các cơ quan nội tạng.[115] Hấp thụ khoảng 5 miligam seleni trở lên, lớn hơn khoảng 10 lần mức nhu cầu khuyến nghị tối đa hằng ngày 0,45 miligam, gây ra độc tính mạnh;[116] ngộ độc về lâu dài có thể gây liệt.[105][n 17]
Kim loại nặng khác
[sửa | sửa mã nguồn]Một số ít kim loại nặng không thiết yếu khác có một hoặc nhiều dạng gây độc. Các ca suy thận và tử vong đã được ghi nhận do ăn thực phẩm chức năng chứa germani (~15 đến 300 g tổng lượng tiêu thụ trong vòng hai tháng đến ba năm).[105] Phơi nhiễm osmi tetroxide (OsO4) có thể gây tổn thương mắt vĩnh viễn, dẫn đến suy hô hấp[118] và tử vong.[119] Muối indi gây độc khi ăn phải với liều lượng vài miligam trở lên, ảnh hưởng đến thận, gan và tim.[120] Cisplatin (PtCl2(NH3)2), một thuốc quan trọng dùng để tiêu diệt tế bào ung thư, cũng là chất độc đối với thận và hệ thần kinh.[105] Hợp chất của bismuth có khả năng gây tổn thương gan nếu dùng quá liều; hợp chất urani không tan cùng với bức xạ nguy hiểm phát ra có thể gây tổn thương thận vĩnh viễn.[121]
Nguồn phơi nhiễm
[sửa | sửa mã nguồn]Kim loại nặng có thể làm suy giảm chất lượng không khí, nước và đất, kéo theo đó gây ra các vấn đề về sức khỏe ở thực vật, động vật và người, khi chúng tích tụ dần do hoạt động công nghiệp.[122] Các nguồn kim loại nặng chủ yếu trong trường hợp này bao gồm khai thác mỏ và chất thải công nghiệp; khí thải xe cộ; pin chì-acid; phân bón; sơn; gỗ đã qua xử lý;[123] cơ sở hạ tầng cấp nước xuống cấp;[124] và vi nhựa trôi nổi trên các đại dương.[125] Một số ví dụ gần đây về ô nhiễm kim loại nặng bao gồm sự xuất hiện bệnh Minamata ở Nhật Bản (1932–1968; các vụ kiện đang diễn ra tại thời điểm năm 2016);[126] thảm họa đập Mariana ở Brazil tháng 11 năm 2015;[127] hay nồng độ chì cao trong nước uống cấp cho người dân tại Flint, Michigan, ở vùng đông bắc nước Mỹ.[128]
Quá trình hình thành, độ phong phú, tồn tại và điều chế
[sửa | sửa mã nguồn]| Kim loại nặng trên vỏ Trái Đất: | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| độ phong phú theo khối lượng và nguồn (hoặc nơi) tồn tại chính[n 18] | |||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | H | He | |||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||
| 6 | Cs | Ba | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | ||||
| 7 | Ra | ||||||||||||||||||
| La | Ce | Pr | Nd | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | |||||||
| Th | Pa | U | |||||||||||||||||
Phổ biến nhất (56.300 ppm)
|
Hiếm (0,01–0,99 ppm)
| ||||||||||||||||||
Phổ biến (100–999 ppm)
|
Rất hiếm (0,0001–0,0099 ppm)
| ||||||||||||||||||
Ít gặp (1–99 ppm)
|
Ít phổ biến nhất (~0,000 001 ppm)
| ||||||||||||||||||
| Kim loại nặng bên trái đường phân cách tồn tại (hoặc có nguồn gốc) chủ yếu ở dạng ưa đá; với kim loại ở bên phải, ở dạng ưa lưu huỳnh ngoại trừ vàng (ưa sắt) và thiếc (ưa đá). | |||||||||||||||||||
Các kim loại nặng cho đến khoảng lân cận của sắt (trong bảng tuần hoàn) phần lớn được tạo thành qua tổng hợp hạt nhân sao. Trong quá trình này, những nguyên tố nhẹ từ hydro đến silic trải qua các phản ứng nhiệt hạch liên tiếp trong các ngôi sao, giải phóng ánh sáng và nhiệt đồng thời hình thành các nguyên tố nặng hơn với số hiệu nguyên tử cao hơn.[132]
Kim loại nặng nặng hơn thường không được tạo ra bằng cách trên do phản ứng nhiệt hạch với những hạt nhân loại này sẽ thu thay vì giải phóng năng lượng.[133] Thay vào đó, chúng chủ yếu được tổng hợp (từ các nguyên tố có số hiệu nguyên tử thấp hơn) qua việc bắt giữ neutron lặp đi lặp lại, với hai dạng chính là quá trình s và quá trình r. Trong quá trình s ("s" viết tắt cho chữ "slow" có nghĩa là "chậm"), mỗi lần bắt neutron cách nhau khoảng vài năm hoặc vài chục năm, khiến hạt nhân kém bền hơn bị phân rã beta,[134] trong khi ở quá trình r ("rapid", nhanh), việc bắt neutron xảy ra nhanh hơn sự phân rã của hạt nhân. Vì vậy, quá trình s diễn ra theo một con đường tương đối rõ ràng: ví dụ, hạt nhân cadmi-110 bền liên tục bị các neutron tự do bắn phá bên trong một ngôi sao đến khi chúng tạo thành hạt nhân cadmi-115, vốn không bền và bị phân rã để tạo ra indi-115 (gần bền, với chu kỳ bán rã khoảng 30.000 lần tuổi của vũ trụ). Các hạt nhân này tiếp tục bắt neutron để hình thành indi-116 (không bền) và phân rã thành thiếc-116, v.v.[132][135][n 19] Ngược lại, quá trình r lại không có con đường nào như vậy. Quá trình s dừng lại ở bismuth do chu kỳ bán rã ngắn của hai nguyên tố tiếp theo, poloni và astatin, vốn phân rã thành bismuth hoặc chì. Quá trình r nhanh đến mức nó có thể bỏ qua "vùng không ổn định" này và tạo ra các nguyên tố nặng hơn như thori và urani.[137]
Kim loại nặng ngưng tụ trong các hành tinh do các quá trình tiến hóa và phá hủy sao. Một ngôi sao mất đi phần lớn khối lượng do bị thổi bay vào khoảng cuối vòng đời của nó, và đôi lúc về sau do kết quả của sự hợp nhất sao neutron,[138][n 20] làm tăng mật độ của các nguyên tố nặng hơn heli trong môi trường liên sao. Khi lực hấp dẫn làm cho vật chất này liên kết lại và sụp đổ, thì các ngôi sao và hành tinh mới được hình thành.[140]
Vỏ Trái Đất chứa khoảng 5% kim loại nặng về khối lượng, trong đó sắt chiếm 95%; kim loại nhẹ (~20%) và phi kim (~75%) chiếm 95% phần lớp vỏ còn lại.[129] Dù tương đối khan hiếm, kim loại nặng có thể tích lũy dần đến lượng khai thác được về mặt kinh tế do sự hình thành núi, xói mòn hoặc các quá trình địa chất khác.[141]
Kim loại nặng chủ yếu có ở dạng ưa đá hoặc ưa lưu huỳnh (theo phân loại Goldschmidt). Kim loại nặng ưa đá đa phần gồm nguyên tố khối f cùng một số nguyên tố hoạt động mạnh nhất của khối d trong bảng tuần hoàn. Chúng có ái lực mạnh với oxy và phần lớn tồn tại dưới dạng khoáng vật silicat với khối lượng riêng tương đối thấp.[142] Kim loại nặng ưa lưu huỳnh chủ yếu gồm những nguyên tố hoạt động yếu của khối d cùng với các kim loại và á kim thuộc khối p, chu kỳ 4–6 trong bảng tuần hoàn. Chúng thường được tìm thấy trong khoáng vật sulfide (không tan). Với khối lượng riêng nặng hơn loại ưa đá dẫn đến bị chìm sâu hơn trong lớp vỏ ở thời điểm đông đặc, loại ưa lưu huỳnh dễ có xu hướng giảm đi mật độ phân bố so với loại ưa đá.[143]
Mặt khác, vàng là một nguyên tố ưa sắt và khó tạo thành hợp chất với oxy hoặc lưu huỳnh.[144] Vào thời điểm Trái Đất hình thành, là kim loại quý (trơ) nhất, vàng bị chìm xuống vào bên trong lõi do có xu hướng tạo thành hợp kim có khối lượng riêng lớn. Do đó, nó là một kim loại tương đối hiếm.[145] Một số kim loại nặng quý (kém hơn) khác—molybden, rheni, kim loại nhóm platin (rutheni, rhodi, paladi, osmi, iridi và platin), germani và thiếc—đều có thể xem là thuộc nhóm ưa sắt khi chỉ xét về mức độ phân bố trong toàn bộ Trái Đất (tính cả lõi, manti và lớp vỏ), thay vì chỉ lớp vỏ. Các kim loại trên tồn tại trên vỏ với lượng nhỏ, chủ yếu dưới dạng ưa lưu huỳnh (đặc tính này kém hơn ở dạng kim loại thiên nhiên).[146][n 21]
Nồng độ kim loại nặng bên dưới lớp vỏ thường cao hơn, với hầu hết trong đó có ở lõi đa phần chứa sắt-silic-nickel. Ví dụ, platin chiếm khoảng 1 phần tỷ ở lớp vỏ trong khi mật độ phân bố trong lõi của nó được cho là cao hơn gần 6.000 lần.[147][148] Một số suy đoán gần đây cho thấy urani (và thori) trong lõi có thể tạo ra lượng nhiệt đáng kể thúc đẩy kiến tạo mảng và (sau cùng) duy trì từ trường Trái Đất.[149][n 22]
Việc khai thác kim loại nặng từ quặng của chúng phụ thuộc một cách phức tạp vào loại quặng, tính chất hóa học của kim loại và tính kinh tế của các phương pháp chiết tách khác nhau. Tùy theo mỗi quốc gia hoặc nhà máy luyện kim khác nhau sẽ có những quy trình khác nhau được áp dụng, có thể khác với một số kỹ thuật chung được liệt kê dưới đây.
Nói chung (với một số ngoại lệ), kim loại nặng ưa đá có thể tách từ quặng chứa nó qua xử lý về điện hoặc hóa học, còn kim loại nặng ưa lưu huỳnh thu được bằng cách nung quặng sulfide để tạo oxide tương ứng rồi làm nóng để được kim loại thô.[151][n 23] Radi tồn tại ở lượng quá nhỏ để khai thác về mặt kinh tế và thay vào đó được chiết ra từ nhiên liệu hạt nhân đã qua sử dụng.[154] Kim loại nhóm platin ưa lưu huỳnh (PGM) chủ yếu có ở lượng nhỏ (hỗn hợp) với quặng ưa lưu huỳnh khác. Quặng loại này cần được nấu luyện, nung và chiết lọc với acid sulfuric để tạo phần lắng chứa PGM. Phần này sau đó được tinh chế hóa học để thu được những kim loại riêng lẻ ở dạng tinh khiết.[155] So với các kim loại khác, PGM có giá cao do tính khan hiếm[156] và chi phí sản xuất lớn.[157]
Vàng, một kim loại ưa sắt, thường được thu lại nhiều nhất bằng cách hòa tan quặng chứa nó trong dung dịch cyanide.[158] Vàng này tạo thành dicyanoaurate(I), ví dụ:
Kẽm được cho thêm vào hỗn hợp và đẩy vàng ra khỏi muối vừa thu được do hoạt động hóa học mạnh hơn vàng:
- 2 K[Au(CN)2] + Zn → K2[Zn(CN)4] + 2 Au.
Vàng kết tủa dưới dạng bùn, sau đó được lọc ra và nấu chảy.[159]
So sánh tính chất với kim loại nhẹ
[sửa | sửa mã nguồn]Một số tính chất vật lý và hóa học chung của kim loại nhẹ và nặng được tóm tắt trong bảng dưới đây. Việc so sánh phải được thực hiện một cách cẩn trọng do các thuật ngữ kim loại nhẹ và kim loại nặng không phải lúc nào cũng được định nghĩa một cách thống nhất. Đồng thời, tính chất vật lý về độ cứng và độ bền kéo có thể khác nhau rất nhiều tùy vào độ tinh khiết, kích thước vi tinh thể và quá trình tiền xử lý.[160]
| Tính chất vật lý | Kim loại nhẹ | Kim loại nặng |
|---|---|---|
| Khối lượng riêng | Thường thấp hơn | Thường cao hơn |
| Độ cứng[161] | Thường mềm, dễ cắt hoặc uốn cong | Hầu hết khá cứng |
| Độ giãn nở nhiệt[162] | Đa phần lớn hơn | Đa phần nhỏ hơn |
| Nhiệt độ nóng chảy | Đa phần thấp[163] | Thấp đến rất cao[164] |
| Độ bền kéo[165] | Đa số thấp hơn | Đa số cao hơn |
| Tính chất hóa học | Kim loại nhẹ | Kim loại nặng |
| Vị trí trong bảng tuần hoàn | Đa số ở nhóm 1 và 2[166] | Hầu hết ở nhóm 3 đến 16 |
| Độ phong phú trên vỏ Trái Đất[129][167] | Cao hơn | Thấp hơn |
| Phân loại địa hóa | Ưa đá[131] | Ưa đá hoặc ưa lưu huỳnh (Au ưa sắt) |
| Mức độ phản ứng[77][167] | Cao hơn | Thấp hơn |
| Sulfide | Tan đến không tan[n 24] | Cực kỳ không tan[172] |
| Hydroxide | Tan đến không tan[n 25] | Thường không tan[176] |
| Muối[169] | Phần lớn tạo dung dịch không màu trong nước | Phần lớn tạo dung dịch có màu trong nước |
| Phức chất | Đa số không màu[177] | Đa số có màu[178] |
| Vai trò sinh học[179] | Gồm nguyên tố đa lượng (Na, Mg, K, Ca) | Gồm nguyên tố vi lượng (V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo) |
Những đặc tính trên giúp chúng ta dễ dàng phân biệt một kim loại nhẹ như natri với một kim loại nặng như wolfram, nhưng sự khác biệt này không còn rõ ràng đối với những kim loại ở vùng ranh giới. Kim loại cấu trúc nhẹ như beryli, scandi và titani có một số đặc tính của kim loại nặng như nhiệt độ nóng chảy cao;[n 26] kim loại nặng hậu chuyển tiếp như kẽm, cadmi và chì có một số đặc tính của kim loại nhẹ như: tương đối mềm, nhiệt độ nóng chảy thấp hơn;[n 27] và chủ yếu tạo thành các phức chất không màu.[21][23][24]
Ứng dụng
[sửa | sửa mã nguồn]Kim loại nặng có mặt ở hầu hết khía cạnh của cuộc sống hiện đại. Sắt có thể là kim loại nặng phổ biến nhất do chiếm 90% lượng kim loại tinh chế. Platin có thể là kim loại nặng có mặt rộng rãi nhất vì nó được cho là được tìm thấy trong, hoặc sử dụng để sản xuất, 20% lượng mặt hàng tiêu dùng.[184]
Một số ứng dụng thường gặp của kim loại nặng được dựa trên các tính chất chung của kim loại như tính dẫn điện và tính phản xạ, hoặc những đặc tính chung của kim loại nặng như khối lượng riêng và độ bền. Một số ứng dụng khác phụ thuộc vào tính chất của nguyên tố cụ thể, chẳng hạn như vai trò sinh học (là chất dinh dưỡng hoặc chất độc) hoặc một số tính chất nguyên tử cụ thể khác, bao gồm: orbital d hoặc f lấp đầy một phần (trong nhiều kim loại nặng chuyển tiếp, thuộc họ Lanthan và Actini) để tạo hợp chất có màu;[185] khả năng để phần lớn ion kim loại nặng (như platin,[186] ceri[187] và bismuth[188]) tồn tại ở nhiều trạng thái oxy hóa khác nhau dẫn đến đóng vai trò xúc tác;[189] orbital 3d hoặc 4f xen phủ kém (trong sắt, cobalt và nickel, hoặc kim loại nặng họ Lanthan từ europi đến thulium) gây hiệu ứng từ;[190] số hiệu nguyên tử và mật độ electron cao làm cơ sở cho các ứng dụng khoa học hạt nhân.[191] Những ứng dụng điển hình của kim loại nặng có thể được chia thành sáu nhóm chính dưới đây.[192][n 28]
Ứng dụng dựa trên trọng lượng hoặc khối lượng riêng
[sửa | sửa mã nguồn]
Một số ứng dụng của kim loại nặng, bao gồm trong thể thao, kỹ thuật cơ khí, vũ khí quân sự và khoa học hạt nhân được dựa trên khối lượng riêng tương đối lớn của chúng. Trong lặn dưới nước, chì được dùng làm vật dằn;[194] trong đua ngựa có chấp, mỗi con ngựa phải mang theo vật nặng bằng chì với khối lượng xác định dựa vào nhiều yếu tố bao gồm thành tích trước đây để đảm bảo tính công bằng.[195] Trong golf, chi tiết chèn làm bằng wolfram, đồng hoặc đồng thau trong gậy đường bóng làm hạ trọng tâm của gậy xuống, giúp người chơi dễ dàng đưa bóng lên trời;[196] bóng golf với lõi bằng wolfram được cho là có đặc tính bay tốt hơn.[197] Trong câu cá bằng ruồi, dây câu chìm có một lớp phủ PVC bao bằng bột wolfram để nó chìm với tốc độ cần thiết.[198] Đối với thể thao điền kinh trong sân vận động, quả cầu thép dùng trong môn ném búa và đẩy tạ được làm đầy bằng chì nhằm đạt trọng lượng tối thiểu quy định theo luật quốc tế.[199] Wolfram trước đây từng được sử dụng trong búa ném ít nhất đến năm 1980; kích thước tối thiểu của quả cầu được nâng lên vào năm 1981 nhằm loại bỏ sự cần thiết phải dùng một kim loại đắt đỏ (chi phí gấp ba lần các loại búa ném khác) vốn không có sẵn ở tất cả các nước.[200] Búa ném bằng wolfram nặng đến mức đâm quá sâu vào mặt cỏ.[201]
Trong kỹ thuật cơ khí, kim loại nặng được dùng làm vật dằn trong tàu thuyền,[202] máy bay[203] và xe cơ giới;[204] hoặc trong vật nặng cân bằng ở bánh xe và trục khuỷu,[205] con quay hồi chuyển và thiết bị đẩy (chân vịt tàu, cánh quạt máy bay),[206] và khớp ly hợp ly tâm,[207] trong điều kiện cần trọng lượng tối đa ở không gian tối thiểu (chẳng hạn như trong bộ máy đồng hồ).[203]
AM Russell và KL Lee
Structure–property relations
in nonferrous metals (2005, tr. 16)
Về mặt vũ khí quân sự, wolfram hoặc urani được sử dụng trong bảo vệ phương tiện quân sự[208] và đạn mũi tên xuyên,[209] cũng như trong vũ khí hạt nhân để tăng hiệu suất (qua phản xạ neutron và làm chậm quá trình giãn nở của vật liệu phản ứng trong giây lát).[210] Vào những năm 1970, tantal được phát hiện có hiệu suất cao hơn đồng trong lượng nổ lõm và lõi xuyên giáp nổ tạo hình (EFP) do khối lượng riêng cao hơn giúp tập trung lực lớn hơn, cùng khả năng biến dạng tốt hơn.[211] Kim loại nặng ít độc như đồng, thiếc, wolfram và bismuth và có thể có mangan (cùng với bor, một á kim), đã thay thế chì và antimon trong đạn xanh do một số quân đội sử dụng và trong một số loại đạn dược bắn tiêu khiển.[212] Đã có những nghi ngờ được đặt ra về độ an toàn (hoặc độ thân thiện với môi trường) của wolfram.[213] Do vật liệu có khối lượng riêng lớn hấp thụ nhiều phóng xạ hơn, nên kim loại nặng có vai trò quan trọng trong bảo vệ phóng xạ và chuẩn trực tia phóng xạ trong máy gia tốc hạt tuyến tính và trong trị liệu bức xạ.[214]
Ứng dụng dựa trên độ bền
[sửa | sửa mã nguồn]
Độ bền của các kim loại nặng như chromi, sắt, nickel, đồng, kẽm, molybden, thiếc, wolfram và chì cùng các hợp kim của chúng đã mang lại tính hữu dụng cho việc sản xuất nhiều sản phẩm như công cụ, máy móc,[217] đồ gia dụng,[218] dụng cụ nhà bếp,[219] đường ống,[218] đường ray,[220] công trình xây dựng[221] và cầu đường,[222] ô tô,[218] khóa,[223] đồ nội thất,[224] tàu thuyền,[202] máy bay,[225] tiền đúc[226] và đồ trang sức.[227] Chúng còn là phụ gia hợp kim để tăng cường cho tính chất của các kim loại khác.[n 30] Trong 24 nguyên tố có trong tiền đúc được lưu hành trên thế giới, chỉ có carbon và nhôm không phải là kim loại nặng.[229][n 31] Vàng, bạc và platin được dùng trong trang sức;[n 32] tương tự đối với (chẳng hạn) nickel, đồng, indi và cobalt trong vàng màu.[232] Trang sức giá rẻ và đồ chơi trẻ em có thể được làm (đến một mức nhất định) bằng kim loại nặng như chromi, nickel, cadmi hoặc chì.[233]
Đồng, kẽm, thiếc và chì là những kim loại yếu hơn về mặt cơ học nhưng có đặc tính chống ăn mòn hữu ích. Dù mỗi kim loại trong số này sẽ phản ứng với không khí, nhưng lớp màng thu được gồm nhiều muối đồng,[234] kẽm carbonat, thiếc oxide, hoặc hỗn hợp chì oxide, carbonat và sulfat, sẽ tạo ra những đặc tính bảo vệ có ích.[235] Đồng và chì do đó được dùng làm vật liệu mái nhà chẳng hạn;[236][n 33] kẽm đóng vai trò là chất chống ăn mòn trong thép mạ kẽm;[237] và thiếc có vai trò tương tự trong lon thiếc.[238]
Khả năng gia công và chống ăn mòn của sắt và chromi tăng lên bằng cách thêm gadolini; tính chống rão của nickel được cải thiện khi cho thêm thori. Teluri được thêm vào hợp kim đồng và thép để cải thiện khả năng gia công; vào chì để giúp nó cứng hơn và bền hơn với acid.[239]
Sinh học và hóa học
[sửa | sửa mã nguồn]
Người ta đã biết tác dụng diệt khuẩn của một số kim loại nặng từ thời cổ đại.[241] Platin, osmi, đồng, rutheni và các kim loại nặng khác (bao gồm arsenic) đã được ứng dụng hoặc cho thấy tiềm năng trong các liệu pháp điều trị ung thư.[242] Antimon (chống sinh vật nguyên sinh), bismuth (chống loét), vàng (chống viêm khớp) và sắt (chống sốt rét) cũng rất quan trọng trong y học.[243] Đồng, kẽm, bạc, vàng hoặc thủy ngân đều có trong các dạng chất sát trùng;[244] một lượng nhỏ một số kim loại nặng được dùng để kiểm soát sự sinh trưởng của tảo trong tháp giải nhiệt chẳng hạn.[245] Tùy vào mục đích sử dụng làm phân bón hoặc chất diệt khuẩn, sản phẩm nông hóa học có thể chứa các kim loại nặng như chromi, cobalt, nickel, đồng, kẽm, arsenic, cadmi, thủy ngân hoặc chì.[246]
Một vài kim loại nặng được dùng làm xúc tác trong xử lý nhiên liệu (ví dụ như rheni), sản xuất cao su và sợi tổng hợp (bismuth), thiết bị kiểm soát khí thải (paladi) và trong lò nướng tự làm sạch (ceri(IV) oxide ở thành lò giúp oxy hóa bã thực phẩm gốc carbon).[247] Kim loại nặng còn tạo thành xà phòng không tan dùng trong mỡ bôi trơn, chất làm khô sơn và thuốc diệt nấm (ngoại trừ lithi, kim loại kiềm và ion amoni tạo thành xà phòng tan).[248]
Tạo màu và quang học
[sửa | sửa mã nguồn]
Màu của thủy tinh, men gốm, sơn, chất màu và chất dẻo thường được tạo ra khi thêm kim loại nặng (hoặc hợp chất của chúng) như chromi, mangan, cobalt, đồng, kẽm, seleni, zirconi, molybden, bạc, thiếc, praseodymi, neodymi, erbi, wolfram, iridi, vàng, chì hoặc urani.[250] Mực xăm có thể chứa các kim loại nặng như chromi, cobalt, nickel và đồng.[251] Độ phản xạ cao của một số kim loại nặng đóng vai trò quan trọng trong chế tạo gương, bao gồm dụng cụ thiên văn chính xác cao. Chóa đèn pha được dựa trên độ phản xạ cực tốt của một màng mỏng rhodi.[252]
Điện tử, nam châm và chiếu sáng
[sửa | sửa mã nguồn]
Kim loại nặng hoặc các hợp chất của chúng có trong linh kiện điện tử, điện cực cùng với hệ thống mạch điện và tấm quang năng, ở đó chúng có thể làm chất dẫn diện, bán dẫn hoặc cách điện. Bột molybden có trong mực phủ mạch in.[253] Anode titani đã phủ rutheni(IV) oxide được dùng để sản xuất chlor trong công nghiệp.[254] Mạng điện gia đình phần lớn được đấu nối bằng dây đồng do đặc tính dẫn điện tốt của nó.[255] Bạc và vàng được sử dụng trong các thiết bị điện và điện tử, đặc biệt là công tắc tiếp xúc nhờ tính dẫn điện tốt và khả năng chống lại hoặc giảm thiểu sự hình thành tạp chất trên bề mặt của chúng.[256] Hai chất bán dẫn cadmi(II) teluride và gali(III) arsenide được ứng dụng trong sản xuất tấm quang năng. Hafni(IV) oxide, một chất cách điện, được dùng để điều chỉnh điện áp trong vi mạch; tantal(V) oxide, một chất cách điện khác, có trong tụ điện của điện thoại di động.[257] Kim loại nặng đã được sử dụng trong pin điện trong hơn 200 năm, ít nhất từ khi Volta phát minh ra pin đồng và bạc mang tên mình vào năm 1800.[258] Promethi, lanthan và thủy ngân là ba kim loại nặng khác lần lượt được tìm thấy trong pin nguyên tử, pin nickel hydride kim loại và pin cúc áo.[259]
Nam châm được làm từ các kim loại nặng như mangan, sắt, cobalt, nickel, niobi, bismuth, praseodymi, neodymi, gadolini và dysprosi. Nam châm neodymi là loại nam châm vĩnh cửu mạnh nhất có trên thị trường. Chúng là thành phần chính trong khóa cửa xe ô tô, hệ thống khởi động, bơm nhiên liệu và cửa sổ điện, chẳng hạn.[260]
Kim loại nặng còn được dùng trong chiếu sáng, laser và diode phát quang (LED). Màn hình phẳng thường kết hợp thêm một màng mỏng indi thiếc oxide dẫn điện. Đèn huỳnh quang phụ thuộc vào hơi thủy ngân để hoạt động. Laser hồng ngọc tạo những chùm sáng màu đỏ đậm bởi các nguyên tử chromi kích thích; các nguyên tố họ Lanthan cũng được sử dụng nhiều trong laser. Gali, indi và arsenic;[261] đồng, iridi và platin được dùng trong LED (trong đó đồng, iridi và platin dùng ở LED hữu cơ).[262]
Hạt nhân
[sửa | sửa mã nguồn]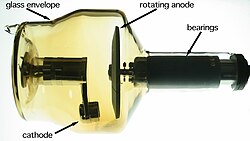
Kim loại nặng với số hiệu nguyên tử lớn có một vài ứng dụng thích hợp trong chụp ảnh y khoa, hiển vi điện tử và khoa học hạt nhân. Trong chụp ảnh y khoa, các kim loại nặng như cobalt hay wolfram là thành phần tạo nên vật liệu anode trong đèn phát tia X.[266] Trong hiển vi điện tử, kim loại nặng như chì, vàng, paladi, platin hoặc urani được dùng để tạo nên lớp phủ dẫn điện và đưa chùm electron vào mẫu vật sinh học qua nhuộm, nhuộm âm tính hoặc lắng đọng chân không.[267] Trong khoa học hạt nhân, hạt nhân của các kim loại nặng như chromi, sắt hoặc kẽm đôi lúc được bắn phá vào các hạt nhân kim loại nặng khác để hình thành nguyên tố siêu nặng;[268] kim loại nặng cũng được dùng làm bia phá vỡ để tạo neutron[269] hoặc đồng vị phóng xạ như astatin (sử dụng chì, bismuth, thori hoặc urani).[270]
Tham khảo
[sửa | sửa mã nguồn]Chú giải
[sửa | sửa mã nguồn]- ^ Các tiêu chí bao gồm, khối lượng riêng:[2] (1) trên 3,5 g/cm3; (2) trên 7 g/cm3; khối lượng nguyên tử: (3) > 22,98;[2] (4) > 40 (trừ kim loại khối s hoặc khối f);[3] (5) > 200;[4] số hiệu nguyên tử: (6) > 20; (7) 21–92;[5] đặc tính hóa học: (8) Dược điển Mỹ;[6][7][8] (9) định nghĩa dựa vào bảng tuần hoàn của Hawkes (trừ họ Lanthan và Actini);[9] và (10) phân loại hóa sinh của Nieboer và Richardson.[10] Dữ liệu khối lượng riêng của các nguyên tố chủ yếu lấy từ Emsley.[11] Khối lượng riêng của At, Fr và các nguyên tố 100–117 là giá trị dự đoán.[12] Khối lượng riêng chỉ định đối với Fm, Md, No và Lr được xác định dựa trên khối lượng nguyên tử, bán kính kim loại (ước tính),[13] và cấu trúc tinh thể xếp chặt (theo dự đoán).[14] Dữ liệu khối lượng nguyên tử lấy từ Emsley,[11] phía trong bìa sau.
- ^ Tuy nhiên, á kim bị loại trừ ra khỏi định nghĩa dựa trên bảng tuần hoàn của Hawkes do ông cho rằng "không cần thiết xác định có nên xem bán kim loại [á kim] là kim loại nặng hay không."[9]
- ^ Thí nghiệm này không cụ thể đối với một kim loại nhất định nào nhưng được cho là ít nhất có khả năng giúp nhận diện các nguyên tố Mo, Cu, Ag, Cd, Hg, Sn, Pb, As, Sb và Bi.[7] Trong mọi trường hợp, khi thí nghiệm dùng hydro sulfide làm thuốc thử thì không thể nhận diện được Th, Ti, Zr, Nb, Ta hoặc Cr.[8]
- ^ Các kim loại chuyển tiếp và hậu chuyển tiếp vốn không thường tạo phức chất có màu là Sc và Y ở nhóm 3;[21] Ag ở nhóm 11;[22] Zn và Cd ở nhóm 12;[21][23] và các kim loại nhóm 13–16.[24]
- ^ Các hợp chất sulfide và hydroxide của nguyên tố họ Lanthan (Ln) đều không tan;[25] hydroxide có thể thu được từ dung dịch muối Ln dưới dạng kết tủa sệt có màu;[26] và các phức chất Ln khá giống màu với ion nước tương ứng (đa số trong đó có màu).[27] Hợp chất sulfide của nguyên tố họ Actini (An) có thể tan hoặc không tan tùy theo tác giả. Urani monosulfide hóa trị II không bị nước sôi ăn mòn.[28] Ion actinide hóa trị III có đặc tính hóa học tương tự với ion lanthanide hóa trị III nên các hợp chất sulfide nêu trên có thể không tan, nhưng hiện tượng này không được nêu rõ ràng.[29] Các muối sulfide hóa trị III của An bị phân hủy[30] nhưng Edelstein và cộng sự cho rằng chúng tan[31] trong khi Haynes cho rằng thori(IV) sulfide không tan.[32] Ở thời kỳ đầu trong lịch sử phản ứng phân hạch, người ta đã ghi nhận rằng kết tủa bằng hydro sulfide là một phương pháp đạt hiệu quả "đáng kể" trong việc phân lập và nhận diện các nguyên tố siêu urani trong dung dịch.[33] Tương tự, Deschlag viết rằng các nguyên tố sau urani được cho là sẽ có muối sulfide tương ứng không tan, tương đồng với kim loại chuyển tiếp thuộc hàng 3. Nhưng ông lưu ý thêm các nguyên tố sau actini được phát hiện có tính chất khác với kim loại chuyển tiếp và khẳng định chúng không tạo thành muối sulfide không tan.[34] Tuy nhiên, hydroxide của An lại không tan[31] và có thể kết tủa từ dung dịch muối của chúng.[35] Cuối cùng, nhiều phức chất An có màu "đậm và sặc sỡ".[36]
- ^ Các nguyên tố nặng hơn vốn ít nhiều được cho là á kim—Ge; As, Sb; Se, Te, Po; At—thỏa mãn phần nào trong ba phần định nghĩa của Hawkes. Tất cả đều có hợp chất sulfide không tan[35][37] nhưng chỉ có Ge, Te và Po rõ ràng là có hợp chất hydroxide không tan một cách hữu hiệu.[38] Trừ At, các kim loại trên đều thu được ở dạng kết tủa (sulfide) có màu từ dung dịch muối của chúng;[35] tương tự, astatin cũng kết tủa khỏi dung dịch nhờ hydro sulfide, nhưng do người ta vẫn chưa thể tổng hợp At với lượng đủ đến mức quan sát được nên chưa rõ màu của kết tủa là gì.[37][39] Do là các nguyên tố khối p nên phức chất của chúng thường không màu.[40]
- ^ Thuật ngữ loại A và loại B tương đồng với thuật ngữ "acid cứng" và "base mềm" đôi khi được dùng để chỉ đặc tính của ion kim loại trong môi trường vô cơ.[42]
- ^ Be và Al là ngoại lệ đối với xu hướng chung nói trên. Hai nguyên tố này có giá trị độ âm điện cao hơn một chút.[43] Vì tương đối nhỏ nên các ion +2 hoặc +3 của chúng có mật độ điện tích cao, làm phân cực các đám mây electron lân cận. Kết quả cuối cùng là các hợp chất Be và Al mang đặc trưng cộng hóa trị đáng kể.[44]
- ^ Nếu Gmelin dùng hệ đo lường của Anh thì ông có thể đã chọn 300 lb/ft3 làm ngưỡng phân biệt kim loại nhẹ/nặng và khi đó seleni (khối lượng riêng 300,27 lb/ft3) sẽ đủ chuẩn làm kim loại nặng, trong khi 5 g/cm3 = 312,14 lb/ft3.
- ^ Chì, một chất độc tích lũy, có mật độ phân bố cao do nó được ứng dụng rộng rãi trong lịch sử, đồng thời lượng chì mà con người thải ra môi trường là rất đáng kể.[79]
- ^ Hàm lượng thiếc theo Haynes là dưới 17 mg[80]
- ^ Hàm lượng nickel theo Iyengar là 5 mg;[81] còn Haynes là 10 mg[80]
- ^ Bao gồm 45 kim loại nặng với hàm lượng nhỏ hơn 10 mg, trong đó có As (7 mg), Mo (5), Co (1,5) và Cr (1,4)[82]
- ^ Ở đây, trong các nguyên tố vốn thường được công nhận là á kim, B và Si được xem là phi kim; Ge, As, Sb và Te là kim loại nặng.
- ^ Ni, Cu, Zn, Se, Ag và Sb xuất hiện trong danh sách chất ô nhiễm độc hại của chính phủ Mỹ;[111] Mn, Co và Sn được liệt kê trong danh mục chất ô nhiễm quốc gia của chính phủ Australia.[112]
- ^ Wolfram cũng có thể là một kim loại nặng độc hại khác.[113]
- ^ Seleni có độc tính mạnh nhất trong các kim loại nặng thiết yếu đối với động vật có vú.[117]
- ^ Các nguyên tố vết với mật độ phân bố thấp hơn rất nhiều so với ngưỡng một phần nghìn tỷ của Ra và Pa (cụ thể là Tc, Pm, Po, At, Ac, Np và Pu) đều không xuất hiện trong bảng. Dữ liệu về độ phong phú lấy từ Lide[129] và Emsley;[130] thông tin về dạng tồn tại của nguyên tố được lấy từ McQueen.[131]
- ^ Trong một số trường hợp, chẳng hạn như khi có tia gamma năng lượng lớn hoặc trong một môi trường giàu hydro ở nhiệt độ rất cao, hạt nhân có thể bị mất neutron hoặc nhận thêm proton dẫn đến hình thành đồng vị thiếu neutron (tương đối hiếm).[136]
- ^ Sự thổi bay vật chất khi hai sao neutron va chạm với nhau được cho là do tương tác của lực thủy triều giữa chúng, khả năng phá hủy lớp vỏ và sự gia tăng nhiệt độ một cách đột ngột (đó cũng là những gì xảy ra nếu bạn nhấn ga ô tô khi động cơ đang nguội).[139]
- ^ Sắt, cobalt, nickel, germani và thiếc cũng là các nguyên tố ưa sắt khi xét trên toàn bộ Trái Đất.[131]
- ^ Nhiệt thoát ra từ lõi trong (rắn) được tin là giúp cho lõi ngoài, vốn được làm bằng hợp kim sắt dạng lỏng, chuyển động. Chuyển động của chất lỏng này tạo ra dòng điện và làm sinh ra từ trường.[150]
- ^ Các kim loại nặng không tồn tại trong tự nhiên ở lượng đủ lớn để khai thác về mặt kinh tế (Tc, Pm, Po, At, Ac, Np và Pu) được sản xuất qua biến đổi hạt nhân.[152] Đây cũng là phương pháp được áp dụng để điều chế kim loại nặng từ americi trở đi.[153]
- ^ Muối sulfide của kim loại nhóm 1 và 2 cùng với nhôm bị nước thủy phân;[168] scandi,[169] yttri[170] và titani sulfide[171] đều không tan.
- ^ Ví dụ, hydroxide của kali, rubidi và caesi có độ tan vượt mức 100 gam trên 100 gam nước[173] trong khi hydroxide của nhôm (0,0001)[174] và scandi (<0,000 000 15 gam)[175] được xem là không tan.
- ^ Beryli có nhiệt độ nóng chảy được cho là "cao", ở mức 1560 K; scandi và titani nóng chảy tại 1814 và 1941 K.[180]
- ^ Kẽm là một kim loại mềm với độ cứng trên thang Mohs là 2,5;[181] cadmi và chì có độ cứng thấp hơn, lần lượt là 2,0 và 1,5.[182] Kẽm có nhiệt độ nóng chảy "thấp" ở mức 693 K; cadmi và chì nóng chảy tại 595 và 601 K.[183]
- ^ Mô hình phân loại này có áp dụng một số điều chỉnh và khái quát hóa nhất định về nội dung nhằm giữ số lượng nhóm phân loại trong tầm kiểm soát.
- ^ Lớp vỏ này phần lớn đã chuyển thành màu lục do sự hình thành một lớp màng bảo vệ với thành phần gồm antlerit Cu3(OH)4SO4, atacamit Cu4(OH)6Cl2, brochantit Cu4(OH)6SO4, đồng(I) oxide Cu2O và tenorit CuO.[216]
- ^ Đối với kim loại họ Lanthan, đây là ứng dụng duy nhất về mặt cấu trúc do chúng có khả năng phản ứng quá cao, chi phí tương đối lớn và độ bền chỉ ở mức vừa phải.[228]
- ^ Welter[230] chia các kim loại dùng để đúc tiền thành nhiều nhóm gồm kim loại quý (ví dụ như bạc, vàng, platin); kim loại nặng có độ bền cao (nickel); kim loại nặng có độ bền thấp (đồng, sắt, kẽm, thiếc và chì); kim loại nhẹ (nhôm).
- ^ Emsley[231] ước tính có khoảng 6 tấn vàng bị hao phí mỗi năm trên toàn cầu do nhẫn cưới 18 carat bị mài mòn từ từ.
- ^ Tấm chì tiếp xúc với điều kiện khắc nghiệt của môi trường khí hậu công nghiệp và ven biển vẫn sẽ tồn tại trong nhiều thế kỷ.[194]
- ^ Electron tác động vào anode bằng wolfram tạo ra tia X;[264] rheni giúp wolfram chống chịu sốc nhiệt tốt hơn;[265] molybden và than chì đóng vai trò tản nhiệt. Molybden còn có khối lượng riêng chỉ gần bằng một nửa wolfram, làm giảm trọng lượng của anode.[263]
Chú thích tham khảo
[sửa | sửa mã nguồn]- ^ Emsley 2011, tr. 288; 374
- ^ a b c d e Duffus 2002, tr. 798
- ^ a b Rand, Wells & McCarty 1995, tr. 23
- ^ a b Baldwin & Marshall 1999, tr. 267
- ^ a b Lyman 1995, tr. 452
- ^ a b The United States Pharmacopeia 1985, tr. 1189
- ^ a b Raghuram, Soma Raju & Sriramulu 2010, tr. 15
- ^ a b Thorne & Roberts 1943, tr. 534
- ^ a b c d Hawkes 1997
- ^ a b Nieboer & Richardson 1980, tr. 4
- ^ a b Emsley 2011
- ^ Hoffman, Lee & Pershina 2011, tr. 1691, 1723; Bonchev & Kamenska 1981, tr. 1182
- ^ Silva 2010, tr. 1628, 1635, 1639, 1644
- ^ Fournier 1976, tr. 243
- ^ a b c Vernon 2013, tr. 1703
- ^ Pourret, Bollinger & Hursthouse 2021
- ^ Morris 1992, tr. 1001
- ^ Gorbachev, Zamyatnin & Lbov 1980, tr. 5
- ^ a b c Duffus 2002, tr. 797
- ^ Liens 2010, tr. 1415
- ^ a b c Longo 1974, tr. 683
- ^ Tomasik & Ratajewicz 1985, tr. 433
- ^ a b Herron 2000, tr. 511
- ^ a b Nathans 1963, tr. 265
- ^ Topp 1965, tr. 106: Schweitzer & Pesterfield 2010, tr. 284
- ^ King 1995, tr. 297; Mellor 1924, tr. 628
- ^ Cotton 2006, tr. 66
- ^ Albutt & Dell 1963, tr. 1796
- ^ Wiberg 2001, tr. 1722–1723
- ^ Wiberg 2001, tr. 1724
- ^ a b Edelstein et al. 2010, tr. 1796
- ^ Haynes 2015, tr. 4–95
- ^ Weart 1983, tr. 94
- ^ Deschlag 2011, tr. 226
- ^ a b c Wulfsberg 2000, tr. 209–211
- ^ Ahrland, Liljenzin & Rydberg 1973, tr. 478
- ^ a b Korenman 1959, tr. 1368
- ^ Yang, Jolly & O'Keefe 1977, tr. 2980; Wiberg 2001, tr. 592; Kolthoff & Elving 1964, tr. 529
- ^ Close 2015, tr. 78
- ^ Parish 1977, tr. 89
- ^ a b Rainbow 1991, tr. 416
- ^ Nieboer & Richardson 1980, tr. 6–7
- ^ Lee 1996, tr. 332; 364
- ^ Clugston & Flemming 2000, tr. 294; 334, 336
- ^ Nieboer & Richardson 1980, tr. 7
- ^ Nieboer & Richardson 1980
- ^ Hübner, Astin & Herbert 2010, tr. 1511–1512
- ^ Järup & 2003, tr. 168; Rasic-Milutinovic & Jovanovic 2013, tr. 6; Wijayawardena, Megharaj & Naidu 2016, tr. 176
- ^ Duffus 2002, tr. 794–795; 800
- ^ Emsley 2011, tr. 480
- ^ USEPA 1988, tr. 1; Uden 2005, tr. 347–348; De Zuane 1997, tr. 93; Dev 2008, tr. 2–3
- ^ a b Ikehata et al. 2015, tr. 143
- ^ Emsley 2011, tr. 71
- ^ Emsley 2011, tr. 30
- ^ a b Podsiki 2008, tr. 1
- ^ Emsley 2011, tr. 106
- ^ Emsley 2011, tr. 62
- ^ Chakhmouradian, Smith & Kynicky 2015, tr. 456–457
- ^ Cotton 1997, tr. ix; Ryan 2012, tr. 369
- ^ Hermann, Hoffmann & Ashcroft 2013, tr. 11604-1
- ^ Emsley 2011, tr. 75
- ^ Gribbon 2016, tr. x
- ^ Emsley 2011, tr. 428–429; 414; Wiberg 2001, tr. 527; Emsley 2011, tr. 437; 21–22; 346–347; 408–409
- ^ Raymond 1984, tr. 8–9
- ^ Chambers 1743: "That which distinguishes metals from all other bodies ... is their heaviness ..." [Cái để phân biệt kim loại với mọi vật khác ... là độ nặng của chúng ...]
- ^ Oxford English Dictionary 1989; Gordh & Headrick 2003, tr. 753
- ^ Goldsmith 1982, tr. 526
- ^ Habashi 2009, tr. 31
- ^ Gmelin 1849, tr. 2
- ^ Magee 1969, tr. 14
- ^ Ridpath 2012, tr. 208
- ^ Duffus 2002, tr. 794
- ^ Leeper 1978, tr. ix
- ^ Housecroft 2008, tr. 802
- ^ Shaw, Sahu & Mishra 1999, tr. 89; Martin & Coughtrey 1982, tr. 2–3
- ^ Hübner, Astin & Herbert 2010, tr. 1513
- ^ a b The Minerals, Metals and Materials Society 2016
- ^ Emsley 2011, tr. 35; passim
- ^ Emsley 2011, tr. 280, 286; Baird & Cann 2012, tr. 549, 551
- ^ a b Haynes 2015, tr. 7–48
- ^ Iyengar 1998, tr. 553
- ^ Emsley 2011, tr. 47; 331; 138; 133; passim
- ^ Nieboer & Richardson 1978, tr. 2
- ^ Emsley 2011, tr. 604; 31; 133; 358; 47; 475
- ^ Valkovic 1990, tr. 214, 218
- ^ Emsley 2011, tr. 331; 89; 552
- ^ Emsley 2011, tr. 571
- ^ Emsley 2011, tr. 24; passim
- ^ Venugopal & Luckey 1978, tr. 307
- ^ Emsley 2011, tr. 192; 197; 240; 120, 166, 188, 224, 269, 299, 423, 464, 549, 614; 559
- ^ Duffus 2002, tr. 794; 799
- ^ Baird & Cann 2012, tr. 519
- ^ Kozin & Hansen 2013, tr. 80
- ^ Baird & Cann 2012, tr. 519–520; 567; Rusyniak et al. 2010, tr. 387
- ^ Vimercati et al. 2017, tr. 11528
- ^ Aoshima 2012, tr. 455
- ^ Clarkson 1987, tr. 59
- ^ Di Maio 2001, tr. 208
- ^ Perry & Vanderklein 1996, tr. 208
- ^ Love 1998, tr. 208
- ^ Hendrickson 2016, tr. 42
- ^ Reyes 2007, tr. 1, 20, 35–36
- ^ Emsley 2011, tr. 311
- ^ Wiberg 2001, tr. 1474, 1501
- ^ a b c d e f g h Tokar et al. 2013
- ^ Eisler 1993, tr. 3, passim
- ^ Lemly 1997, tr. 259; Ohlendorf 2003, tr. 490
- ^ State Water Control Resources Board 1987, tr. 63
- ^ Scott 1989, tr. 107–108
- ^ International Antimony Association 2016
- ^ United States Government 2014
- ^ Australian Government 2022
- ^ United States Environmental Protection Agency 2014
- ^ Ong, Tan & Cheung 1997, tr. 44
- ^ Emsley 2011, tr. 146
- ^ Emsley 2011, tr. 476
- ^ Selinger 1978, tr. 369
- ^ Cole & Stuart 2000, tr. 315
- ^ Clegg 2014
- ^ Emsley 2011, tr. 240
- ^ Emsley 2011, tr. 595
- ^ Stankovic & Stankovic 2013, tr. 154–159
- ^ Bradl 2005, tr. 15, 17–20
- ^ Harvey, Handley & Taylor 2015, tr. 12276
- ^ Howell et al. 2012; Cole et al. 2011, tr. 2589–2590
- ^ Amasawa et al. 2016, tr. 95–101
- ^ Massarani 2015
- ^ Torrice 2016
- ^ a b c Lide 2004, tr. 14–17
- ^ Emsley 2011, tr. 29; passim
- ^ a b c McQueen 2009, tr. 74
- ^ a b Cox 1997, tr. 73–89
- ^ Cox 1997, tr. 32, 63, 85
- ^ Podosek 2011, tr. 482
- ^ Padmanabhan 2001, tr. 234
- ^ Rehder 2010, tr. 32, 33
- ^ Hofmann 2002, tr. 23–24
- ^ Hadhazy 2016
- ^ Choptuik, Lehner & Pretorias 2015, tr. 383
- ^ Cox 1997, tr. 83, 91, 102–103
- ^ Berry & Mason 1959, tr. 210–211; Rankin 2011, tr. 69
- ^ Hartmann 2005, tr. 197
- ^ Yousif 2007, tr. 11–12
- ^ Berry & Mason 1959, tr. 214
- ^ Yousif 2007, tr. 11
- ^ Wiberg 2001, tr. 1511
- ^ Emsley 2011, tr. 403
- ^ Litasov & Shatskiy 2016, tr. 27
- ^ Sanders 2003; Preuss 2011
- ^ Natural Resources Canada 2015
- ^ MacKay, MacKay & Henderson 2002, tr. 203–204
- ^ Emsley 2011, tr. 525–528; 428–429; 414; 57–58; 22; 346–347; 408–409; Keller, Wolf & Shani 2012, tr. 98
- ^ Emsley 2011, tr. 32 et seq.
- ^ Emsley 2011, tr. 437
- ^ Chen & Huang 2006, tr. 208; Crundwell et al. 2011, tr. 411–413; Renner et al. 2012, tr. 332; Seymour & O'Farrelly 2012, tr. 10–12
- ^ Crundwell et al. 2011, tr. 409
- ^ International Platinum Group Metals Association n.d., tr. 3–4
- ^ McLemore 2008, tr. 44
- ^ Wiberg 2001, tr. 1277
- ^ Russell & Lee 2005, tr. 437
- ^ McCurdy 1975, tr. 186
- ^ von Zeerleder 1949, tr. 68
- ^ Chawla & Chawla 2013, tr. 55
- ^ von Gleich 2006, tr. 3
- ^ Biddle & Bush 1949, tr. 180
- ^ Magill 1992, tr. 1380
- ^ a b Gidding 1973, tr. 335–336
- ^ Wiberg 2001, tr. 520
- ^ a b Schweitzer & Pesterfield 2010, tr. 230
- ^ Macintyre 1994, tr. 334
- ^ Booth 1957, tr. 85; Haynes 2015, tr. 4–96
- ^ Schweitzer & Pesterfield 2010, tr. 230. Tuy nhiên, hai tác giả viết thêm: "Các muối sulfide của ... Ga(III) và Cr(III) thường tan và/hoặc bị phân hủy trong nước."
- ^ Sidgwick 1950, tr. 96
- ^ Ondreička, Kortus & Ginter 1971, tr. 294
- ^ Gschneidner 1975, tr. 195
- ^ Hasan 1996, tr. 251
- ^ Brady & Holum 1995, tr. 825
- ^ Cotton 2006, tr. 66; Ahrland, Liljenzin & Rydberg 1973, tr. 478
- ^ Nieboer & Richardson 1980, tr. 10
- ^ Russell & Lee 2005, tr. 158, 434, 180
- ^ Schweitzer 2003, tr. 603
- ^ Samsonov 1968, tr. 432
- ^ Russell & Lee 2005, tr. 338–339; 338; 411
- ^ Emsley 2011, tr. 260; 401
- ^ Jones 2001, tr. 3
- ^ Berea, Rodriguez-lbelo & Navarro 2016, tr. 203
- ^ Alves, Berutti & Sánchez 2012, tr. 94
- ^ Yadav, Antony & Subba Reddy 2012, tr. 231
- ^ Masters 1981, tr. 5
- ^ Wulfsberg 1987, tr. 200–201
- ^ Bryson & Hammond 2005, tr. 120 (mật độ electron cao); Frommer & Stabulas-Savage 2014, tr. 69–70 (số hiệu nguyên tử cao)
- ^ Landis, Sofield & Yu 2011, tr. 269
- ^ Prieto 2011, tr. 10; Pickering 1991, tr. 5–6, 17
- ^ a b Emsley 2011, tr. 286
- ^ Berger & Bruning 1979, tr. 173
- ^ Jackson & Summitt 2006, tr. 10, 13
- ^ Shedd 2002, tr. 80.5; Kantra 2001, tr. 10
- ^ Spolek 2007, tr. 239
- ^ White 2010, tr. 139
- ^ Dapena & Teves 1982, tr. 78
- ^ Burkett 2010, tr. 80
- ^ a b Moore & Ramamoorthy 1984, tr. 102
- ^ a b National Materials Advisory Board 1973, tr. 58
- ^ Livesey 2012, tr. 57
- ^ VanGelder 2014, tr. 354, 801
- ^ National Materials Advisory Board 1971, tr. 35–37
- ^ Frick 2000, tr. 342
- ^ Rockhoff 2012, tr. 314
- ^ Russell & Lee 2005, tr. 16, 96
- ^ Morstein 2005, tr. 129
- ^ Russell & Lee 2005, tr. 218–219
- ^ Lach et al. 2015; Di Maio 2016, tr. 154
- ^ Preschel 2005; Guandalini et al. 2011, tr. 488
- ^ Scoullos et al. 2001, tr. 315; Ariel, Barta & Brandon 1973, tr. 126
- ^ Wingerson 1986, tr. 35
- ^ Matyi & Baboian 1986, tr. 299; Livingston 1991, tr. 1401, 1407
- ^ Casey 1993, tr. 156
- ^ a b c Bradl 2005, tr. 25
- ^ Kumar, Srivastava & Srivastava 1994, tr. 259
- ^ Nzierżanowski & Gawroński 2012, tr. 42
- ^ Pacheco-Torgal, Jalali & Fucic 2012, tr. 283–294; 297–333
- ^ Venner et al. 2004, tr. 124
- ^ Technical Publications 1958, tr. 235: "Here is a rugged hard metal cutter ... for cutting ... through ... padlocks, steel grilles and other heavy metals." [Đây là một máy cắt kim loại cứng chắc chắn ... để cắt ... xuyên qua ... khóa móc, lưới thép và các kim loại nặng khác.]
- ^ Naja & Volesky 2009, tr. 41
- ^ Department of the Navy 2009, tr. 3.3–13
- ^ Rebhandl et al. 2007, tr. 1729
- ^ Greenberg & Patterson 2008, tr. 239
- ^ Russell & Lee 2005, tr. 437, 441
- ^ Roe & Roe 1992
- ^ Welter 1976, tr. 4
- ^ Emsley 2011, tr. 208
- ^ Emsley 2011, tr. 206
- ^ Guney & Zagury 2012, tr. 1238; Cui et al. 2015, tr. 77
- ^ Brepohl & McCreight 2001, tr. 15
- ^ Russell & Lee 2005, tr. 337, 404, 411
- ^ Emsley 2011, tr. 141; 286
- ^ Emsley 2011, tr. 625
- ^ Emsley 2011, tr. 555, 557
- ^ Emsley 2011, tr. 531
- ^ Emsley 2011, tr. 123
- ^ Weber & Rutula 2001, tr. 415
- ^ Dunn 2009; Bonetti et al. 2009, tr. 1, 84, 201
- ^ Desoize 2004, tr. 1529
- ^ Atlas 1986, tr. 359; Lima et al. 2013, tr. 1
- ^ Volesky 1990, tr. 174
- ^ Nakbanpote, Meesungnoen & Prasad 2016, tr. 180
- ^ Emsley 2011, tr. 447; 74; 384; 123
- ^ Elliott 1946, tr. 11; Warth 1956, tr. 571
- ^ McColm 1994, tr. 215
- ^ Emsley 2011, tr. 135; 313; 141; 495; 626; 479; 630; 334; 495; 556; 424; 339; 169; 571; 252; 205; 286; 599
- ^ Everts 2016
- ^ Emsley 2011, tr. 450
- ^ Emsley 2011, tr. 334
- ^ Emsley 2011, tr. 459
- ^ Moselle 2004, tr. 409–410
- ^ Russell & Lee 2005, tr. 323
- ^ Emsley 2011, tr. 212
- ^ Tretkoff 2006
- ^ Emsley 2011, tr. 428; 276; 326–327
- ^ Emsley 2011, tr. 73; 141; 141; 141; 355; 73; 424; 340; 189; 189
- ^ Emsley 2011, tr. 192; 242; 194
- ^ Baranoff 2015, tr. 80; Wong et al. 2015, tr. 6535
- ^ a b Ball, Moore & Turner 2008, tr. 177
- ^ Ball, Moore & Turner 2008, tr. 248–249, 255
- ^ Russell & Lee 2005, tr. 238
- ^ Tisza 2001, tr. 73
- ^ Chandler & Roberson 2009, tr. 47, 367–369, 373; Ismail, Khulbe & Matsuura 2015, tr. 302
- ^ Ebbing & Gammon 2017, tr. 695
- ^ Pan & Dai 2015, tr. 69
- ^ Brown 1987, tr. 48
Thư mục
[sửa | sửa mã nguồn]- Ahrland, S.; Liljenzin, J. O.; Rydberg, J. (1973). “Solution chemistry”. Trong Bailar, J. C.; Trotman-Dickenson, A. F. (biên tập). Comprehensive Inorganic Chemistry. Volume 5: The Actinides. Oxford: Pergamon Press. tr. 465–635.
- Albutt, M.; Dell, R. (1963). The nitrites and sulphides of uranium, thorium and plutonium: A review of present knowledge. Harwell, Berkshire: UK Atomic Energy Authority Research Group.
- Alves, A. K.; Berutti, F. A.; Sánchez, F. A. L. (2012). “Nanomaterials and catalysis”. Trong Bergmann, C. P.; de Andrade, M. J. (biên tập). Nanonstructured Materials for Engineering Applications. Berlin: Springer-Verlag. ISBN 978-3-642-19130-5.
- Amasawa, E.; Yi Teah, H.; Yu Ting Khew, J.; Ikeda, I.; Onuki, M. (2016). “Drawing Lessons from the Minamata Incident for the General Public: Exercise on Resilience, Minamata Unit AY2014”. Trong Esteban, M.; Akiyama, T.; Chen, C.; Ikea, I.; Mino, T. (biên tập). Sustainability Science: Field Methods and Exercises. Springer International. tr. 93–116. doi:10.1007/978-3-319-32930-7_5. ISBN 978-3-319-32929-1.
- Aoshima, K. (2012). “Itai-itai disease: cadmium-induced renal tubular osteomalacia”. Nihon Eiseigaku Zasshi. Japanese Journal of Hygiene. 67 (4): 455–463. doi:10.1265/jjh.67.455. ISSN 1882-6482. PMID 23095355.
- Ariel, E.; Barta, J.; Brandon, D. (1973). “Preparation and properties of heavy metals”. Powder Metallurgy International. 5 (3): 126–129.
- Atlas, R. M. (1986). Basic and Practical Microbiology. New York: Macmillan Publishing Company. ISBN 978-0-02-304350-5.
- Baird, C.; Cann, M. (2012). Environmental Chemistry (ấn bản thứ 5). New York: W. H. Freeman and Company. ISBN 978-1-4292-7704-4.
- Baldwin, D. R.; Marshall, W. J. (1999). “Heavy metal poisoning and its laboratory investigation”. Annals of Clinical Biochemistry. 36 (3): 267–300. doi:10.1177/000456329903600301.
- Ball, J. L.; Moore, A. D.; Turner, S. (2008). Ball and Moore's Essential Physics for Radiographers (ấn bản thứ 4). Chichester: Blackwell Publishing. ISBN 978-1-4051-6101-5.
- Ban cố vấn vật liệu quốc gia Hoa Kỳ (1971). Trends in the Use of Depleted Uranium. Washington DC: Viện Hàn lâm Khoa học Quốc gia – Viện Hàn lâm Kỹ thuật Quốc gia.
- Ban cố vấn vật liệu quốc gia Hoa Kỳ (1973). Trends in Usage of Tungsten. Washington DC: Viện Hàn lâm Khoa học Quốc gia – Viện Hàn lâm Kỹ thuật Quốc gia.
- Bánfalvi, G. (2011). “Heavy metals, trace elements and their cellular effects”. Trong Bánfalvi, G. (biên tập). Cellular Effects of Heavy Metals. Dordrecht: Springer. tr. 3–28. ISBN 978-94-007-0427-5.
- Baranoff, E. (2015). “First-row transition metal complexes for the conversion of light into electricity and electricity into light”. Trong Wong, W-Y (biên tập). Organometallics and Related Molecules for Energy Conversion. Heidelberg: Springer. tr. 61–90. ISBN 978-3-662-46053-5.
- Berea, E.; Rodriguez-lbelo, M.; Navarro, J. A. R. (2016). “Platinum Group Metal—Organic frameworks”. Trong Kaskel, S. (biên tập). The Chemistry of Metal-Organic Frameworks: Synthesis, Characterisation, and Applications. 2. Wiley-VCH Weinheim. tr. 203–230. ISBN 978-3-527-33874-0.
- Berger, A. J.; Bruning, N. (1979). Lady Luck's Companion: How to Play... How to Enjoy... How to Bet... How to Win. New York: Harper & Row. ISBN 978-0-06-014696-2.
- Berry, L. G.; Mason, B. (1959). Mineralogy: Concepts, Descriptions, Determinations. San Francisco: W. H. Freeman and Company.
- Biddle, H. C.; Bush, G. L. (1949). Chemistry Today. Chicago: Rand McNally.
- Bộ Hải quân Hoa Kỳ (2009). “Gulf of Alaska Navy Training Activities: Draft Environmental Impact Statement/Overseas Environmental Impact Statement” (PDF). Chính phủ Mỹ. Bản gốc (PDF) lưu trữ ngày 21 tháng 8 năm 2016. Truy cập ngày 12 tháng 8 năm 2022.
- Bonchev, D.; Kamenska, V. (1981). “Predicting the properties of the 113–120 transactinide elements”. The Journal of Physical Chemistry. 85 (9): 1177–1186. doi:10.1021/j150609a021.
- Bonetti, A.; Leone, R.; Muggia, F.; Howell, S. B. biên tập (2009). Platinum and Other Heavy Metal Compounds in Cancer Chemotherapy: Molecular Mechanisms and Clinical Applications. New York: Humana Press. ISBN 978-1-60327-458-6.
- Booth, H. S. (1957). Inorganic Syntheses. 5. New York: McGraw-Hill.
- Bradl, H. E. (2005). “Sources and origins of heavy metals”. Trong Bradl, H. E. (biên tập). Heavy Metals in the Environment: Origin, Interaction and Remediation. Amsterdam: Elsevier. ISBN 978-0-12-088381-3.
- Brady, J. E.; Holum, J. R. (1995). Chemistry: The Study of Matter and its Changes (ấn bản thứ 2). New York: John Wiley & Sons. ISBN 978-0-471-10042-3.
- Brepohl, E.; McCreight, T. biên tập (2001). The Theory and Practice of Goldsmithing. Lewton-Brain, C. biên dịch. Portland, Maine: Brynmorgen Press. ISBN 978-0-9615984-9-5.
- Brown, I. (1987). “Astatine: Its organonuclear chemistry and biomedical applications”. Trong Emeléus, H. J.; Sharpe, A. G. (biên tập). Advances in Inorganic Chemistry. 31. Orlando: Academic Press. tr. 43–88. ISBN 978-0-12-023631-2.
- Bryson, R. M.; Hammond, C. (2005). “Generic methodologies for nanotechnology: Characterisation”. Trong Kelsall, R.; Hamley, I. W.; Geoghegan, M. (biên tập). Nanoscale Science and Technology. Chichester: John Wiley & Sons. tr. 56–129. ISBN 978-0-470-85086-2.
- Burkett, B. (2010). Sport Mechanics for Coaches (ấn bản thứ 3). Champaign, Illinois: Human Kinetics. ISBN 978-0-7360-8359-1.
- Casey, C. (1993). “Restructuring work: New work and new workers in post-industrial production”. Trong Coulter, R. P.; Goodson, I. F. (biên tập). Rethinking Vocationalism: Whose Work/life is it?. Toronto: Our Schools/Our Selves Education Foundation. ISBN 978-0-921908-15-9.
- Chakhmouradian, A.R.; Smith, M. P.; Kynicky, J. (tháng 1 năm 2015). “From "strategic" tungsten to "green" neodymium: A century of critical metals at a glance”. Ore Geology Reviews. 64: 455–458. doi:10.1016/j.oregeorev.2014.06.008.
- Chambers, E. (1743). “Metal”. Cyclopedia: Or an Universal Dictionary of Arts and Sciences (etc.). 2. London: D. Midwinter.
- Chandler, D. E.; Roberson, R. W. (2009). Bioimaging: Current Concepts in Light & Electron Microscopy. Boston: Jones & Bartlett Publishers. ISBN 978-0-7637-3874-7.
- Chawla, N.; Chawla, K. K. (2013). Metal matrix composites (ấn bản thứ 2). New York: Springer Science+Business Media. ISBN 978-1-4614-9547-5.
- Chen, J.; Huang, K. (2006). “A new technique for extraction of platinum group metals by pressure cyanidation”. Hydrometallurgy. 82 (3–4): 164–171. doi:10.1016/j.hydromet.2006.03.041.
- Chính phủ Australia (2022). “National Pollutant Inventory”. Bộ Môi trường và Năng lượng. Lưu trữ bản gốc ngày 4 tháng 10 năm 2022. Truy cập ngày 9 tháng 10 năm 2022.
- Chính phủ Mỹ (2014). “Toxic Pollutant List”. Code of Federal Regulations, 40 CFR 401.15. Bản gốc lưu trữ ngày 22 tháng 10 năm 2015. Truy cập ngày 12 tháng 8 năm 2022.
- Choptuik, M. W.; Lehner, L.; Pretorias, F. (2015). “Probing strong-field gravity through numerical simulation”. Trong Ashtekar, A.; Berger, B. K.; Isenberg, J.; MacCallum, M. (biên tập). General Relativity and Gravitation: A Centennial Perspective. Cambridge: Cambridge University Press. ISBN 978-1-107-03731-1.
- Clarkson, T. W. (tháng 11 năm 1987). “Metal toxicity in the central nervous system”. Environmental Health Perspectives. 75: 59–64. doi:10.1289/ehp.877559. ISSN 0091-6765. PMC 1474439. PMID 3319566.
- Clegg, B. (2014). “Osmium tetroxide”. Chemistry World. Lưu trữ bản gốc ngày 15 tháng 9 năm 2016. Truy cập ngày 12 tháng 8 năm 2022.
- Close, F. (2015). Nuclear Physics: A Very Short Introduction. Oxford: Oxford University Press. ISBN 978-0-19-871863-5.
- Clugston, M.; Flemming, R. (2000). Advanced Chemistry. Oxford: Oxford University Press. ISBN 978-0-19-914633-8.
- Cole, M.; Lindeque, P.; Halsband, C.; Galloway, T. S. (2011). “Microplastics as contaminants in the marine environment: A review” (PDF). Marine Pollution Bulletin. 62 (12): 2588–2597. doi:10.1016/j.marpolbul.2011.09.025.
- Cole, S. E.; Stuart, K. R. (2000). “Nuclear and cortical histology for brightfield microscopy”. Trong Asai, D. J.; Forney, J. D. (biên tập). Methods in Cell Biology. 62. San Diego: Academic Press. tr. 313–322. ISBN 978-0-12-544164-3.
- Cotton, S. A. (1997). Chemistry of Precious Metals. London: Blackie Academic & Professional. ISBN 978-94-010-7154-3.
- Cotton, S. (2006). Lanthanide and Actinide Chemistry. Chichester: John Wiley & Sons. ISBN 978-0-470-01005-1. (tái bản có chỉnh lý 2007)
- Cox, P. A. (1997). The elements: Their Origin, Abundance and Distribution. Oxford: Oxford University Press. ISBN 978-0-19-855298-7.
- Cơ quan Bảo vệ Môi trường Hoa Kỳ (1988). Ambient Aquatic Life Water Quality Criteria for Antimony (III). Washington: Phòng Nghiên cứu và Phát triển, Phòng Thí nghiệm Nghiên cứu Môi trường. (bản thảo)
- Cơ quan Bảo vệ Môi trường Hoa Kỳ (2014). “Technical Fact Sheet–Tungsten” (PDF). Bản gốc (PDF) lưu trữ ngày 15 tháng 10 năm 2015. Truy cập ngày 9 tháng 8 năm 2022.
- Crundwell, F. K.; Moats, M. S.; Ramachandran, V.; Robinson, T. G.; Davenport, W. G. (2011). Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals. Kidlington, Oxford: Elsevier. ISBN 978-0-08-096809-4.
- Cui, X-Y.; Li, S-W.; Zhang, S-J.; Fan, Y-Y.; Ma, L. Q. (2015). “Toxic metals in children's toys and jewelry: Coupling bioaccessibility with risk assessment” (PDF). Environmental Pollution. 200: 77–84. doi:10.1016/j.envpol.2015.01.035. Bản gốc (PDF) lưu trữ ngày 24 tháng 8 năm 2022. Truy cập ngày 24 tháng 8 năm 2022.
- Dapena, J.; Teves, M. A. (1982). “Influence of the diameter of the hammer head on the distance of a hammer throw”. Research Quarterly for Exercise and Sport. 53 (1): 78–81. doi:10.1080/02701367.1982.10605229.
- De Zuane, J. (1997). Handbook of Drinking Water Quality (ấn bản thứ 2). New York: John Wiley & Sons. ISBN 978-0-471-28789-6.
- Deschlag, J. O. (2011). “Nuclear fission”. Trong Vértes, A.; Nagy, S.; Klencsár, Z.; Lovas, R. G.; Rösch, F. (biên tập). Handbook of Nuclear Chemistry (ấn bản thứ 2). Dordrecht: Springer Science+Business Media. tr. 223–280. ISBN 978-1-4419-0719-6.
- Desoize, B. (2004). “Metals and metal compounds in cancer treatment” (PDF). Anticancer Research. 24 (3a): 1529–1544. PMID 15274320.
- Dev, N. (2008). Modelling Selenium Fate and Transport in Great Salt Lake Wetlands. Luận án Tiến sĩ Đại học Utah. Ann Arbor, Michigan: ProQuest. ISBN 978-0-549-86542-1.
- Di Maio, V. J. M. (2001). Forensic Pathology (ấn bản thứ 2). Boca Raton: CRC Press. ISBN 0-8493-0072-X.
- Di Maio, V. J. M. (2016). Gunshot Wounds: Practical Aspects of Firearms, Ballistics, and Forensic Techniques (ấn bản thứ 3). Boca Raton: CRC Press. ISBN 978-1-4987-2570-5.
- Duffus, J. H. (2002). “'Heavy metals'—A meaningless term?” (PDF). Pure and Applied Chemistry. 74 (5): 793–807. doi:10.1351/pac200274050793.
- Dunn, P. (2009). “Unusual metals could forge new cancer drugs”. Đại học Warwick. Lưu trữ bản gốc ngày 4 tháng 4 năm 2016. Truy cập ngày 13 tháng 8 năm 2022.
- Ebbing, D. D.; Gammon, S. D. (2017). General Chemistry (ấn bản thứ 11). Boston: Cengage Learning. ISBN 978-1-305-58034-3.
- Edelstein, N. M.; Fuger, J.; Katz, J. L.; Morss, L. R. (2010). “Summary and comparison of properties of the actinde and transactinide elements”. Trong Morss, L. R.; Edelstein, N. M.; Fuger, J. (biên tập). The Chemistry of the Actinide and Transactinide Elements. 1–6 (ấn bản thứ 4). Dordrecht: Springer. tr. 1753–1835. ISBN 978-94-007-0210-3.
- Eisler, R. (1993). “Zinc Hazards to Fish, Wildlife, and Invertebrates: A Synoptic Review” (PDF). Biological Report 10. Laurel, Maryland: Bộ Nội vụ Hoa Kỳ. Lưu trữ (PDF) bản gốc ngày 30 tháng 9 năm 2015. Truy cập ngày 13 tháng 8 năm 2022.
- Elliott, S. B. (1946). The Alkaline-earth and Heavy-metal Soaps. New York: Reinhold Publishing Corporation.
- Emsley, J. (2011). Nature's Building Blocks, New Edition. Oxford: Oxford University Press. ISBN 978-0-19-960563-7.
- Everts, S. (2016). “What chemicals are in your tattoo”. Chemical & Engineering News. 94 (33): 24–26. Bản gốc lưu trữ ngày 12 tháng 8 năm 2016. Truy cập ngày 10 tháng 8 năm 2022.
- Fournier, J. (1976). “Bonding and the electronic structure of the actinide metals”. Journal of Physics and Chemistry of Solids. 37 (2): 235–244. doi:10.1016/0022-3697(76)90167-0.
- Frick, J. P. biên tập (2000). Woldman's Engineering Alloys (ấn bản thứ 9). Materials Park, Ohio: ASM International. ISBN 978-0-87170-691-1.
- Frommer, H. H.; Stabulas-Savage, J. J. (2014). Radiology for the Dental Professional (ấn bản thứ 9). St. Louis, Missouri: Mosby Inc. ISBN 978-0-323-06401-9.
- Gidding, J. C. (1973). Chemistry, Man, and Environmental Change: An Integrated Approach. New York: Canfield Press. ISBN 978-0-06-382790-5.
- Gmelin, L. (1849). Hand-book of chemistry. Volume III: Metals. Watts, H. biên dịch. London: Cavendish Society.
- Goldsmith, R. H. (1982). “Metalloids”. Journal of Chemical Education. 59 (6): 526–527. doi:10.1021/ed059p526.
- Gorbachev, V. M.; Zamyatnin, Y. S.; Lbov, A. A. (1980). Nuclear Reactions in Heavy Elements: A Data Handbook. Oxford: Pergamon Press. ISBN 978-0-08-023595-0.
- Gordh, G.; Headrick, D. (2003). A Dictionary of Entomology. Wallingford: CABI Publishing. ISBN 978-0-85199-655-4.
- Greenberg, B. R.; Patterson, D. (2008). Art in Chemistry; Chemistry in Art (ấn bản thứ 2). Westport, Connecticut: Teachers Ideas Press. ISBN 978-1-59158-309-7.
- Gribbon, J. (2016). 13.8: The Quest to Find the True Age of the Universe and the Theory of Everything. New Haven: Yale University Press. ISBN 978-0-300-21827-5.
- Gschneidner, K. A. (1975). “Inorganic compounds”. Trong Horowitz, C. T. (biên tập). Scandium: Its Occurrence, Chemistry, Physics, Metallurgy, Biology and Technology. London: Academic Press. tr. 152–251. ISBN 978-0-12-355850-3.
- Guandalini, G. S.; Zhang, L.; Fornero, E.; Centeno, J. A.; Mokashi, V. P.; Ortiz, P. A.; Stockelman, M. D.; Osterburg, A. R.; Chapman, G. G. (2011). “Tissue distribution of tungsten in mice following oral exposure to sodium tungstate”. Chemical Research in Toxicology. 24 (4): 488–493. doi:10.1021/tx200011k.
- Guney, M.; Zagury, G. J. (2012). “Heavy metals in toys and low-cost jewelry: Critical review of U.S. and Canadian legislations and recommendations for testing”. Environmental Science & Technology. 48: 1238–1246. doi:10.1021/es4036122.
- Habashi, F. (2009). “Gmelin and his Handbuch” (PDF). Bulletin for the History of Chemistry. 34 (1): 30–31.
- Hadhazy, A. (10 tháng 5 năm 2016). “Galactic 'gold mine' explains the origin of nature's heaviest elements”. Science Spotlights. Lưu trữ bản gốc ngày 24 tháng 5 năm 2016. Truy cập ngày 13 tháng 8 năm 2022.
- Hartmann, W. K. (2005). Moons & Planets (ấn bản thứ 5). Belmont, California: Thomson Brooks/Cole. ISBN 978-0-534-49393-6.
- Harvey, P. J.; Handley, H. K.; Taylor, M. P. (2015). “Identification of the sources of metal (lead) contamination in drinking waters in north-eastern Tasmania using lead isotopic compositions”. Environmental Science and Pollution Research. 22 (16): 12276–12288. doi:10.1007/s11356-015-4349-2. PMID 25895456.
- Hasan, S. E. (1996). Geology and Hazardous Waste Management. Upper Saddle River, New Jersey: Prentice Hall. ISBN 978-0-02-351682-5.
- Hawkes, S. J. (1997). “What is a "heavy metal"?”. Journal of Chemical Education. 74 (11): 1374. doi:10.1021/ed074p1374.
- Haynes, W. M. (2015). CRC Handbook of Chemistry and Physics (ấn bản thứ 96). Boca Raton: CRC Press. ISBN 978-1-4822-6097-7.
- Hendrickson, D. J. (2016). “Effects of early experience on brain and body”. Trong Alicata, D.; Jacobs, N. N.; Guerrero, A.; Piasecki, M. (biên tập). Problem-based Behavioural Science and Psychiatry (ấn bản thứ 2). Cham: Springer. tr. 33–54. ISBN 978-3-319-23669-8.
- Hermann, A.; Hoffmann, R.; Ashcroft, N. W. (2013). “Condensed astatine: Monatomic and metallic” (PDF). Physical Review Letters. 111: 11604-1−11604-5. doi:10.1103/PhysRevLett.111.116404. Bản gốc (PDF) lưu trữ ngày 16 tháng 3 năm 2016. Truy cập ngày 10 tháng 8 năm 2022.
- Herron, N. (2000). “Cadmium compounds”. Kirk-Othmer Encyclopedia of Chemical Technology. New York: John Wiley & Sons. tr. 507–523. ISBN 978-0-471-23896-6.
- Hiệp hội antimon quốc tế (2016). “Antimony compounds”. Bản gốc lưu trữ ngày 21 tháng 9 năm 2016. Truy cập ngày 13 tháng 8 năm 2022.
- Hiệp hội Khoáng sản, Kim loại và Vật liệu. “Light Metals Division 2016”. Bản gốc lưu trữ ngày 12 tháng 4 năm 2016. Truy cập ngày 13 tháng 8 năm 2022.
- Hiệp hội kim loại nhóm platin quốc tế (n.d.). “The Primary Production of Platinum Group Metals (PGMs)” (PDF). Lưu trữ (PDF) bản gốc ngày 4 tháng 8 năm 2016. Truy cập ngày 13 tháng 8 năm 2022.
- Hoffman, D. C.; Lee, D. M.; Pershina, V. (2011). “Transactinide elements and future elements”. Trong Morss, L. R.; Edelstein, N.; Fuger, J.; Katz, J. J. (biên tập). The Chemistry of the Actinide and Transactinide Elements. 3 (ấn bản thứ 4). Dordrecht: Springer. tr. 1652–1752. ISBN 978-94-007-0210-3.
- Hofmann, S. (2002). On Beyond Uranium: Journey to the End of the Periodic Table. London: Taylor & Francis. ISBN 978-0-415-28495-0.
- Housecroft, J. E. (2008). Inorganic Chemistry. Burlington, Massachusetts: Elsevier. ISBN 978-0-12-356786-4.
- Howell, N.; Lavers, J.; Paterson, D.; Garrett, R.; Banati, R. (2012). “Trace metal distribution in feathers from migratory, pelagic birds”. Tổ chức khoa học và công nghệ hạt nhân Australia. Bản gốc lưu trữ ngày 3 tháng 3 năm 2016. Truy cập ngày 13 tháng 8 năm 2022.
- Hübner, R.; Astin, K. B.; Herbert, R. J. H. (2010). “'Heavy metal'—time to move on from semantics to pragmatics?”. Journal of Environmental Monitoring. 12: 1511–1514. doi:10.1039/C0EM00056F.
- Ikehata, K.; Jin, Y.; Maleky, N.; Lin, A. (2015). “Heavy metal pollution in water resources in China—Occurrence and public health implications”. Trong Sharma, S. K. (biên tập). Heavy Metals in Water: Presence, Removal and Safety. Cambridge: Hội Hóa học Hoàng gia. tr. 141–167. ISBN 978-1-84973-885-9.
- Ismail, A. F.; Khulbe, K.; Matsuura, T. (2015). Gas Separation Membranes: Polymeric and Inorganic. Cham: Springer. ISBN 978-3-319-01095-3.
- IUPAC (2016). “IUPAC is naming the four new elements nihonium, moscovium, tennessine, and oganesson”. Lưu trữ bản gốc ngày 8 tháng 6 năm 2016. Truy cập ngày 13 tháng 8 năm 2022.
- Iyengar, G. V. (1998). “Reevaluation of the trace element content in Reference Man” (PDF). Radiation Physics and Chemistry. 51 (4–6): 545–560. doi:10.1016/S0969-806X(97)00202-8.[liên kết hỏng]
- Jackson, J.; Summitt, J. (2006). The Modern Guide to Golf Clubmaking: The Principles and Techniques of Component Golf Club Assembly and Alteration (ấn bản thứ 5). City of Industry, California: Hireko Trading Company. ISBN 978-0-9619413-0-7.
- Järup, L. (2003). “Hazards of heavy metal contamination”. British Medical Bulletin. 68 (1): 167–182. doi:10.1093/bmb/ldg032. Bản gốc lưu trữ ngày 24 tháng 9 năm 2013. Truy cập ngày 10 tháng 8 năm 2022.
- Jones, C. J. (2001). d- and f-Block Chemistry. Cambridge: Hội Hóa học Hoàng gia. ISBN 978-0-85404-637-9.
- Kantra, S. (tháng 4 năm 2001). “What's new”. Popular Science. 254 (4): 10.
- Keller, C.; Wolf, W.; Shani, J. (2012). “Radionuclides, 2. Radioactive elements and artificial radionuclides”. Trong Ullmann, F. (biên tập). Ullmann's Encyclopedia of Industrial Chemistry. 31. Weinheim: Wiley-VCH. tr. 89–117. doi:10.1002/14356007.o22_o15.
- King, R. B. (1995). Inorganic Chemistry of Main Group Elements. New York: Wiley-VCH. ISBN 978-1-56081-679-9.
- Kolthoff, I. M.; Elving, P. J. (1964). Treatise on Analytical Chemistry, Part II. 6. New York: Interscience Encyclopedia. ISBN 978-0-07-038685-3.
- Korenman, I. M. (1959). “Regularities in properties of thallium”. Journal of General Chemistry of the USSR. New York: Consultants Bureau. 29 (2): 1366–1390. ISSN 0022-1279. (bản dịch tiếng Anh)
- Kozin, L. F.; Hansen, S. C. (2013). Mercury Handbook: Chemistry, Applications and Environmental Impact. Cambridge: RSC Publishing. ISBN 978-1-84973-409-7.
- Kumar, R.; Srivastava, P. K.; Srivastava, S. P. (1994). “Leaching of heavy metals (Cr, Fe, and Ni) from stainless steel utensils in food simulates and food materials”. Bulletin of Environmental Contamination and Toxicology. 53 (2): 259–266. doi:10.1007/BF00192942.
- Lach, K.; Steer, B.; Gorbunov, B.; Mička, V.; Muir, R. B. (2015). “Evaluation of exposure to airborne heavy metals at gun shooting ranges”. The Annals of Occupational Hygiene. 59 (3): 307–323. doi:10.1093/annhyg/meu097.
- Landis, W.; Sofield, R.; Yu, M-H. (2011). Introduction to Environmental Toxicology: Molecular Substructures to Ecological Landscapes (ấn bản thứ 4). Boca Raton: CRC Press. ISBN 978-1-4398-0411-7.
- Lane, T. W.; Saito, M. A.; George, G. N.; Pickering, I. J.; Prince, R. C.; Morel, F. M. M. (2005). “Biochemistry: A cadmium enzyme from a marine diatom” (PDF). Nature. 435 (7038): 42. doi:10.1038/435042a.
- Lee, J. D. (1996). Concise Inorganic Chemistry (ấn bản thứ 5). Oxford: Blackwell Science. ISBN 978-0-632-05293-6.
- Leeper, G. W. (1978). Managing the Heavy Metals on the Land. New York: Marcel Dekker. ISBN 0-8247-6661-X.
- Lemly, A. D. (1997). “A teratogenic deformity index for evaluating impacts of selenium on fish populations”. Ecotoxicology and Environmental Safety. 37 (3): 259–266. doi:10.1006/eesa.1997.1554.
- Lide, D. R. biên tập (2004). CRC Handbook of Chemistry and Physics (ấn bản thứ 85). Boca Raton: CRC Press. ISBN 978-0-8493-0485-9.
- Liens, J. (2010). “Heavy metals as pollutants”. Trong Warf, B. (biên tập). Encyclopaedia of Geography. Thousand Oaks, California: Sage Publications. tr. 1415–1418. ISBN 978-1-4129-5697-0.
- Lima, E.; Guerra, R.; Lara, V.; Guzmán, A. (2013). “Gold nanoparticles as efficient antimicrobial agents for Escherichia coli and Salmonella typhi”. Chemistry Central. 7: 11. doi:10.1186/1752-153X-7-11. PMC 3556127. PMID 23331621.
- Litasov, K. D.; Shatskiy, A. F. (2016). “Composition of the Earth's core: A review”. Russian Geology and Geophysics. 57 (1): 22–46. doi:10.1016/j.rgg.2016.01.003.
- Livesey, A. (2012). Advanced Motorsport Engineering. London: Routledge. ISBN 978-0-7506-8908-3.
- Livingston, R. A. (1991). “Influence of the Environment on the Patina of the Statue of Liberty”. Environmental Science & Technology. 25 (8): 1400–1408. doi:10.1021/es00020a006.
- Longo, F. R. (1974). General Chemistry: Interaction of Matter, Energy, and Man. New York: McGraw-Hill. ISBN 978-0-07-038685-3.
- Love, M. (1998). Phasing Out Lead from Gasoline: Worldwide Experience and Policy Implications (PDF). World Bank Technical Paper. 397. Washington DC: Ngân hàng Thế giới. ISBN 0-8213-4157-X. Bản gốc (PDF) lưu trữ ngày 25 tháng 9 năm 2022. Truy cập ngày 12 tháng 8 năm 2022.
- Lyman, W. J. (1995). “Transport and transformation processes”. Trong Rand, G. M. (biên tập). Fundamentals of Aquatic Toxicology. London: Taylor & Francis. tr. 449–492. ISBN 978-1-56032-090-6.
- Macintyre, J. E. (1994). “Supplement 2”. Dictionary of inorganic compounds. Dictionary of Inorganic Compounds. 7. London: Chapman & Hall. ISBN 978-0-412-49100-9.
- MacKay, K. M.; MacKay, R. A.; Henderson, W. (2002). Introduction to Modern Inorganic Chemistry (ấn bản thứ 6). Cheltenham: Nelson Thornes. ISBN 978-0-7487-6420-4.
- Magee, R. J. (1969). Steps to Atomic Power. Melbourne: Cheshire for La Trobe University.
- Magill, F. N. I. biên tập (1992). Magill's Survey of Science. Physical Science series. 3. Pasadena: Salem Press. ISBN 978-0-89356-621-0.
- Martin, M. H.; Coughtrey, P. J. (1982). Biological Monitoring of Heavy Metal Pollution. London: Applied Science Publishers. ISBN 978-0-85334-136-9.
- Massarani, M. (tháng 11 năm 2015). “Brazilian mine disaster releases dangerous metals”. Chemistry World. Lưu trữ bản gốc ngày 21 tháng 11 năm 2015. Truy cập ngày 13 tháng 8 năm 2022.
- Masters, C. (1981). Homogenous Transition-metal Catalysis: A Gentle Art. London: Chapman and Hall. ISBN 978-0-412-22110-1.
- Matyi, R. J.; Baboian, R. (1986). “An X-ray Diffraction Analysis of the Patina of the Statue of Liberty”. Powder Diffraction. 1 (4): 299–304. doi:10.1017/S0885715600011970.
- McColm, I. J. (1994). Dictionary of Ceramic Science and Engineering (ấn bản thứ 2). New York: Springer Science+Business Media. ISBN 978-1-4419-3235-8.
- McCurdy, R. M. (1975). Qualities and quantities: Preparation for College Chemistry. New York: Harcourt Brace Jovanovich. ISBN 978-0-15-574100-3.
- McLemore, V. T. biên tập (2008). Basics of Metal Mining Influenced Water. 1. Littleton, Colorado: Society for Mining, Metallurgy, and Exploration. ISBN 978-0-87335-259-8.
- McQueen, K. G. (2009). “Regolith geochemistry”. Trong Scott, K. M.; Pain, C. F. (biên tập). Regolith Science. Collingwood, Victoria: CSIRO Publishing. ISBN 978-0-643-09396-6.
- Mellor, J. W. (1924). A comprehensive Treatise on Inorganic and Theoretical Chemistry. 5. London: Longmans, Green and Company.
- Moore, J. W.; Ramamoorthy, S. (1984). Heavy Metals in Natural Waters: Applied Monitoring and Impact Assessment. New York: Springer Verlag. ISBN 978-1-4612-9739-0.
- Morris, C. G. (1992). Academic Press Dictionary of Science and Technology. San Diego: Harcourt Brace Jovanovich. ISBN 978-0-12-200400-1.
- Morstein, J. H. (2005). “Fat Man”. Trong Croddy, E. A.; Wirtz, Y. Y. (biên tập). Weapons of Mass Destruction: An Encyclopedia of Worldwide Policy, Technology, and History. Santa Barbara, California: ABC-CLIO. ISBN 978-1-85109-495-0.
- Moselle, B. biên tập (2004). 2005 National Home Improvement Estimator. Carlsbad, California: Craftsman Book Company. ISBN 978-1-57218-150-2.
- Naja, G. M.; Volesky, B. (2009). “Toxicity and sources of Pb, Cd, Hg, Cr, As, and radionuclides”. Trong Wang, L. K.; Chen, J. P.; Hung, Y.; Shammas, N. K. (biên tập). Heavy Metals in the Environment. Boca Raton: CRC Press. ISBN 978-1-4200-7316-4.
- Nakbanpote, W.; Meesungnoen, O.; Prasad, M. N. V. (2016). “Potential of ornamental plants for phytoremediation of heavy metals and income generation”. Trong Prasad, M. N. V. (biên tập). Bioremediation and Bioeconomy. Amsterdam: Elsevier. tr. 179–218. ISBN 978-0-12-802830-8.
- Nathans, M. W. (1963). Elementary Chemistry. Englewood Cliffs, New Jersey: Prentice Hall.
- Natural Resources Canada (2015). “Generation of the Earth's magnetic field”. Lưu trữ bản gốc ngày 10 tháng 9 năm 2015. Truy cập ngày 13 tháng 8 năm 2022.
- Nieboer, E.; Richardson, D. H. S. (1978). “Lichens and 'heavy metals'”. International Lichenology Newsletter. 11 (1): 1–3.
- Nieboer, E.; Richardson, D. H. S. (1980). “The replacement of the nondescript term 'heavy metals' by a biologically and chemically significant classification of metal ions” (PDF). Environmental Pollution Series B, Chemical and Physical. 1 (1): 3–26. doi:10.1016/0143-148X(80)90017-8.
- Nzierżanowski, K.; Gawroński, S. W. (2012). “Heavy metal concentration in plants growing on the vicinity of railroad tracks: a pilot study”. Challenges of Modern Technology. 3 (1): 42–45. ISSN 2353-4419. Bản gốc lưu trữ ngày 16 tháng 9 năm 2016. Truy cập ngày 13 tháng 8 năm 2022.
- Ohlendorf, H. M. (2003). “Ecotoxicology of selenium”. Trong Hoffman, D. J.; Rattner, B. A.; Burton, G. A.; Cairns, J. (biên tập). Handbook of Ecotoxicology (ấn bản thứ 2). Boca Raton: Lewis Publishers. tr. 466–491. ISBN 978-1-56670-546-2.
- Ondreička, R.; Kortus, J.; Ginter, E. (1971). “Aluminium, its absorption, distribution, and effects on phosphorus metabolism”. Trong Skoryna, S. C.; Waldron-Edward, D. (biên tập). Intestinal Absorption of Metal Ions, Trace Elements and Radionuclides. Oxford: Pergamon Press.
- Ong, K. L.; Tan, T. H.; Cheung, W. L. (1997). “Potassium permanganate poisoning—a rare cause of fatal poisoning”. Journal of Accident & Emergency Medicine. 14 (1): 43–45. PMC 1342846.
- Oxford English Dictionary (ấn bản thứ 2). Oxford: Oxford University Press. 1989. ISBN 978-0-19-861213-1.
- Pacheco-Torgal, F.; Jalali, S.; Fucic, A. biên tập (2012). Toxicity of building materials. Oxford: Woodhead Publishing. ISBN 978-0-85709-122-2.
- Padmanabhan, T. (2001). Theoretical Astrophysics Volume 2: Stars and Stellar Systems. Cambridge: Cambridge University Press. ISBN 978-0-521-56241-6.
- Pan, W.; Dai, J. (2015). “ADS based on linear accelerators”. Trong Chao, W.; Chou, W. (biên tập). Reviews of accelerator science and technology, Volume 8: Accelerator Applications in Energy and Security. Singapore: World Scientific. tr. 55–76. ISBN 981-3108-89-4.
- Parish, R. V. (1977). The Metallic Elements. New York: Longman. ISBN 978-0-582-44278-8.
- Perry, J.; Vanderklein, E. L. (1996). Water Quality: Management of a Natural Resource. Cambridge, Massachusetts: Blackwell Science. ISBN 0-86542-469-1.
- Pickering, N. C. (1991). The Bowed String: Observations on the Design, Manufacture, Testing and Performance of Strings for Violins, Violas and Cellos. Mattituck, New York: Amereon.
- Podosek, F. A. (2011). “Noble gases”. Trong Holland, H. D.; Turekian, K. K. (biên tập). Isotope Geochemistry: From the Treatise on Geochemistry. Amsterdam: Elsevier. tr. 467–492. ISBN 978-0-08-096710-3.
- Podsiki, C. (tháng 11 năm 2008). “Heavy metals, their salts, and other compounds” (PDF). AIC News. Lưu trữ (PDF) bản gốc ngày 23 tháng 9 năm 2016. Truy cập ngày 13 tháng 8 năm 2022. (tờ in rời)
- Pourret, O.; Bollinger, J.; Hursthouse, A. (2021). “Heavy Metal: a misused term?” (PDF). Acta Geochimica. 40 (3): 466–471. doi:10.1007/s11631-021-00468-0. S2CID 232342843.
- Preschel, J. (29 tháng 7 năm 2005). “Green bullets not so eco-friendly”. CBS News. Lưu trữ bản gốc ngày 29 tháng 6 năm 2016. Truy cập ngày 13 tháng 8 năm 2022.
- Preuss, P. (17 tháng 7 năm 2011). “What keeps the Earth cooking?”. Berkeley Lab. Lưu trữ bản gốc ngày 5 tháng 9 năm 2015. Truy cập ngày 13 tháng 8 năm 2022.
- Prieto, C. (2011). The Adventures of a Cello: Revised Edition, with a New Epilogue. Austin: University of Texas Press. ISBN 978-0-292-72393-1.
- Raghuram, P.; Soma Raju, I. V.; Sriramulu, J. (2010). “Heavy metals testing in active pharmaceutical ingredients: an alternate approach”. Pharmazie. 65 (1): 15–18. doi:10.1691/ph.2010.9222.
- Rainbow, P. S. (1991). “The biology of heavy metals in the sea”. Trong Rose, J. (biên tập). Water and the Environment. Philadelphia: Gordon and Breach Science Publishers. tr. 415–432. ISBN 978-2-88124-747-7.
- Rand, G. M.; Wells, P. G.; McCarty, L. S. (1995). “Introduction to aquatic toxicology”. Trong Rand, G. M. (biên tập). Fundamentals of Aquatic Toxicology (ấn bản thứ 2). London: Taylor & Francis. tr. 3–70. ISBN 978-1-56032-090-6.
- Rankin, W. J. (2011). Minerals, Metals and Sustainability: Meeting Future Material Needs. Collingwood, Victoria: CSIRO Publishing. ISBN 978-0-643-09726-1.
- Rasic-Milutinovic, Z.; Jovanovic, D. (2013). “Toxic metals”. Trong Ferrante, M.; Oliveri Conti, G.; Rasic-Milutinovic, Z.; Jovanovic, D. (biên tập). Health Effects of Metals and Related Substances in Drinking Water. London: IWA Publishing. ISBN 978-1-68015-557-0.
- Raymond, R. (1984). Out of the Fiery Furnace: The Impact of Metals on the History of Mankind. South Melbourne: Macmillan. ISBN 978-0-333-38024-6.
- Rebhandl, W.; Milassin, A.; Brunner, L.; Steffan, I.; Benkö, T.; Hörmann, M.; Burschen, J. (2007). “In vitro study of ingested coins: Leave them or retrieve them?”. Journal of Paediatric Surgery. 42 (10): 1729–1734. doi:10.1016/j.jpedsurg.2007.05.031.
- Rehder, D. (2010). Chemistry in Space: From Interstellar Matter to the Origin of Life. Weinheim: Wiley-VCH. ISBN 978-3-527-32689-1.
- Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; Lüchow, H. M.; Tews, P.; Panster, P.; Diehl, M.; Lang, J.; Kreuzer, T.; Knödler, A.; Starz, K. A.; Dermann, K.; Rothaut, J.; Drieselmann, R.; Peter, C.; Schiele, R. (2012). “Platinum Group Metals and compounds”. Trong Ullmann, F. (biên tập). Ullmann's Encyclopedia of Industrial Chemistry. 28. Weinheim: Wiley-VCH. tr. 317–388. doi:10.1002/14356007.a21_075.
- Reyes, J. W. (2007). “Environmental Policy as Social Policy? The Impact of Childhood Lead Exposure on Crime” (PDF). Văn kiện làm việc 13097. Cục Nghiên cứu Kinh tế Quốc gia Hoa Kỳ. Lưu trữ (PDF) bản gốc ngày 19 tháng 10 năm 2020. Truy cập ngày 13 tháng 8 năm 2022.
- Ridpath, I. biên tập (2012). Oxford Dictionary of Astronomy, Revised 2nd Edition. New York: Oxford University Press. ISBN 978-0-19-960905-5.
- Rockhoff, H. (2012). America's Economic Way of War: War and the US Economy from the Spanish–American War to the Persian Gulf War. Cambridge: Cambridge University Press. ISBN 978-0-521-85940-0.
- Roe, J.; Roe, M. (1992). “World's coinage uses 24 chemical elements”. World Coinage News. 19 (4): 24–25; 19 (5): 18–19.
- Russell, A. M.; Lee, K. L. (2005). Structure–Property Relations in Nonferrous Metals. Hoboken, New Jersey: John Wiley & Sons. ISBN 978-0-471-64952-6.
- Rusyniak, D. E.; Arroyo, A.; Acciani, J.; Froberg, B.; Kao, L.; Furbee, B. (2010). “Heavy metal poisoning: Management of intoxication and antidotes”. Trong Luch, A. (biên tập). Molecular, Clinical and Environmental Toxicology. 2. Basel: Birkhäuser Verlag. tr. 365–396. ISBN 978-3-7643-8337-4.
- Ryan, J. (2012). Personal Financial Literacy (ấn bản thứ 2). Mason, Ohio: South-Western. ISBN 978-0-8400-5829-4.
- Samsonov, G. V. biên tập (1968). Handbook of the Physicochemical Properties of the Elements. New York: IFI-Plenum. ISBN 978-1-4684-6066-7.
- Sanders, R. (10 tháng 12 năm 2003). “Radioactive potassium may be major heat source in Earth's core”. UCBerkelyNews. Lưu trữ bản gốc ngày 12 tháng 12 năm 2003. Truy cập ngày 13 tháng 8 năm 2022.
- Schweitzer, P. A. (2003). Metallic materials: Physical, Mechanical, and Corrosion properties. New York: Marcel Dekker. ISBN 978-0-8247-0878-8.
- Schweitzer, G. K.; Pesterfield, L. L. (2010). The Aqueous Chemistry of the Elements. Oxford: Oxford University Press. ISBN 978-0-19-539335-4.
- Scott, R. M. (1989). Chemical Hazards in the Workplace. Boca Raton: CRC Press. ISBN 978-0-87371-134-0.
- Scoullos, M.; Vonkeman, G. H.; Thornton, I.; Makuch, Z. (2001). Mercury — Cadmium — Lead Handbook for Sustainable Heavy Metals Policy and Regulation. Dordrecht: Kluwer Academic Publishers. ISBN 978-1-4020-0224-3.
- Selinger, B. (1978). Chemistry in the Market Place (ấn bản thứ 2). Canberra: Australian National University Press. ISBN 978-0-7081-0728-7.
- Seymour, R. J.; O'Farrelly, J. (2012). “Platinum Group Metals”. Kirk-Other Encyclopaedia of Chemical Technology. New York: John Wiley & Sons. doi:10.1002/0471238961.1612012019052513.a01.pub3.
- Shaw, B. P.; Sahu, S. K.; Mishra, R. K. (1999). “Heavy metal induced oxidative damage in terrestrial plants”. Trong Prased, M. N. V. (biên tập). Heavy Metal Stress in Plants: From Biomolecules to Ecosystems. Berlin: Springer-Verlag. ISBN 978-3-540-40131-5.
- Shedd, K. B. (2002). “Tungsten”. Minerals Yearbook (PDF). United States Geological Survey.
- Sidgwick, N. V. (1950). The Chemical Elements and their Compounds. 1. London: Oxford University Press.
- Silva, R. J. (2010). “Fermium, mendelevium, nobelium, and lawrencium”. Trong Morss, L. R.; Edelstein, N.; Fuger, J. (biên tập). The Chemistry of the Actinide and Transactinide Elements. 3 (ấn bản thứ 4). Dordrecht: Springer. tr. 1621–1651. ISBN 978-94-007-0210-3.
- Spolek, G. (2007). “Design and materials in fly fishing”. Trong Subic, A. (biên tập). Materials in Sports Equipment. 2. Abington, Cambridge: Woodhead Publishing. tr. 225–247. ISBN 978-1-84569-131-8.
- Stankovic, S.; Stankovic, A. R. (2013). “Bioindicators of toxic metals”. Trong Lichtfouse, E.; Schwarzbauer, J.; Robert, D. (biên tập). Green materials for energy, products and depollution. Dordrecht: Springer. tr. 151–228. ISBN 978-94-007-6835-2.
- Technical Publications (1958). Fire Engineering. 111. tr. 235. ISSN 0015-2587.
- The United States Pharmacopeia. Sửa đổi lần thứ 21. Rockville, Maryland: Hội đồng Dược điển Mỹ. 1985. ISBN 978-0-913595-04-6.
- Thorne, P. C. L.; Roberts, E. R. (1943). Fritz Ephraim Inorganic Chemistry (ấn bản thứ 4). London: Gurney and Jackson.
- Tisza, M. (2001). Physical Metallurgy for Engineers. Materials Park, Ohio: ASM International. ISBN 978-0-87170-725-3.
- Tổ chức Quốc gia về Rối loạn Hiếm gặp (2015). “Heavy metal poisoning”. Lưu trữ bản gốc ngày 14 tháng 6 năm 2015. Truy cập ngày 14 tháng 8 năm 2022.
- Tokar, E. J.; Boyd, W. A.; Freedman, J. H.; Wales, M. P. (2013). “Toxic effects of metals”. Trong Klaassen, C. D. (biên tập). Casarett and Doull's Toxicology: the Basic Science of Poisons (ấn bản thứ 8). New York: McGraw-Hill Medical. ISBN 978-0-07-176923-5. Truy cập ngày 14 tháng 8 năm 2022.
- Tomasik, P.; Ratajewicz, Z. (1985). Pyridine metal complexes. The Chemistry of Heterocyclic Compounds. 14. New York: John Wiley & Sons. Phần 6C. ISBN 978-0-471-05073-5.
- Topp, N. E. (1965). The Chemistry of the Rare-earth Elements. Amsterdam: Elsevier Publishing Company.
- Torrice, M. (2016). “How lead ended up in Flint's tap water”. Chemical & Engineering News. 94 (7): 26–27. Bản gốc lưu trữ ngày 13 tháng 2 năm 2016. Truy cập ngày 10 tháng 8 năm 2022.
- Tretkoff, E. (2006). “March 20, 1800: Volta describes the Electric Battery”. APS News, This Month in Physics History. Hội Vật lý Hoa Kỳ. Lưu trữ bản gốc ngày 11 tháng 9 năm 2007. Truy cập ngày 14 tháng 8 năm 2022.
- Uden, P. C. (2005). “Speciation of Selenium”. Trong Cornelis, R.; Caruso, J.; Crews, H.; Heumann, K. (biên tập). Handbook of Elemental Speciation II: Species in the Environment, Food, Medicine and Occupational Health. Chichester: John Wiley & Sons. tr. 346–365. ISBN 978-0-470-85598-0.
- Ủy ban kiểm soát nguồn nước California (1987). Toxic substances monitoring program. Water Quality Monitoring Report. Sacramento, California. Số 79, phần 20.
- Valkovic, V. (1990). “Origin of trace element requirements by living matter”. Trong Gruber, B.; Yopp, J. H. (biên tập). Symmetries in Science IV: Biological and biophysical systems. New York: Plenum Press. tr. 213–242. ISBN 978-1-4612-7884-9.
- VanGelder, K. T. (2014). Fundamentals of Automotive Technology: Principles and Practice. Burlington: Jones & Bartlett Learning. ISBN 978-1-4496-7108-2.
- Venner, M.; Lessening, M.; Pankani, D.; Strecker, E. (2004). Identification of Research Needs Related to Highway Runoff Management (PDF). Washington DC: Ủy ban nghiên cứu giao thông Hoa Kỳ. ISBN 978-0-309-08815-2. Bản gốc (PDF) lưu trữ ngày 22 tháng 8 năm 2016. Truy cập ngày 14 tháng 8 năm 2022.
- Venugopal, B.; Luckey, T. D. (1978). Metal Toxicity in Mammals. 2. New York: Plenum Press. ISBN 978-0-306-37177-6.
- Vernon, R. E. (2013). “Which elements are metalloids”. Journal of Chemical Education. 90 (12): 1703–1707. doi:10.1021/ed3008457.
- Vimercati, L.; Gatti, M. F.; Gagliardi, T.; Cuccaro, F.; De Maria, L.; Caputi, A.; Quarato, M.; Baldassarre, A. (2017). “Environmental exposure to arsenic and chromium in an industrial area”. Environmental Science and Pollution Research. 24 (12): 11528–11535. doi:10.1007/s11356-017-8827-6. ISSN 1614-7499.
- Volesky, B. (1990). Biosorption of Heavy Metals. Boca Raton: CRC Press. ISBN 978-0-8493-4917-1.
- von Gleich, A. (2006). “Outlines of a sustainable metals industry”. Trong von Gleich, A.; Ayres, R. U.; Gößling-Reisemann, S. (biên tập). Sustainable Metals Management. Dordrecht: Springer. tr. 3–40. ISBN 978-1-4020-4007-8.
- von Zeerleder, A. (1949). Technology of Light Metals. New York: Elsevier Publishing Company.
- Warth, A. H. (1956). The Chemistry and Technology of Waxes. New York: Reinhold Publishing Corporation.
- Weart, S. R. (1983). “The discovery of nuclear fission and a nuclear physics paradigm”. Trong Shea, W. (biên tập). Otto Hahn and the Rise of Nuclear Physics. Dordrecht: D. Reidel Publishing Company. tr. 91–133. ISBN 978-90-277-1584-5.
- Weber, D. J.; Rutula, W. A. (2001). “Use of metals as microbicides in preventing infections in healthcare”. Trong Block, S. S. (biên tập). Disinfection, Sterilization, and Preservation (ấn bản thứ 5). Philadelphia: Lippincott Williams & Wilkins. ISBN 978-0-683-30740-5.
- Welter, G. (1976). Cleaning and Preservation of Coins and Medals. New York: S. J. Durst. ISBN 978-0-915262-03-8.
- White, C. (2010). Projectile Dynamics in Sport: Principles and Applications. London: Routledge. ISBN 978-0-415-47331-6.
- Wiberg, N. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- Wijayawardena, M. A. A.; Megharaj, M.; Naidu, R. (2016). “Exposure, toxicity, health impacts and bioavailability of heavy metal mixtures”. Trong Sparks, D. L. (biên tập). Advances in Agronomy. 138. London: Academic Press. tr. 175–234. ISBN 978-0-12-804774-3.
- Wingerson, L. (1986). “America cleans up Liberty”. New Scientist: 31–35. Truy cập ngày 14 tháng 8 năm 2022.[liên kết hỏng]
- Wong, M. Y.; Hedley, G. J.; Xie, G.; Kölln, L. S.; Samuel, I. D. W.; Pertegaś, A.; Bolink, H. J.; Mosman-Colman, E. (2015). “Light-emitting electrochemical cells and solution-processed organic light-emitting diodes using small molecule organic thermally activated delayed fluorescence emitters”. Chemistry of Materials. 27 (19): 6535–6542. doi:10.1021/acs.chemmater.5b03245.
- Wulfsberg, G. (1987). Principles of Descriptive Inorganic Chemistry. Monterey, California: Brooks/Cole Publishing Company. ISBN 978-0-534-07494-4.
- Wulfsberg, G. (2000). Inorganic Chemistry. Sausalito, California: University Science Books. ISBN 978-1-891389-01-6.
- Yadav, J. S.; Antony, A.; Subba Reddy, B. V. (2012). “Bismuth(III) salts as synthetic tools in organic transformations”. Trong Ollevier, T. (biên tập). Bismuth-mediated Organic Reactions. Topics in Current Chemistry. 311. Heidelberg: Springer. ISBN 978-3-642-27238-7.
- Yang, D. J.; Jolly, W. L.; O'Keefe, A. (1977). “Conversion of hydrous germanium(II) oxide to germynyl sesquioxide, (HGe)2O3”. Inorganic Chemistry. 16 (11): 2980–2982. doi:10.1021/ic50177a070.
- Yousif, N. (2007). Geochemistry of stream sediment from the state of Colorado using NURE data. El Paso: ETD Collection for the University of Texas.
Đọc thêm
[sửa | sửa mã nguồn]Định nghĩa và sử dụng thuật ngữ
- Ali, H.; Khan, E. (2017). “What are heavy metals? Long-standing controversy over the scientific use of the term 'heavy metals'—proposal of a comprehensive definition”. Toxicological & Environmental Chemistry: 1–25. doi:10.1080/02772248.2017.1413652. Đề xuất định nghĩa kim loại nặng là "kim loại tồn tại trong tự nhiên có số hiệu nguyên tử (Z) lớn hơn 20 và khối lượng riêng nguyên tố lớn hơn 5 g · cm−3".
- Duffus, J. H. (2002). “'Heavy metals'—A meaningless term?” (PDF). Pure and Applied Chemistry. 74 (5): 793–807. doi:10.1351/pac200274050793. Có khảo sát về các nghĩa khác nhau của thuật ngữ.
- Hawkes, S. J. (1997). “What is a "heavy metal"?”. Journal of Chemical Education. 74 (11): 1374. doi:10.1021/ed074p1374. Góc nhìn từ một nhà hóa học.
- Hübner, R.; Astin, K. B.; Herbert, R. J. H. (2010). “'Heavy metal'—time to move on from semantics to pragmatics?”. Journal of Environmental Monitoring. 12: 1511–1514. doi:10.1039/C0EM00056F. Phát hiện rằng, dù thiếu tính cụ thể, thuật ngữ vẫn trở thành một phần của ngôn ngữ khoa học.
Độc tính và vai trò sinh học
- Baird, C.; Cann, M. (2012). Environmental Chemistry (ấn bản thứ 5). New York: W. H. Freeman and Company. Chương 12, "Toxic heavy metals". ISBN 978-1-4292-7704-4. Có thông tin về ứng dụng và độc tính của Hg, Pb, Cd, As và Cr.
- Nieboer, E.; Richardson, D. H. S. (1980). “The replacement of the nondescript term 'heavy metals' by a biologically and chemically significant classification of metal ions” (PDF). Environmental Pollution Series B, Chemical and Physical. 1 (1): 3–26. doi:10.1016/0143-148X(80)90017-8. Một bài báo có số lượng trích dẫn lớn, tập trung vào vai trò sinh học của kim loại nặng.
Quá trình hình thành
- Hadhazy, A. (10 tháng 5 năm 2016). “Galactic 'gold mine' explains the origin of nature's heaviest elements”. Science Spotlights. Lưu trữ bản gốc ngày 24 tháng 5 năm 2016. Truy cập ngày 13 tháng 8 năm 2022.
Ứng dụng
- Koehler, C. S. W. (2001). “Heavy metal medicine”. Chemistry Chronicles. Hội Hóa học Hoa Kỳ. Truy cập ngày 14 tháng 8 năm 2022.
- Morowitz, N. (14 tháng 6 năm 2006). “The heavy metals”. Modern Marvels. Mùa 12. Tập 18. History Channel.
- Öhrström, L. (24 tháng 9 năm 2014). “Tantalum oxide”. Chemistry World. Truy cập ngày 14 tháng 8 năm 2022. Tác giả giải thích tantal(V) oxide đã "đẩy đi" điện thoại di động "cục gạch" như thế nào. Xem thêm podcast.
Liên kết ngoài
[sửa | sửa mã nguồn] Tư liệu liên quan tới Heavy metals tại Wikimedia Commons
Tư liệu liên quan tới Heavy metals tại Wikimedia Commons- Kim loại nặng tại Từ điển bách khoa Việt Nam
 GIẢM
49%
GIẢM
49%
 GIẢM
30%
GIẢM
30%
 GIẢM
26%
GIẢM
26%
 GIẢM
1%
GIẢM
1%





![[Review sách] Những giấc mơ ở hiệu sách Morisaki - Chốn bình yên gắn kết tâm hồn đồng điệu](https://down-tx-vn.img.susercontent.com/edd27e656c28712031d4105f97d6d801.webp)




