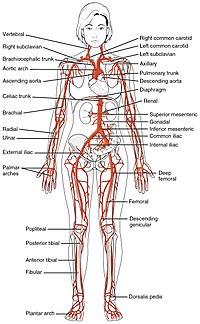
Hệ miễn dịch
Hệ miễn dịch (tiếng Anh : Immune system) là một hệ thống bảo vệ vật chủ gồm nhiều cấu trúc và quá trình sinh học của cơ thể nhằm bảo vệ chống lại bệnh tật. Để được coi là hoạt động bình thường, hệ thống miễn dịch phải phát hiện được rất nhiều yếu tố, gọi là mầm bệnh, có thể là từ virus đến ký sinh trùng, và phải phân biệt chúng với những mô khỏe mạnh của cơ thể. Ở nhiều loài, hệ thống miễn dịch có thể được phân thành các hệ thống nhỏ hơn, chẳng hạn như hệ thống miễn dịch tự nhiên với hệ thống miễn dịch thu được, hoặc miễn dịch thể dịch và miễn dịch qua trung gian tế bào. Ở người, hàng rào máu–não, hàng rào máu–dịch não tủy và các hàng rào chất lỏng–não tương tự tách biệt hệ thống miễn dịch bình thường với hệ thống miễn dịch não, vốn chuyên bảo vệ não.
Các mầm bệnh có thể nhanh chóng tiến hóa và thích nghi, và do đó có thể tránh bị phát hiện và không bị vô hiệu hoá bởi hệ thống miễn dịch; tuy nhiên, nhiều cơ chế phòng thủ cũng đã tiến hóa để nhận diện và trung hòa mầm bệnh. Ngay cả các sinh vật đơn bào đơn giản như vi khuẩn cũng có hệ thống miễn dịch thô sơ dưới dạng các enzym bảo vệ (ở đây là enzym giới hạn) để chống lại các bệnh do thể thực khuẩn. Một số cơ chế miễn dịch cơ bản khác đã phát triển trong các loài sinh vật nhân chuẩn cổ đại và vẫn còn trong hậu duệ hiện đại của chúng, như ở thực vật và động vật không xương sống. Các cơ chế này bao gồm thực bào, các peptide kháng khuẩn được gọi là defensin, và hệ thống bổ thể. Các động vật có quai hàm, bao gồm cả con người, còn có cơ chế phòng vệ tinh vi hơn,[1] bao gồm khả năng thích ứng theo thời gian để nhận ra các mầm bệnh cụ thể hiệu quả hơn. Miễn dịch thích ứng (hoặc miễn dịch thu được) hình thành trí nhớ miễn dịch sau lần gặp ban đầu đối với một mầm bệnh cụ thể, dẫn đến đáp ứng tăng cường cho các lần chạm trán sau này với cùng mầm bệnh đó. Quá trình miễn dịch thu được này là cơ sở tiêm chủng.
Rối loạn hệ thống miễn dịch có thể dẫn đến bệnh tự miễn, bệnh viêm và ung thư.[2] Suy giảm miễn dịch là khi hệ miễn dịch ít hoạt động hơn bình thường, dẫn đến các bệnh nhiễm trùng tái phát và đe dọa đến mạng sống. Ở người, suy giảm miễn dịch có thể là kết quả của một căn bệnh di truyền như suy giảm miễn dịch kết hợp cấp, các bệnh liên quan đến HIV/AIDS, hoặc sử dụng thuốc ức chế miễn dịch. Ngược lại, bệnh tự miễn là kết quả khi hệ thống miễn dịch hoạt động quá mức nên tấn công chính các mô bình thường như thể là sinh vật ngoại lai. Các bệnh tự miễn thường gặp bao gồm viêm tuyến giáp Hashimoto, viêm khớp dạng thấp, bệnh đái tháo đường type 1, và lupus ban đỏ hệ thống. Miễn dịch học là môn học nghiên cứu của tất cả các khía cạnh của hệ thống miễn dịch.
Lịch sử miễn dịch học
[sửa | sửa mã nguồn]Miễn dịch học là một ngành khoa học tìm hiểu thành phần và chức năng của hệ miễn dịch. Môn học này xuất phát từ những nghiên cứu y dược ban đầu về nguyên nhân gây miễn nhiễm đối với bệnh tật. Miễn dịch được đề cập đến sớm nhất là trong trận đại dịch ở Athens năm 430 TCN. Nhà y học Thucydides đã để ý rằng: những người đã hồi phục từ một đợt bệnh trước đó có thể giám sát người đang bệnh mà không bị bệnh lại lần thứ hai.[3] Vào thế kỷ 18, Pierre-Louis Moreau de Maupertuis thực hiện thí nghiệm với nọc độc bọ cạp và quan sát thấy rằng một số con chó và chuột đã được miễn nhiễm với nọc độc này.[4] Quan sát này và các quan sát khác về khả năng miễn dịch đã được Louis Pasteur khai thác trong quá trình tiêm vaccine và đề xuất lý thuyết mầm bệnh vi sinh.[5] Lý thuyết của Pasteur đã trực tiếp phản đối các học thuyết đương thời về bệnh tật, chẳng hạn như học thuyết miasma-nói rằng bệnh tật gây ra do "hắc khí". Chỉ đến năm 1891, với những bằng chứng được đưa ra bởi Robert Koch (được trao giải Nobel năm 1905) các vi sinh vật đã được khẳng định chính là nguyên nhân gây bệnh truyền nhiễm.[6] Virus đã được xác định cũng là mầm bệnh cho con người vào năm 1901, khi Walter Reed phát hiện ra virus sốt vàng.[7]
Miễn dịch học đã có một bước tiến lớn vào cuối thế kỷ 19 đó là nhờ sự phát triển nhanh chóng trong nghiên cứu về miễn dịch thể dịch và miễn dịch tế bào.[8] Đặc biệt quan trọng là công trình của Paul Ehrlich, người đã đề xuất lý thuyết chuỗi phụ phân tử (side-chain) để giải thích tính đặc hiệu của phản ứng kháng nguyên-kháng thể; những đóng góp của ông cho sự hiểu biết về miễn dịch thể dịch đã được ghi nhận bởi giải thưởng Nobel năm 1908, cùng với người đề xuất miễn dịch qua trung gian tế bào, Elie Metchnikoff.[9]
Các lớp bảo vệ
[sửa | sửa mã nguồn]Hệ miễn dịch bảo vệ các sinh vật khỏi bị nhiễm trùng với các lớp phòng thủ ngày càng đặc hiệu. Nói một cách đơn giản, các hàng rào vật lý ngăn ngừa các mầm bệnh như vi khuẩn và virus xâm nhập vào cơ thể. Nếu một mầm bệnh vượt qua hàng rào này, hệ thống miễn dịch bẩm sinh sẽ tạo đáp ứng tức thời, nhưng không đặc hiệu. Hệ miễn dịch bẩm sinh được tìm thấy ở tất cả các loài thực vật và động vật.[10] Nếu các mầm bệnh thoát được miễn dịch bẩm sinh, thì động vật có xương sống còn có lớp bảo vệ thứ hai là hệ thống miễn dịch thu được, được kích hoạt bởi hệ miễn dịch bẩm sinh. Lúc này, hệ thống miễn dịch sẽ thích ứng các đáp ứng của nó trong suốt thời gian nhiễm trùng để cải thiện khả năng nhận diện mầm bệnh. Sự đáp ứng được cải thiện này sẽ được giữ lại cả sau khi mầm bệnh đã được loại bỏ, dưới dạng trí nhớ miễn dịch, và cho phép hệ miễn dịch thu được phát động các cuộc tấn công nhanh và mạnh mẽ hơn nếu gặp lại mầm bệnh này.[11][12]
So sánh hệ miễn dịch bẩm sinh và thu được
[sửa | sửa mã nguồn]| Hệ miễn dịch bẩm sinh
(Innate Immune System - IIS) |
Hệ miễn dịch thu được
(Adaptive Immune System - AIS) |
|---|---|
| Đáp ứng không đặc hiệu | Đáp ứng đặc hiệu của kháng nguyên và mầm bệnh |
| Đáp ứng khơi mào sẽ nhanh chóng đẩy lên cao trào | Có thời gian "trễ" giữa đáp ứng khơi mào và cao trào |
| Các thành phần trung gian tế bào và thể dịch | Các thành phần trung gian tế bào và thể dịch |
| Không có trí nhớ miễn dịch | Có trí nhớ miễn dịch |
| Tìm thấy ở rất nhiều dạng sinh vật | Chỉ tìm thấy ở động vật có quai hàm |
Cả miễn dịch bẩm sinh và thu được đều phụ thuộc vào khả năng của hệ thống miễn dịch để phân biệt giữa các phân tử của bản thân và không của bản thân. Trong miễn dịch học, các phân tử của bản thân là những thành phần của cơ thể và có thể phân biệt với phân tử ngoại lai bởi hệ thống miễn dịch.[13] Ngược lại, các phân tử không của bản thân là các phân tử ngoại lai. Một loại các phân tử ngoại lai như thế được gọi là kháng nguyên và được định nghĩa là các chất gắn với các thụ thể miễn dịch đặc hiệu và kích hoạt đáp ứng miễn dịch.[14]
Miễn dịch bẩm sinh
[sửa | sửa mã nguồn]Các vi sinh vật hoặc độc tố sau khi xâm nhập thành công sẽ phải đối mặt với các tế bào và cơ chế của hệ miễn dịch bẩm sinh. Đáp ứng bẩm sinh thường được kích hoạt khi các vi khuẩn được xác định bởi các thụ thể nhận dạng, nhận biết các thành phần được giấu trong các nhóm vi sinh vật[15] hoặc trong một trường hợp khác là khi các tế bào bị tổn thương, hư hại hoặc stress sẽ gửi tín hiệu báo động, mà đa số (không phải tất cả) được nhận dạng bởi cùng thụ thể nhận biết các mầm bệnh.[16] Hệ thống miễn dịch bẩm sinh thì không đặc hiệu, có nghĩa là những hệ thống này phản ứng với tất cả mầm bệnh theo một cách giống nhau.[14] Hệ thống này cũng không tạo ra miễn dịch lâu dài đối với mầm bệnh. Hệ thống miễn dịch bẩm sinh là hệ thống chủ yếu bảo vệ vật chủ ở hầu hết các sinh vật.[10]
Các hàng rào bề mặt
[sửa | sửa mã nguồn]Một số hàng rào bảo vệ sinh vật khỏi bị nhiễm trùng, bao gồm các hàng rào cơ học, hóa học và sinh học. Lớp vỏ sáp phủ ngoài ở hầu hết các loại lá, bộ xương ngoài của côn trùng, vỏ và màng ngoài của trứng, hoặc da là những ví dụ về các hàng rào cơ học, chúng là tuyến bảo vệ đầu tiên để phòng ngừa nhiễm trùng.[14] Tuy nhiên, vì các sinh vật không thể được bao phủ và tách biệt hoàn toàn với môi trường sống, chúng cũng có các hệ thống khác hoạt động để bảo vệ các phần hở của cơ thể (như phổi, ruột, và đường sinh dục). Ở đường phổi, cơ chế ho và hắt hơi tống khứ mầm bệnh và các chất gây khó chịu khác ra khỏi đường hô hấp. Chảy nước mắt và bài tiết nước tiểu cũng là cơ chế đẩy các mầm bệnh ra ngoài, trong khi dịch nhầy tiết ra do đường hô hấp và đường tiêu hóa giúp "bẫy" và ngăn vi sinh vật xâm nhập.[17]
Hàng rào hóa học cũng bảo vệ chống lại nhiễm trùng. Da và đường hô hấp tiết ra các chất kháng khuẩn như peptide β.[18] Enzyme như lysozyme và phospholipase A2 trong nước bọt, nước mắt và sữa mẹ cũng là các chất kháng khuẩn.[19][20] Chất nhầy âm đạo cũng là một hàng rào hóa học cùng với kinh nguyệt, vì chất nhầy hơi acid giúp hạn chế vi sinh vật. Trong khi đó, tinh dịch có chứa defensin và kẽm để diệt các mầm bệnh.[21][22] Trong dạ dày, acid dạ dày và protease đóng vai trò như bức tường hóa học mạnh mẽ giúp ngăn các mầm bệnh tiến vào.
Ở đường sinh dục và đường tiêu hóa, những vi khuẩn sống hội sinh đóng vai trò như các hàng rào sinh học bằng cách cạnh tranh với vi khuẩn gây bệnh ở mặt dinh dưỡng và nơi ở, và trong một số trường hợp là bằng cách thay đổi điều kiện môi trường của chúng, như pH hoặc sắt tự do[23] Kết quả của mối quan hệ cộng sinh (hoặc hội sinh) giữa những lợi khuẩn này với hệ thống miễn dịch là các mầm bệnh sẽ rất khó để đạt đủ số lượng dẫn đến gây bệnh (do bị cạnh tranh mạnh mẽ). Tuy nhiên, vì hầu hết các kháng sinh không đặc hiệu nhắm tới vi khuẩn mà không ảnh hưởng đến nấm, thuốc kháng sinh đường uống có thể dẫn đến sự phát triển quá mức của nấm và gây ra các bệnh như candida âm đạo (bệnh do nấm).[24] Có nhiều bằng chứng cho thấy việc đưa thêm những vi sinh vật probiodic, ví dụ như dòng thuần của lợi khuẩn Lactobacillus thường thấy trong sữa chua không được khử trùng Pasteur, giúp khôi phục lại sự cân bằng tốt giữa các quần thể vi sinh vật trong nhiễm khuẩn đường ruột ở trẻ em và cũng là những dữ liệu ban đầu khuyến khích các nghiên cứu về vi khuẩn viêm vị trường, bệnh viêm ruột, nhiễm trùng đường tiểu và nhiễm trùng hậu phẫu.[25][26][27]
Viêm
[sửa | sửa mã nguồn]Viêm là một trong những đáp ứng đầu tiên của hệ miễn dịch đối với nhiễm trùng.[28] Các triệu chứng viêm điển hình là đỏ, sưng, nóng, và đau, đó là do sự gia tăng lưu lượng máu vào mô. Viêm được biểu hiện bởi các phân tử tín hiệu eicosanoid và các protein nhỏ cytokine, do các tế bào bị thương hoặc nhiễm khuẩn tiết ra. Eicosanoid bao gồm prostaglandin gây ra sốt và sự giãn các mạch máu tạo nên chứng viêm, và leukotriene thu hút một số tế bào máu trắng nhất định (bạch cầu).[29][30] Các cytokine thông thường bao gồm: interleukin chịu trách nhiệm truyền tin giữa các tế bào bạch cầu; chemokine thúc đẩy hướng hóa; và interferon có tác dụng chống virus, chẳng hạn như tắt tổng hợp protein trong tế bào chủ.[31] Các nhân tố sinh trưởng và các yếu tố độc tế bào cũng có thể được giải phóng. Các cytokine này và các hóa chất khác giúp huy động tế bào miễn dịch vào vị trí nhiễm trùng và cũng thúc đẩy việc chữa lành các mô bị tổn thương sau khi loại bỏ các mầm bệnh.[32]

Hệ thống bổ thể
[sửa | sửa mã nguồn]Có thể coi hệ thống bổ thể là một "dòng thác" sinh hóa tấn công bề mặt của các tế bào ngoại lai. Hệ thống này gồm hơn 20 protein khác nhau và tên gọi "bổ thể" xuất phát từ khả năng "bổ sung" cho việc tiêu diệt các mầm bệnh bằng kháng thể. Bổ thể là thành phần thể dịch (lưu hành trong máu) chính của đáp ứng miễn dịch bẩm sinh.[33][34] Hệ thống bổ thể được tìm thấy ở nhiều loài, bao gồm cả các loài không phải là động vật có vú như thực vật, cá, và một số động vật không xương sống.[35]
Ở người, phản ứng bổ thể được kích hoạt bằng cách gắn kết bổ thể vào các kháng thể đang gắn đặc hiệu với những vi sinh vật lạ hoặc bổ thể sẽ gắn vào đuôi carbohydrate trên bề mặt mầm bệnh. Tín hiệu nhận biết này gây nên phản ứng tiêu diệt nhanh chóng.[36] Tốc độ phản ứng nhanh là kết quả của sự khuếch đại tín hiệu xảy ra do khởi động chuỗi phân tách tuần tự của các protein bổ thể, còn được gọi là protease (thủy phân protein). Sau khi bổ thể đầu tiên gắn với vi khuẩn, hoạt tính protease của nó được kích hoạt, từ đó kích hoạt protease của các bổ thể tiếp theo, và cứ như vậy. Điều này tạo ra một dòng thác khuếch đại tín hiệu ban đầu bằng điều hòa ngược dương tính được kiểm soát.[37] Quá trình này cuối cùng sẽ tạo nên các chuỗi peptide giúp thu hút các tế bào miễn dịch, tăng tính thấm của mạch máu, và opsonin hóa mầm bệnh, và đánh dấu chúng để phá hủy. "Dòng thác" bổ thể cũng có thể giết chết tế bào ngoại lai trực tiếp bằng cách phá vỡ màng sinh chất của chúng.[33]
Hàng rào của tế bào
[sửa | sửa mã nguồn]
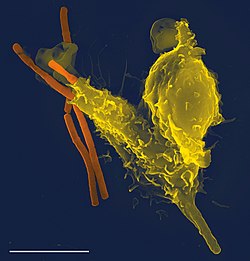
Bạch cầu (tế bào máu trắng) hoạt động giống như các sinh vật đơn bào độc lập và là trợ thủ đắc lực của hệ miễn dịch bẩm sinh.[14] Các bạch cầu bẩm sinh bao gồm các tế bào thực bào (gồm đại thực bào, bạch cầu trung tính và các tế bào nhiều nhánh), các tế bào lympho bẩm sinh, các tế bào phì-dưỡng bào, bạch cầu ưa acid, bạch cầu ưa base, và các tế bào giết tự nhiên. Các tế bào này xác định và loại bỏ mầm bệnh bằng cách tấn công các mầm bệnh lớn hơn qua tiếp xúc, hoặc bằng cách thực bào và sau đó giết chết các vi sinh vật. Các tế bào bẩm sinh cũng là trung gian quan trọng[38] trong sự phát triển của cơ quan bạch huyết và kích hoạt hệ thống miễn dịch thu được.[39]
Thực bào là một khía cạnh quan trọng của miễn dịch bẩm sinh cấp tế bào và được thực hiện bởi các tế bào được gọi là tế bào thực bào (phagocyte). Các tế bào này sẽ thực bào, hay nói đơn giản hơn là "nuốt" mầm bệnh hoặc các hạt. Tế bào thực bào thường đi tuần trong cơ thể tìm kiếm mầm bệnh, nhưng có thể được gọi đến các vị trí cụ thể bằng các cytokine.[14] Một khi mầm bệnh đã bị "nuốt" bởi một tế bào thực bào, nó sẽ bị mắc kẹt trong một túi bào nội bào gọi là phagosome, sau đó túi này sẽ kết hợp với một túi khác gọi là lysosome để tạo thành một phagolysosome. Mầm bệnh sau đó bị tiêu diệt bởi hoạt động của các enzyme tiêu hóa hoặc sau một đợt bùng nổ hô hấp khi bị phóng thích các gốc tự do có hại vào trong phagolysosome.[40][41] Thực bào được tiến hóa như một phương tiện để thu thập các chất dinh dưỡng ("thực" là ăn), nhưng vai trò này đã được mở rộng trong các tế bào thực bào để có thể nuốt các mầm bệnh như một cơ chế bảo vệ. Thực bào có thể đại diện cho hình thức bảo vệ vật chủ lâu đời nhất, vì các tế bào thực bào đã được tìm thấy trên cả động vật có xương sống và động vật không xương sống.[42]
Bạch cầu trung tính và đại thực bào là những tế bào thực bào chu du khắp cơ thể truy đuổi mầm bệnh xâm nhập.[43] Bạch cầu trung tính hay thường được tìm thấy trong máu và là dạng phổ biến nhất của tế bào thực bào, bình thường chiếm từ 50% đến 60% tổng số bạch cầu của dịch tuần hoàn.[44] Trong giai đoạn cấp tính của viêm, đặc biệt là do nhiễm khuẩn, bạch cầu trung tính sẽ di chuyển đến chỗ viêm trong một quá trình gọi là hướng hóa, và thường là các tế bào đầu tiên đến "hiện trường" nhiễm trùng. Các đại thực bào là các tế bào đa năng nằm trong các mô và sản xuất ra một loạt các chất gồm: enzyme, bổ thể và các cytokine, chúng cũng có thể hoạt động như những "máy dọn rác" để loại bỏ các tế bào không còn chức năng và các mảnh tế bào khác, và cả các tế bào đang trình diện kháng nguyên kích hoạt hệ thống miễn dịch thu được.[45]
Các tế bào tua (hay tế bào nhiều nhánh, tế bào hình cây) là những tế bào thực bào hay tiếp xúc với môi trường bên ngoài; do đó chúng nằm chủ yếu ở da, mũi, phổi, dạ dày và ruột.[46] Các tế bào này được đặt tên theo sự giống nhau của chúng với các tế bào nhiều nhánh trên thần kinh, vì cả hai đều có nhiều "gai" tua tủa, nhưng các tế bào nhiều nhánh ở đây tất nhiên là không liên quan gì đến hệ thần kinh. Các tế bào nhiều nhánh phục vụ như một liên kết giữa các mô cơ thể và các hệ thống miễn dịch bẩm sinh và thu được, vì chúng có kháng nguyên đối với tế bào T, một trong những loại tế bào chủ chốt của hệ miễn dịch thu được.
Các dưỡng bào hay tế bào phì nằm ở trong mô liên kết và niêm mạc, và điều chỉnh phản ứng viêm.[47] Chúng thường liên quan đến dị ứng và sốc phản vệ.[44] Bạch cầu ưa kiềm và bạch cầu ưa acid có liên quan đến bạch cầu trung tính. Chúng tiết ra các chất trung gian hóa học có liên quan đến việc phòng vệ ký sinh trùng và đóng một vai trò trong các phản ứng dị ứng, như hen suyễn.[48] Các tế bào giết tự nhiên là các bạch cầu tấn công và phá hủy tế bào khối u, hoặc các tế bào đã bị nhiễm virus.[49]
Các tế bào giết tự nhiên
[sửa | sửa mã nguồn]Các tế bào giết tự nhiên, còn gọi là các tế bào NK, là các tế bào lympho trong hệ miễn dịch bẩm sinh. Tế bào NK không trực tiếp tấn công các vi khuẩn xâm nhập.[50] Thay vào đó, các tế bào NK tiêu hủy các tế bào chủ bị "hỏng", ví dụ như các tế bào khối u hoặc các tế bào bị nhiễm virus, NK nhận ra các tế bào như vậy do chúng có một tình trạng gọi là "mất bản thân." (missing self). Thuật ngữ này mô tả các tế bào với rất ít dấu chuẩn (thụ thể) bề mặt tế bào gọi là MHC I (phức hợp phù hợp mô chính) - tình trạng này có thể phát sinh khi tế bào chủ nhiễm virus.[35] Tế bào này được đặt tên là "giết tự nhiên" vì nó không cần được hoạt hóa ban đầu để giết các tế bào "mất bản thân". Trong rất nhiều năm, ta không rõ các tế bào NK đã nhận ra tế bào khối u và ung thư như thế nào. Bây giờ người ta biết rằng "lớp phủ" MHC trên bề mặt của những tế bào này đã bị thay đổi và các tế bào NK trở nên hoạt hóa thông qua việc nhận ra "mất bản thân". Các tế bào cơ thể bình thường không được nhận diện và tấn công bởi các tế bào NK vì chúng thể hiện các kháng nguyên MHC còn nguyên vẹn. Những kháng nguyên MHC này được nhận diện bởi các thụ thể kháng thể tế bào giết (killer cell immunoglobulin receptors viết tắt là KIR), nhận diện này sẽ kìm hãm các tế bào NK khỏi giết chính các tế bào khỏe mạnh.[51]
Miễn dịch thu được
[sửa | sửa mã nguồn]Hệ miễn dịch thu được (còn gọi là miễn dịch tập nhiễm) đã phát triển sớm ở động vật có xương sống và cho phép có một đáp ứng miễn dịch mạnh hơn cũng như có một trí nhớ miễn dịch, nơi mà mỗi mầm bệnh được "ghi nhớ" bằng một "dấu ấn" kháng nguyên đặc thù [52]. Đáp ứng miễn dịch thu được là đặc hiệu với từng kháng nguyên và đòi hỏi sự nhận diện các kháng nguyên "không của bản thân" cụ thể trong một quá trình được gọi là trình diện kháng nguyên. Tính đặc hiệu của kháng nguyên cho phép tạo ra các phản ứng được điều chỉnh cho từng mầm bệnh cụ thể hoặc các tế bào nhiễm mầm bệnh. Những phản ứng vô cùng phù hợp này được lưu lại trong cơ thể bằng các tế bào nhớ. Nếu mầm bệnh lây nhiễm vào cơ thể nhiều lần, những tế bào nhớ cụ thể này sẽ được sử dụng để nhanh chóng loại bỏ nó.
Các tế bào lympho
[sửa | sửa mã nguồn]Các tế bào của hệ miễn dịch thu được là các loại bạch cầu đặc biệt, gọi là tế bào lympho. Tế bào B và tế bào T là những loại chính của tế bào lympho và đều được bắt nguồn từ các tế bào gốc tạo máu trong tủy xương. Các tế bào B tham gia vào phản ứng miễn dịch thể dịch, trong khi các tế bào T tham gia phản ứng miễn dịch qua trung gian tế bào.
Cả hai tế bào B và tế bào T mang các phân tử thụ thể nhận ra các mục tiêu cụ thể. Các tế bào T nhận diện được một mục tiêu "không của bản thân", ví dụ như một mầm bệnh, chỉ sau khi các kháng nguyên (những mảnh nhỏ của mầm bệnh) được xử lý và trình diện kết hợp với một thụ thể "của bản thân" gọi là phân tử phức hợp phù hợp mô chính (MHC). Có hai loại phụ chính của tế bào T: tế bào T độc còn gọi là T giết và tế bào T hỗ trợ. Ngoài ra còn có các tế bào T điều hòa có vai trò trong tinh chỉnh các đáp ứng miễn dịch. Các tế bào T độc chỉ nhận biết các kháng nguyên kết hợp với các phân tử MHC lớp I, trong khi các tế bào T hỗ trợ và các tế bào T điều hòa chỉ nhận ra các kháng nguyên kết hợp với các phân tử MHC lớp II. Hai cơ chế trình diện kháng nguyên phản ánh các vai trò khác nhau của hai loại tế bào T. Còn có cơ chế thứ ba, dành cho một phần nhỏ các tế bào T γδ (đọc là T gamma delta) là nhận diện các kháng nguyên nguyên vẹn mà không cần gắn với thụ thể MHC.[53] Các tế bào T lưỡng dương tính (double-positive) biểu hiện nhiều loại kháng nguyên của cơ thể khác nhau trong tuyến ức, và nhân đây cũng nói rằng, iod rất cần cho sự trưởng thành và hoạt động của tế bào T trong tuyến ức.[54]
Ngược lại, thụ thể đặc hiệu kháng nguyên tế bào B là một phân tử kháng thể trên bề mặt tế bào B và nhận biết được mầm bệnh hoàn chỉnh mà không cần phải xử lý và trình diện kháng nguyên. Mỗi dòng tế bào B biểu hiện một kháng thể khác nhau, do đó, bộ hoàn chỉnh thụ thể kháng nguyên tế bào B đại diện cho tất cả các kháng thể mà cơ thể có thể sản xuất.
Tế bào T độc
[sửa | sửa mã nguồn]Tế bào T độc (hay T giết) là một nhóm nhỏ các tế bào T tiêu diệt các tế bào bị nhiễm virus (và các mầm bệnh khác), hoặc tế bào bị hư hỏng hoặc không còn chức năng.[55] Giống như các tế bào B, mỗi loại tế bào T nhận ra một kháng nguyên khác nhau. Các tế bào T độc được kích hoạt khi thụ thể tế bào T của chúng (T-cell receptor viết tắt là TCR) gắn với kháng nguyên cụ thể trong một phức hợp với thụ thể MHC lớp I của tế bào khác. Sự nhận diện của MHC này: phức hợp kháng nguyên còn được hỗ trợ bởi một đồng thụ thể trên tế bào T, được gọi là CD8. Sau đó, tế bào T di chuyển khắp cơ thể để tìm các tế bào mang các thụ thể MHC I trình diện kháng nguyên này. Khi một tế bào T được hoạt hóa tiếp xúc với các tế bào như vậy, nó sẽ phóng ra các chất độc tế bào (cytotoxin), ví dụ như perforin, tạo thành các lỗ trên màng tế bào của các tế bào đích, cho phép các ion, nước và các chất độc tràn vào. Sự xâm nhập của một độc tố khác gọi là granulysin (một protease) khiến cho tế bào đích phải trải qua quá trình tự chết theo chương trình.[56] Việc giết tế bào chủ bởi tế bào T là đặc biệt quan trọng trong việc ngăn ngừa sự nhân lên của virus. Việc kích hoạt tế bào T được kiểm soát chặt chẽ và thường đòi hỏi một tín hiệu kích hoạt MHC / kháng nguyên rất mạnh hoặc các tín hiệu kích hoạt bổ sung được cung cấp bởi các tế bào T hỗ trợ.[56]
Tế bào T hỗ trợ
[sửa | sửa mã nguồn]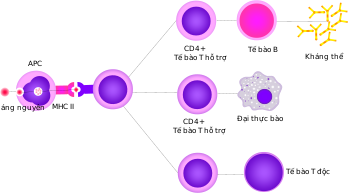
Các tế bào T hỗ trợ giúp điều chỉnh cả đáp ứng miễn dịch bẩm sinh và thu được và giúp xác định phản ứng miễn dịch nào mà cơ thể tạo ra đối với một mầm bệnh cụ thể.[57][58] Các tế bào này không có hoạt động gây độc tế bào và không giết các tế bào bị nhiễm cũng không tiêu diệt mầm bệnh một cách trực tiếp. Thay vào đó, nó kiểm soát phản ứng miễn dịch bằng cách "chỉ đạo" các tế bào khác để thực hiện các nhiệm vụ trên.
Các tế bào T hỗ trợ biểu hiện các thụ thể tế bào T (TCR) nhận diện kháng nguyên đang gắn với phân tử MHC lớp II. Phức hợp MHC-kháng nguyên: cũng được nhận diện bởi đồng thụ thể CD4 của tế bào hỗ trợ, huy động các các phân tử bên trong tế bào T (ví dụ, Lck-lymphocyte-specific protein tyrosine kinase), với nhiệm vụ kích hoạt tế bào T. Các tế bào T hỗ trợ có một tương tác yếu hơn với phức hợp kháng nguyên MHC nếu so sánh với các tế bào T độc, có nghĩa là: phải nhiều thụ thể (khoảng 200-300) trên tế bào T hỗ trợ gắn với một MHC-kháng nguyên mới kích hoạt tế bào T hỗ trợ, trong khi các tế bào T độc có thể được kích hoạt chỉ bằng 1 thụ thể gắn một phân tử MHC-kháng nguyên duy nhất. Kích hoạt tế bào T hỗ trợ còn đòi hỏi thời gian tương tác dài hơn với tế bào trình diện kháng nguyên.[59] Việc kích hoạt tế bào T hỗ trợ làm nó phóng thích các cytokine ảnh hưởng đến hoạt động của nhiều loại tế bào. Các tín hiệu Cytokine được tạo ra bởi các tế bào T hỗ trợ làm tăng chức năng diệt vi khuẩn của các đại thực bào và hoạt động của các tế bào T độc.[14] Ngoài ra, kích hoạt tế bào T hỗ trợ gây ra sự tăng lên của các phân tử biểu hiện trên bề mặt của tế bào T, như phối tử CD40 (còn gọi là CD154), cung cấp các tín hiệu kích thích đặc biệt để kích hoạt các tế bào B tạo kháng thể.[60]
Tế bào T Gamma delta
[sửa | sửa mã nguồn]Các tế bào T Gamma delta (hay T γδ) có một thụ thể tế bào T thay thế là đối nghịch so với các tế bào T CD4+ và CD8 + (αβ) T và chia sẻ các đặc tính của tế bào T hỗ trợ, tế bào T độc T và tế bào NK. Các điều kiện tạo đáp ứng từ các tế bào T γδ không được hiểu đầy đủ. Giống như một phần nhỏ các tế bào T "khác thường", T gamma delta mang một số TCR bất biến, chẳng hạn như thụ thể CD1d ức chế các tế bào giết tự nhiên, các tế bào T γδ nằm ở ranh giới miễn dịch bẩm sinh và thu được.[61] Một mặt, các tế bào T γδ là một thành phần của miễn dịch thu được do chúng sắp xếp lại gen TCR để tạo ra sự đa dạng thụ thể và cũng có thể phát triển kiểu hình trí nhớ miễn dịch. Mặt khác, một số tập con khác nhau của nó lại là một phần của hệ thống miễn dịch bẩm sinh, vì các thụ thể ức chế TCR hay thụ thể NK có thể được sử dụng như các thụ thể nhận dạng khuôn mẫu (Pattern recognition receptor viết tắt là PRR). Ví dụ, một lượng lớn các tế bào T Vγ9/Vδ2 người sẽ đáp ứng trong vòng vài giờ với các kháng nguyên không phải peptide được tạo ra bởi các vi khuẩn, và các tế bào T Vδ1+ bị ức chế rất cao trong đáp ứng biểu mô với tế bào biểu mô bị stress.[53]
Tế bào lympho B và kháng thể
[sửa | sửa mã nguồn]
Một tế bào B xác định các mầm bệnh khi các kháng thể trên bề mặt của nó liên kết với một kháng nguyên ngoại lai đặc hiệu.[63] Phức hệ kháng nguyên/kháng thể này được lấy bởi tế bào B và được xử lý bằng phân giải protein thành các peptide. Tế bào B sau đó sẽ trình diện các peptide kháng nguyên này trên các phân tử MHC lớp II. Phức hợp MHC-kháng nguyên thu hút một tế bào T hỗ trợ đến kết hợp, giải phóng lymphokine và hoạt hóa tế bào B.[64] Khi tế bào B được hoạt hóa, chúng bắt đầu phân chia và tạo ra các tương bào. Những tương bào này sẽ sinh ra hàng triệu bản sao của kháng thể nhận diện kháng nguyên này. Những kháng thể này lưu thông trong huyết tương và bạch huyết, kết hợp với các mầm bệnh biểu hiện kháng nguyên và đánh dấu chúng để phá hủy bởi bổ thể hoặc cho chúng bị tiêu hủy bởi các tế bào thực bào. Các kháng thể cũng có thể trung hòa các mầm bệnh trực tiếp bằng cách liên kết với các độc tố của vi khuẩn hoặc can thiệp vào các thụ thể mà virus và vi khuẩn sử dụng để gây nhiễm các tế bào.[65]
Các biến thể hệ miễn dịch thu được
[sửa | sửa mã nguồn]Sự tiến hóa của hệ thống miễn dịch thu được xảy ra trong tổ tiên của động vật có quai hàm. Rất nhiều phân tử cơ bản của hệ thống miễn dịch thu được (ví dụ, globulin miễn dịch và các thụ thể tế bào T) chỉ tồn tại trong động vật có quai hàm. Tuy nhiên, một phân tử nguồn gốc lympho khác biệt đã được phát hiện trong "động vật không có quai hàm" nguyên thủy, ví dụ như ở cá mút đá. Những động vật này có một mảng lớn các phân tử gọi là thụ thể tế bào lympho biến đổi (variable lymphocyte receptors hay VLR), giống như các thụ thể kháng nguyên của động vật có quai hàm, được sản xuất từ chỉ một hoặc hai gen. Các phân tử này được cho là gắn kết các kháng nguyên gây bệnh theo cách tương tự với các kháng thể và với cùng mức độ đặc hiệu.[66]
Trí nhớ miễn dịch
[sửa | sửa mã nguồn]Khi các tế bào B và tế bào T được kích hoạt và bắt đầu nhân lên, một số tế bào con của chúng sẽ trở thành các tế bào nhớ tồn tại rất lâu. Trong suốt cuộc đời của một con vật, các tế bào nhớ sẽ "ghi nhớ" từng mầm bệnh cụ thể gặp phải và có thể khởi động một đáp ứng mạnh mẽ nếu mầm bệnh được gặp lại. Điều này chính là "thu được" (trong từ miễn dịch thu được - acquired immunity) bởi vì nó xảy ra trong suốt cuộc đời của một cá thể, "gặp" và "nhớ" rất nhiều mầm bệnh gặp phải và chuẩn bị hệ miễn dịch cho những thách thức trong tương lai. Trí nhớ miễn dịch có thể ở dạng trí nhớ thụ động ngắn hạn hoặc trí nhớ chủ động dài hạn.
Trí nhớ thụ động
[sửa | sửa mã nguồn]Trẻ sơ sinh chưa từng bị nhiễm trước đó với vi khuẩn nhưng lại đặc biệt dễ bị phơi nhiễm. Vì vậy, một số hàng rào bảo vệ thụ động được cung cấp bởi người mẹ để giúp con tránh nhiễm khuẩn. Trong thời kỳ mang thai, một loại kháng thể đặc biệt, được gọi là IgG, được vận chuyển từ mẹ sang con trực tiếp qua nhau thai, do đó, đứa trẻ có kháng thể cao ngay cả vừa mới sinh, với cùng một phổ kháng nguyên đặc hiệu như mẹ của chúng.[67] Sữa mẹ cũng chứa các kháng thể được chuyển vào ruột của trẻ sơ sinh và bảo vệ khỏi nhiễm khuẩn cho đến khi trẻ sơ sinh có thể tổng hợp các kháng thể riêng của mình.[68] Đây là miễn dịch thụ động bởi vì thai nhi không thực sự tạo ra bất kỳ tế bào nhớ hoặc kháng thể nào, chúng chỉ mượn từ mẹ. Sự miễn dịch thụ động này thường là ngắn hạn, chỉ kéo dài từ vài ngày đến vài tháng. Trong y học, khả năng miễn dịch thụ động bảo vệ cũng có thể được truyền nhân tạo từ người này sang người khác qua truyền huyết thanh giàu kháng thể.[69]
Trí nhớ chủ động và tiêm chủng
[sửa | sửa mã nguồn]
Trí nhớ chủ động dài hạn thu được sau nhiễm trùng là do hoạt hóa các tế bào B và T, đẫn đến tạo các tế bào nhớ. Hoạt động miễn dịch cũng có thể được tạo ra một cách nhân tạo, thông qua tiêm chủng. Tiêm vaccine là đưa kháng nguyên từ mầm bệnh để kích thích hệ miễn dịch và phát triển miễn dịch đặc hiệu chống lại mầm bệnh mà không gây ra bệnh liên quan đến mầm bệnh đó, chẳng hạn tiêm vaccine cúm không làm ta bị cúm. Sự kích thích nhân tạo này là thành công vì nó khai thác tính đặc hiệu tự nhiên của hệ thống miễn dịch, cũng như cảm ứng hệ miễn dịch hoạt động dựa trên những cơ chế của nó. Bệnh truyền nhiễm vẫn là một trong những nguyên nhân gây tử vong hàng đầu trong quần thể con người, vì vậy, có thể nói, tiêm vaccine đại diện cho sự điều khiển hệ thống miễn dịch hiệu quả nhất của mà nhân loại từng phát triển.[35][70]
Hầu hết các loại vaccine virus dùng các virus đã bị vô hiệu hóa, trong khi nhiều vaccine vi khuẩn dựa trên thành phần tế bào nhỏ của vi khuẩn, bao gồm các thành phần độc hại đã bị vô hiệu hóa.[14] Vì nhiều loại kháng nguyên có nguồn gốc từ vaccine"'không chứa tế bào" là không đủ mạnh để gây ra đáp ứng thu được, do vậy hầu hết các vaccine vi khuẩn đều được cung cấp thêm các chất bổ trợ để kích hoạt tế bào trình diện kháng nguyên của hệ thống miễn dịch bẩm sinh và tối đa hoá tính miễn dịch.[71]
Rối loạn miễn dịch ở người
[sửa | sửa mã nguồn]Hệ miễn dịch là một cấu trúc vô cùng hiệu quả kết hợp tính đặc hiệu, tính thích ứng và lợi dụng các đặc tính nhằm tăng tính miễn dịch. Tuy nhiên, hệ thống phòng thủ này vẫn xảy ra những sai hỏng, ta có thể chia vào ba phạm trù chính: suy giảm miễn dịch, bệnh tự miễn, và các đáp ứng quá mẫn.
Suy giảm miễn dịch
[sửa | sửa mã nguồn]Suy giảm miễn dịch xảy ra khi một hoặc nhiều thành phần của hệ miễn dịch không hoạt động. Khả năng đáp ứng của các hệ miễn dịch chống lại mầm bệnh là thấp hơn ở cả người trẻ và người cao tuổi, và đáp ứng miễn dịch bắt đầu suy giảm từ khoảng 50 tuổi do lão hóa miễn dịch tự nhiên.[72][73] Ở các nước phát triển, béo phì, nghiện rượu, và sử dụng ma túy là những nguyên nhân phổ biến dẫn đến chức năng miễn dịch kém.[73] Tuy nhiên, suy dinh dưỡng lại là nguyên nhân phổ biến nhất của suy giảm miễn dịch ở các nước đang phát triển.[73] Thức ăn thiếu chất đạm có liên quan đến miễn dịch qua trung gian qua tế bào, bổ thể, chức năng thực bào, nồng độ kháng thể IgA, và sản xuất cytokine. Ngoài ra, sự mất tuyến ức lúc trẻ do đột biến di truyền hoặc cắt bỏ phẫu thuật cũng dẫn đến suy giảm miễn dịch trầm trọng và dễ bị nhiễm trùng.[74]
Suy giảm miễn dịch cũng có thể được di truyền thừa kế (inheritance-phân biệt với genetic).[14] Bệnh u hạt mãn tính, bệnh mà thực bào giảm khả năng tiêu diệt các mầm bệnh, là một ví dụ về sự suy giảm miễn dịch do di truyền, hay suy giảm miễn dịch bẩm sinh. AIDS và một số loại ung thư gây ra tình trạng suy giảm miễn dịch thu được.[75][76]
Bệnh tự miễn
[sửa | sửa mã nguồn]Đáp ứng miễn dịch quá mức lại là thái cực còn lại của rối loạn chức năng miễn dịch, đặc biệt là các bệnh tự miễn. Lúc này, hệ thống miễn dịch không thể phân biệt chính xác giữa "của bản thân" và "không của bản thân", và tự tấn công một phần của chính cơ thể. Trong điều kiện bình thường, nhiều tế bào T và kháng thể phản ứng với các peptide của cơ thể [77]. Một trong những chức năng của việc biệt hóa các tế bào miễn dịch (ở tuyến ức và tủy xương) là đưa các lymphocyte non với các kháng nguyên được tạo ra trong cơ thể và sẽ loại bỏ các tế bào nhận ra các kháng nguyên của chính bản thân, nhằm hạn chế bệnh tự miễn.
Đáp ứng quá mẫn
[sửa | sửa mã nguồn]Đáp ứng quá mẫn là một đáp ứng miễn dịch mà gây tổn thương các mô của cơ thể. Chúng được chia thành bốn loại (từ I - IV) dựa trên các cơ chế liên quan và thời gian đáp ứng quá mẫn. Quá mẫn loại I là phản ứng tức thời còn gọi là phản vệ, thường liên quan đến dị ứng. Các triệu chứng có thể từ khó chịu nhẹ cho đến tử vong. Quá mẫn loại I do trung gian là kháng thể IgE, làm các tế bào phì và bạch cầu trung tính giải phóng hạt khi được liên kết ngang với kháng nguyên.[78] Quá mẫn loại II xảy ra khi các kháng thể gắn kết với kháng nguyên trên chính tế bào của bệnh nhân, đánh dấu chúng để tiêu hủy. Nó cũng được gọi là quá mẫn phụ thuộc kháng thể (hoặc quá mẫn gây độc tế bào), và do trung gian bởi các kháng thể IgG và IgM.[78] Các phức hợp miễn dịch (lắng kết của các kháng nguyên, các bổ thể, và các kháng thể IgG và IgM) tích tụ trong các mô khác nhau sẽ kích hoạt phản ứng quá mẫn loại III.[78] Quá mẫn loại IV (còn gọi là quá mẫn qua trung gian tế bào hoặc hay quá mẫn đình trệ-delayed type hypersensitivity) thường mất từ hai đến ba ngày để phát triển. Đáp ứng loại IV có liên quan đến nhiều bệnh tự miễn và nhiễm trùng nhưng cũng có thể liên quan đến bệnh viêm da tiếp xúc (dị ứng thường xuân). Những đáp ứng này được trung gian bởi tế bào T, bạch cầu đơn nhân và đại thực bào.[78]
Viêm tự phát
[sửa | sửa mã nguồn]Viêm là một trong những phản ứng đầu tiên của hệ miễn dịch đối với nhiễm trùng.[79] Nhưng nó có thể xuất hiện mà không rõ nguyên nhân.
Viêm được gây ra bởi các eicosanoid và các cytokine, được các tế bào bị thương hoặc nhiễm khuẩn phóng thích. Eicosanoid bao gồm prostaglandin gây ra sốt và giãn mạch máu liên quan đến chứng viêm, và leukotriene thu hút các bạch cầu nhất định.[80][81] Các cytokine thông thường bao gồm interleukin có trách nhiệm truyềnt tin giữa các tế bào bạch cầu; chemokine thúc đẩy hướng hóa; và interferon có tác dụng chống virus, chẳng hạn như ngừng tổng hợp protein trong tế bào chủ.[82] Các nhân tố sinh trưởng và các yếu tố độc tế bào cũng có thể được giải phóng. Những cytokine này và các hóa chất khác tuyển các tế bào miễn dịch vào vị trí nhiễm trùng và thúc đẩy việc chữa lành bất cứ mô nào bị tổn thương sau khi tiêu diệt các tác nhân gây bệnh.[83]
Một số cơ chế khác và tiến hóa
[sửa | sửa mã nguồn]Có khả năng là một hệ miễn dịch thích ứng và nhiều thành phần ngày nay đã khởi đầu ở các động vật có xương sống đầu tiên, vì động vật không xương sống không tạo ra tế bào lympho hoặc phản ứng thể dịch dựa trên kháng thể [1]. Tuy nhiên, cũng có nhiều loài sử dụng các cơ chế mà dường như là tiền thân của các khía cạnh này trong miễn dịch của động vật có xương sống. Hệ miễn dịch xuất hiện ngay cả trong các hình thức cấu trúc đơn giản nhất của sự sống, ví dụ với vi khuẩn sử dụng một cơ chế bảo vệ duy nhất, được gọi là hệ thống điều chỉnh hạn chế để tự bảo vệ mình khỏi các mầm bệnh virus, còn gọi là thực khuẩn thể.[84] Sinh vật nhân sơ cũng có khả năng miễn dịch, thông qua một hệ thống sử dụng các trình tự CRISPR để giữ lại các mảnh của bộ gen của thực khuẩn thể mà nó từng tiếp xúc với trong quá khứ, cho phép chúng ngăn chặn sự nhân lên của virus dưới dạng can thiệp RNA [85][86] Sinh vật nhân sơ cũng còn các cơ chế phòng thủ khác [87][88] Các yếu tố tấn công của hệ thống miễn dịch cũng có mặt ở sinh vật nhân chuẩn đơn bào, nhưng các nghiên cứu về vai trò của chúng trong phòng vệ còn rất hạn chế.[89]
Thụ thể nhận dạng khuôn mẫu (Pattern recognition receptor) là các protein được sử dụng bởi gần như tất cả các sinh vật để xác định các phân tử liên quan đến các mầm bệnh. Các peptide kháng khuẩn được gọi là defensin là thành phần bảo thủ trong tiến hóa của đáp ứng miễn dịch bẩm sinh, được tìm thấy ở tất cả các động vật và thực vật và thể hiện cho dạng chính của miễn dịch ở động vật không xương sống. Hệ thống bổ thể và thực bào cũng được sử dụng bởi hầu hết các dạng của động vật không xương sống. Ribonuclease (enzyme sẽ thủy phân RNA) và con đường can thiệp RNA được bảo tồn trên tất cả các sinh vật nhân thực, và được cho là có vai trò trong phản ứng miễn dịch đối với virus.[90]
Không giống như động vật, thực vật không có tế bào thực bào, nhưng nhiều phản ứng miễn dịch thực vật liên quan đến tín hiệu hóa học hệ thống được gửi qua cây.[91] Các tế bào thực vật riêng biệt đáp ứng với các phận tử liên quan đến các mầm bệnh gọi là mô hình phân tử liên quan đến mầm bệnh (Pathogen-associated molecular pattern viết tắt là PAMP).[92] Khi một phần của cây bị nhiễm bệnh, cây sẽ đáp ứng quá mẫn cục bộ, nhờ đó các tế bào ở vị trí nhiễm trùng bị chết theo chương trình nhanh chóng để ngăn sự lây lan của bệnh đến các bộ phận khác của cây. Hệ thống cảm ứng kháng bệnh thu được hay SAR (Systemic acquisition resistance) là một loại phản ứng phòng vệ được sử dụng bởi các thực vât làm cho toàn bộ cây có khả năng chống lại một tác nhân gây bệnh đặc biệt.[91] Các cơ chế làm tắt RNA đặc biệt quan trọng trong phản ứng có hệ thống này vì chúng có thể ngăn chặn sự nhân lên của virus.[93]
Miễn dịch học khối u
[sửa | sửa mã nguồn]
Một vai trò quan trọng khác của hệ thống miễn dịch là xác định và loại bỏ khối u. Đây được gọi là giám sát miễn dịch. Các tế bào chuyển dạng của các khối u sẽ biểu hiện các kháng nguyên không tìm thấy trên các tế bào bình thường. Đối với hệ thống miễn dịch, các kháng nguyên này là ngoại lai, sự hiện diện của chúng làm các tế bào miễn dịch tấn công các tế bào khối u chuyển dạng. Các kháng nguyên biểu hiện bởi các khối u có nhiều nguồn,[95] một số xuất phát từ các virus gây ung thư như papillomavirus ở người, gây ra ung thư cổ tử cung,[96] trong khi ở một số khác thì do sai khác về nồng độ protein, thường là tế bào khối u với nồng độ protein cao đột biến. Một ví dụ là một enzyme được gọi là tyrosinase (điều khiển tổng hợp sắc tố melanin), khi biểu hiện ở mức cao, sẽ chuyển dạng một số tế bào da (ví dụ như tế bào hắc tố) thành các khối u ác tính (ung thư hắc tố).[97][98] Một nguồn tiềm năng thứ ba của các kháng nguyên khối u, là các protein bình thường quan trọng điều chỉnh sự tăng trưởng và sống sót của tế bào, thường đột biến thành các phần tử gây ra ung thư gọi là gen sinh ung thư.[95][99][100]
Phản ứng chính của hệ thống miễn dịch đối với các khối u là tiêu hủy các tế bào bất thường bằng cách sử dụng các tế bào T độc, đôi khi với sự trợ giúp của các tế bào T hỗ trợ.[98][101] Các kháng nguyên khối u được trình diện trên các phân tử MHC I loại tương tự như các kháng nguyên virus. Điều này cho phép các tế bào T độc nhận ra tế bào khối u là bất thường.[102] Các tế bào giết tự nhiên cũng triệt hạ các tế bào ung thư một cách tương tự, đặc biệt nếu các tế bào khối u có ít MHC lớp I trên bề mặt của chúng hơn bình thường; đây là một hiện tượng phổ biến với các khối u.[103] Đôi khi các kháng thể được tạo ra để chống lại tế bào khối u, cho phép chúng phá huỷ bởi hệ thống bổ thể.[99]
Có một điều rất rõ ràng, một số khối u trốn thoát hệ thống miễn dịch và tiến đến trở thành bệnh ung thư.[104][105] Các tế bào khối u thường có một lượng giảm các phân tử MHC lớp I trên bề mặt của chúng, do đó tránh phát hiện bởi các tế bào T độc.[102][104] Một số tế bào khối u cũng giải phóng các sản phẩm ức chế đáp ứng miễn dịch; ví dụ bằng cách giải phóng cytokine TGF-β, làm ức chế hoạt động của các đại thực bào và lymphocyte.[104][106] Ngoài ra, dung nạp miễn dịch có thể phát triển chống lại kháng nguyên khối u, do đó, hệ thống miễn dịch không còn tấn công các tế bào khối u [104][105]
Rất nghịch lý là, các đại thực bào có thể thúc đẩy phát triển khối u [107] khi tế bào khối u phát ra các cytokine thu hút các đại thực bào, sau đó tạo ra các cytokine và các yếu tố tăng trưởng như yếu tố hoại tử khối u-alpha (TNF-alpha) nuôi dưỡng sự phát triển khối u hoặc tăng sự dẻo dai của tế bào giống tế bào gốc[104] Ngoài ra, sự kết hợp của giảm oxy trong khối u và cytokine do các đại thực bào tạo ra làm cho các tế bào khối u giảm sản xuất một protein ngăn chặn di căn và do đó giúp phát tán các tế bào ung thư.[104]
Điều tiết sinh lý và miễn dịch
[sửa | sửa mã nguồn]Hệ miễn dịch có liên quan mật thiết đến nhiều khía cạnh của sự điều tiết sinh lý trong cơ thể. Hệ miễn dịch cũng tương tác chặt chẽ với các hệ thống khác, như hệ nội tiết [108][109] và hệ thần kinh.[110][111][112] Hệ miễn dịch cũng đóng một vai trò quan trọng trong sự phát triển của phôi thai, cũng như trong việc sửa chữa và tái tạo mô.
Hormone
[sửa | sửa mã nguồn]Hormone có thể hoạt động như một bộ điều hoà miễn dịch, giúp thay đổi độ nhạy cảm của hệ miễn dịch. Ví dụ, các hormone sinh dục nữ có thể sử dụng như các chất kích thích miễn dịch của cả đáp ứng miễn dịch thu được [113] và đáp ứng miễn dịch bẩm sinh.[114] Một số bệnh tự miễn như lupus ban đỏ thường hay gặp ở phụ nữ hơn, và thường khởi phát ở tuổi dậy thì. Ngược lại, các hormone giới tính nam như testosterone lại là chất ức chế miễn dịch.[115] Một số hormone khác cũng có thể điều chỉnh hệ miễn dịch, đặc biệt là prolactin, hormone tăng trưởng (GH) và vitamin D.[116][117]
Vitamin D
[sửa | sửa mã nguồn]Khi một tế bào T gặp một mầm bệnh ngoại lai, nó sẽ mở ra thụ thể vitamin D (VDR). Đây là tín hiệu quan trọng cho phép tế bào T liên kết với dạng hoạt động của vitamin D, là hormone steroid calcitriol (1 vitamin D gắn 3 nhóm hydroxyl). Các tế bào T có quan hệ gần giống "cộng sinh" với vitamin D. Tế bào T không chỉ mở ra thụ thể vitamin D, để kết hợp với dạng hormone của vitamin D là calcitriol mà tế bào T còn có thể biểu hiện gen CYP27B1, đó là gen chịu trách nhiệm chuyển đổi tiền-hormone của vitamin D, calcidiol thành hormone steroid, calcitriol. Chỉ sau khi kết hợp với calcitriol thì tế bào T mới có thể thực hiện chức năng dự định của chúng. Một số tế bào miễn dịch khác cũng biểu hiện CYP27B1 là các tế bào nhiều nhánh, tế bào sừng (keratinocyte) và đại thực bào [118][119]
Người ta suy đoán rằng sự giảm dần nồng độ hormone cùng với tăng tuổi tác là một nguyên nhân gây ra đáp ứng miễn dịch suy yếu ở những người già.[120] Ngược lại, một số hormone lại được điều chỉnh bởi hệ miễn dịch, đặc biệt là hoạt động của hormone tuyến giáp.[121] Sự suy giảm chức năng miễn dịch liên quan đến tuổi cũng liên quan đến việc giảm mức vitamin D ở người cao tuổi. Khi con người già đi, có hai điều xảy ra ảnh hưởng xấu đến lượng vitamin D của họ. Thứ nhất, người già ở trong nhà nhiều hơn do giảm hoạt động. Điều này cũng có nghĩa là họ ít chịu tác động bởi ánh sáng mặt trời và do đó sản sinh ra ít hơn vitamin D3 qua bức xạ UV. Thứ hai, khi một người già đi, da trở nên ít chuyên hóa hơn trong việc sản xuất vitamin D.[122]
Ngủ và nghỉ
[sửa | sửa mã nguồn]Hệ miễn dịch cũng bị ảnh hưởng bởi ngủ và nghỉ,[123] và thiếu ngủ là vô cùng hại cho chức năng miễn dịch.[124] Các vòng phản hồi phức tạp liên quan đến các cytokine, như interleukin-1 và yếu tố hoại tử khối u-α sản xuất để đáp ứng với nhiễm trùng, cũng có vai trò trong việc điều chỉnh giai đoạn ngủ chập chờn (non-REM).[125] Do đó đáp ứng miễn dịch với nhiễm trùng có thể dẫn đến thay đổi chu kỳ ngủ, bao gồm cả tăng giấc ngủ chập chờn so với giấc ngủ sâu.[126]
Khi bị thiếu ngủ, tạo miễn dịch chủ động có thể khó khăn hơn và có thể dẫn đến sản xuất kháng thể không cao và đáp ứng miễn dịch thấp hơn so với những người ngủ bình thường. Ngoài ra, các protein như NFIL3 (có liên quan chặt chẽ với sự biệt hóa các tế bào T và nhịp sinh học) có thể bị ảnh hưởng bởi sự thay đổi của nhịp sáng-tối tự nhiên trong các trường hợp thiếu ngủ, thay đổi ca làm việc... kết quả là những sự gián đoạn này có thể dẫn đến sự gia tăng các bệnh mãn tính như bệnh tim, đau mãn tính, và hen suyễn.[127]
Ngoài các hậu quả tiêu cực của việc thiếu ngủ, giấc ngủ và nhịp sinh học đã cho thấy có những ảnh hưởng điều chỉnh mạnh mẽ đối với các chức năng miễn dịch của cả miễn dịch bẩm sinh và thích nghi. Thứ nhất, trong giai đoạn đầu của ngủ sâu-SWS, sự giảm nồng độ cortisol, epinephrine và norepinephrine trong máu sẽ làm tăng nồng độ hormone leptin, hormone tăng trưởng tuyến yên và prolactin. Những tín hiệu này tạo ra trạng thái viêm hệ thống (pro-imflammatory) thông qua việc sản sinh các cytokine: pro-interleukin-1, interleukin-12, TNF-alpha và IFN-gamma. Những cytokine sau đó sẽ kích thích chức năng miễn dịch như hoạt hóa tế bào miễn dịch, tăng sinh và biệt hóa. Trong thời gian này mà các tế bào chưa biệt hóa, hoặc ít biệt hóa (giống như các tế bào T nhớ non và T nhớ trung tâm) sẽ đạt đỉnh (cụ thể hơn là trong thời gian này, đáp ứng miễn dịch thu được đang sẽ chậm hơn). Ngoài các tác động này, môi trường cơ thể do các hormone được sản xuất tại thời điểm này (leptin, hormone tăng trưởng tuyến yên và prolactin) sẽ hỗ trợ sự tương tác giữa tế bào trình diện kháng nguyên và tế bào T, sự dịch chuyển cân bằng cytokine Th1 / Th2 về bên Th1, tăng số lượng chung của tế bào Th, và tế bào T non sẽ đi đến các hạch bạch huyết. Môi trường này cũng được cho là hỗ trợ sự hình thành trí nhớ miễn dịch lâu dài thông qua việc bắt đầu các phản ứng miễn dịch Th1.[128]
Ngược lại, trong thời gian thức, các tế bào tác dụng biệt hóa, như các tế bào giết tự nhiên và tế bào lympho T độc, sẽ đạt đỉnh để tạo ra đáp ứng hiệu quả chống lại bất kỳ mầm bệnh xâm nhập nào. Cũng như trong thời gian hoạt động tích cực, các phân tử chống viêm, như cortisol và catecholamine, sẽ đạt đỉnh. Có hai lý thuyết để giải thích tại sao trạng thái viêm hệ thống được dành riêng cho thời gian ngủ. Thứ nhất, viêm sẽ gây ra sự suy giảm nhận thức và thể chất nghiêm trọng nếu nó xảy ra trong suốt thời gian thức. Thứ hai, viêm có thể xảy ra trong thời gian ngủ do sự hiện diện của melatonin-một horrmone điều hòa nhịp sinh học. Viêm gây ra rất nhiều stress oxy hóa và sự hiện diện của melatonin trong thời gian ngủ có thể tích cực chống lại quá trình sản sinh gốc tự do trong thời gian này.[128][129]
Dinh dưỡng và chế độ ăn uống
[sửa | sửa mã nguồn]Suy dinh dưỡng liên quan đến các bệnh như tiểu đường và béo phì, được biết là ảnh hưởng đến chức năng miễn dịch. Suy dinh dưỡng trung bình, cũng như thiếu hụt một số khoáng chất vi lượng và chất dinh dưỡng, cũng có thể ảnh hưởng đến đáp ứng miễn dịch.[130]
Thực phẩm giàu một số axit béo nhất định có thể thúc đẩy hệ thống miễn dịch khỏe mạnh.[131] Tương tự như vậy, suy dinh dưỡng thai nhi có thể gây suy yếu hệ thống miễn dịch suốt đời.[132]
Sửa chữa và phục hồi mô
[sửa | sửa mã nguồn]Hệ miễn dịch, đặc biệt là các thành phần của hệ bẩm sinh, đóng một vai trò quyết định trong việc sửa chữa mô sau khi bị thương [133][134][135][136][137] Các tác nhân chủ chốt bao gồm các đại thực bào và bạch cầu trung tính, nhưng các tế bào khác, như các tế bào T γδ, tế bào lympho bẩm sinh (ILC) và các tế bào T điều hòa cũng rất quan trọng. Sự dẻo dai các tế bào miễn dịch và sự cân bằng giữa các tín hiệu viêm hệ thống và chống viêm là các khía cạnh quan trọng trong việc sửa chữa mô hiệu quả [137]. Các thành phần miễn dịch và các con đường cũng tham gia vào quá trình phục hồi, ví dụ ở động vật lưỡng cư. Theo một giả thuyết, các sinh vật có thể tái tạo các bộ phận trên cơ thể (ví dụ như thạch sùng) có đáp ứng miễn dịch kém hơn các sinh vật không thể tái tạo được [138][139]
Tác động của dược phẩm
[sửa | sửa mã nguồn]
Đáp ứng miễn dịch có thể được điều khiển để ngăn chặn các đáp ứng không mong muốn như bệnh tự miễn, dị ứng, và thải loại mảnh ghép (trong cấy ghép nội tạng), hoặc kích thích các đáp ứng bảo vệ để chống lại các mầm bệnh mà phần lớn đang lọt qua hệ miễn dịch (xem Tiêm chủng) hoặc ung thư.
Ức chế miễn dịch
[sửa | sửa mã nguồn]Thuốc ức chế miễn dịch thường được sử dụng để kiểm soát bệnh tự miễn hoặc đáp ứng viêm khi mô bị tổn thương quá mức, hoặc để ngăn chặn việc thải loại mảnh ghép sau khi ghép tạng.[35][140]
Thuốc chống viêm thường được sử dụng để kiểm soát tác động của viêm. Glucocorticoid là thuốc mạnh nhất trong số những thuốc này; tuy nhiên, thuốc này có thể có nhiều tác dụng phụ không mong muốn, như béo phì vùng bụng, cao đường huyết, loãng xương, và việc sử dụng phải được kiểm soát chặt chẽ [141]. Các liều thấp hơn của thuốc chống viêm thường được sử dụng kết hợp với thuốc gây độc tế bào hoặc thuốc ức chế miễn dịch như methotrexate hoặc azathioprine. Thuốc gây độc tế bào ức chế đáp ứng miễn dịch bằng cách giết các tế bào đang phân chia như tế bào T hoạt hóa. Tuy nhiên, việc "giết" này không chính xác; các tế bào phân chia liên tục khác và các cơ quan cũng có thể bị ảnh hưởng khiến tạo ra các phản ứng phụ nguy hiểm.[140] Các thuốc ức chế miễn dịch như cyclosporin ngăn không cho tế bào T trả lời chính xác các tín hiệu bằng cách ức chế các con đường dẫn truyền tín hiệu.[142]
Tăng cường miễn dịch
[sửa | sửa mã nguồn]Liệu pháp miễn dịch ung thư gồm các phương pháp y học để kích thích hệ thống miễn dịch để tấn công các khối u ác tính.
Các phương pháp lý thuyết để tiếp cận hệ miễn dịch
[sửa | sửa mã nguồn]Miễn dịch học là bộ môn mang tính thực nghiệm mạnh mẽ, nhưng cũng được đặc trưng bởi những quan điểm, lý thuyết liên tục được đề xuất. Nhiều lý thuyết đã được đề xuất liên quan đến miễn dịch học từ cuối thế kỷ XIX đến thời điểm hiện tại. Cuối của thế kỷ 19 và đầu thế kỷ 20 đã chứng kiến một cuộc "so găng" giữa hai lý thuyết: "tế bào" và "thể dịch" về miễn dịch. Theo lý thuyết miễn dịch "tế bào", với đại diện nổi bật là Elie Metchnikoff, cho rằng: chính các tế bào - hay chính xác hơn, các tế bào thực bào - có trách nhiệm trong đáp ứng miễn dịch. Ngược lại, lý thuyết miễn dịch "thể dịch", được Robert Koch và Emil von Behring ủng hộ, cho rằng: tác nhân đáp ứng miễn dịch phải là các thành phần (hay phân tử) hòa tan được tìm thấy trong các "thể dịch" (dịch của cơ thể) hơn là trong các tế bào.[143][144][145]
Vào giữa những năm 1950, Frank Burnet, lấy cảm hứng từ một gợi ý của Niels Jerne,[146] đã xây dựng lý thuyết lựa chọn dòng (clonal selection theory hay CST).[147] Trên cơ sở CST, Burnet đã phát triển một lý thuyết về làm thế nào đáp ứng miễn dịch được kích hoạt bằng sự phân biệt "của bản thân/không của bản thân": các thành phần của bản thân (thành phần cấu tạo của cơ thể) thì không gây ra đáp ứng miễn dịch 'tiêu diệt', trong khi các thành phần không của bản thân (mầm bệnh, hay mảnh ghép dị loại-allograft) sẽ kích hoạt một phản ứng miễn dịch 'tiêu diệt'.[148] Lý thuyết này sau đó đã được sửa đổi để phù hợp với các phát hiện mới về phức hệ hòa hợp mô chính hay sự hoạt hóa "song tín hiệu" phức tạp của các tế bào T.[149] Lý thuyết miễn dịch "của bản thân/không của bản thân" đã bị chỉ trích,[145][150][151] nhưng vẫn rất có ảnh hưởng.[152][153]
Gần đây hơn, một số lý thuyết đã được đề xuất trong miễn dịch học, bao gồm các quan điểm như "tự sinh" (autopoiesis),[154] quan niệm "miễn dịch nhận thức" (cognitive immune),[155] "mô hình nguy hiểm" (danger model),[150] và thuyết "gián đoạn"(discontinuity).[156][157][158] "Mô hình nguy hiểm", được đề xuất bởi Polly Matzinger và các đồng nghiệp, đã có ảnh hưởng lớn, gây ra nhiều ý kiến và thảo luận.[159][160][161][162]
Dự đoán khả năng sinh miễn dịch
[sửa | sửa mã nguồn]Những thuốc lớn (> 500 Dalton) có thể dẫn đến đáp ứng miễn dịch làm trung hòa thuốc, đặc biệt nếu dùng thuốc nhiều lần, hoặc với liều lớn hơn. Điều này làm hạn chế hiệu quả của các thuốc với bản chất là peptide và protein khá lớn (loại này thường >6000 Da). Trong một số trường hợp, bản thân thuốc không gây miễn dịch, nhưng được pha chế cùng các chất gây miễn dịch, như trường hợp của Taxol. Các phương pháp tính toán trên các phần mềm đã được phát triển để tiên đoán khả năng gây miễn dịch của peptide và protein, đặc biệt hữu ích trong việc thiết kế các kháng thể trị liệu, đánh giá độc lực của các thể đột biến ở các tiểu phần trên vỏ virus và xác nhận các phương pháp điều trị sử dụng thuốc peptide được đề xuất. Các kỹ thuật ban đầu dựa chủ yếu vào việc quan sát thấy các amino acid ưa nước rất điển hình ở các vùng epitope hơn các amino acid không ưa nước.[163] Tuy nhiên, những cải tiến gần đây dựa vào các kỹ thuật máy tính sử dụng cơ sở dữ liệu của các epitope hiện có, thường là trên các protein virus được nghiên cứu kỹ, còn gọi là dữ liệu huấn luyện.[164] Một ngân hàng dữ liệu có thể truy cập công cộng đã được thiết lập cho việc biên mục các epitope từ các mầm bệnh mà các tế bào B có thể nhận biết được.[165] Các địa hạt đang nổi lên dựa trên các nghiên cứu của tin sinh học về miễn dịch học được gọi là miễn dịch thông tin học (immunoinformatic).[166] Phân ngành miễn dịch protein học (immunoproteomic) là nghiên cứu của số lượng lớn protein (proteomic) tham gia vào đáp ứng miễn dịch.
Tác động của mầm bệnh
[sửa | sửa mã nguồn]Sự thành công của bất kỳ mầm bệnh nào phụ thuộc vào khả năng lách qua các phản ứng miễn dịch của vật chủ. Do đó, các mầm bệnh đã phát triển một số phương pháp cho phép chúng lây nhiễm thành công vật chủ, trong khi tránh được sự phát hiện hoặc phá hủy bởi hệ miễn dịch.[167] Vi khuẩn thường vượt qua các hàng rào vật lý bằng cách giải phóng các enzyme phân giải hàng rào, ví dụ bằng cách sử dụng hệ thống tiết kiểu II (T2SS) ở vi khuẩn Gram (-).[168] Ngoài ra, sử dụng hệ thống tiết kiểu III (T3SS), chúng có thể "tiêm" một ống rỗng vào tế bào chủ, tạo ra một đường dẫn trực tiếp cho các protein di chuyển từ mầm bệnh sang vật chủ. Những protein này thường được sử dụng để đánh sập hệ thống phòng thủ.[169]
Một chiến thuật để "lách" hệ miễn dịch bẩm sinh khác được sử dụng bởi một số mầm bệnh là ẩn mình trong các tế bào của vật chủ (còn gọi là sinh bệnh nội bào hay intracellular pathogenesis). Ở đây, một mầm bệnh dành phần lớn vòng đời của nó trong tế bào chủ, vậy là nó được bảo vệ, không tiếp xúc trực tiếp với các tế bào miễn dịch, kháng thể và bổ thể. Một số ví dụ về các tác nhân sinh bệnh nội bào có thể kể đến như virus, vi khuẩn gây ngộ độc thực phẩm Salmonella và ký sinh trùng nhân thực gây bệnh sốt rét (Plasmodium falciparu)) và bệnh do Leishmania (Leishmania spp.). Các vi khuẩn khác, như Mycobacterium tuberculosis, sống trong một màng bảo vệ để ngăn ngừa sự làm tan do bổ thể.[170] Nhiều mầm bệnh tiết ra các hợp chất làm giảm hoặc làm lệch đáp ứng miễn dịch của vật chủ.[167] Một số vi khuẩn hình thành màng sinh học để bảo vệ bản thân khỏi các tế bào và các protein của hệ miễn dịch. Những màng sinh học này thường có mặt trong các trường hợp nhiễm trùng thành công, ví dụ như Pseudomonas aeruginosa mãn tính và nhiễm Burkholderia cenocepacia đặc trưng của xơ nang.[171] Một số vi khuẩn khác tạo ra các protein bề mặt gắn kết với các kháng thể, vô hiệu hóa chúng; ví dụ như Streptococcus (protein G), Staphylococcus aureus (protein A), và Peptostreptococcus magnus (protein L).[172]
Các cơ chế được sử dụng để né tránh hệ thống miễn dịch thu được thì phức tạp hơn. Cách tiếp cận đơn giản nhất là liên tục thay đổi các epitope không cần thiết (các amino acid và/hoặc đường) trên bề mặt của mầm bệnh, trong khi giữ các epitope quan trọng thì được giấu kín. Đây được gọi là biến thể kháng nguyên (antigenic variation). Một ví dụ là HIV, virus này đột biến rất nhanh, do đó, các protein trên vỏ virus (mà cần thiết để xâm nhập vào tế bào đích của vật chủ) không ngừng thay đổi. Sự biến thể kháng nguyên liên tục này có thể giải thích vì sao vaccine lại thất bại đối với virus này.[173] Ký sinh trùng Trypanosoma brucei sử dụng một chiến lược tương tự, liên tục biến đổi loại protein bề mặt này thành một loại protein khác, cho phép nó luôn đi trước một bước trước phản ứng kháng thể.[174] Che đậy kháng nguyên bằng các phân tử của vật chủ là một chiến lược phổ biến khác để tránh sự phát hiện của hệ thống miễn dịch. Ở HIV, vỏ bọc virion có nguồn gốc từ màng sinh chất của tế bào chủ; những loại virus "tự giấu mình" như vậy làm cho hệ thống miễn dịch rất khó xác định được chúng là những cấu trúc "không của bản thân".[175]
Xem thêm
[sửa | sửa mã nguồn]Tham khảo
[sửa | sửa mã nguồn]- ^ a b Beck G, Habitat GS (tháng 11 năm 1996). "Immunity and the Invertebrates" (Miễn dịch và ĐV không xương sống) (PDF). Scientific American. 275 (5): 60–66. doi:10.1038/scientificamerican1196-60. Truy cập 1 tháng 1 2007.
- ^ O'Byrne KJ, Dalgleish AG (Aug 2001). "Chronic immune activation and inflammation as the cause of malignancy".("Kích thích hệ miễn dịch và viêm liên tục là nguyên nhân gây nên ác tính") British Journal of Cancer. 85 (4): 473–83. doi:10.1054/bjoc.2001.1943. PMC 2364095 . PMID 11506482.
- ^ Retief FP, Cilliers L (tháng 1 năm 1998). "The epidemic of Athens, 430-426 BC" (Đại dịch ở Athens, 430-426 trước CN). South African Medical Journal = Suid-Afrikaanse Tydskrif Vir Geneeskunde. 88 (1): 50–3. PMID 9539938
- ^ Ostoya P (1954). "Maupertuis et la biologie". "Maupertuis và Sinh học" Revue d'histoire des sciences et de leurs applications. 7 (1): 60–78. doi:10.3406/rhs.1954.3379.
- ^ Plotkin SA (tháng 4 năm 2005). "Vaccines: past, present and future" (Vắc-xin hiện tại và tương lai). Nature Medicine.11 (4 Suppl): S5–11. doi:10.1038/nm1209. PMID 15812490
- ^ The Nobel Prize in Physiology or Medicine 1905 (Giải Nobel cho Tâm lý học và dược học 1905) Nobelprize.org Truy cập 8 tháng 1 năm 2009.
- ^ Major Walter Reed, Medical Corps, U.S. Army (Tập đoạn dược, quân đội Mỹ) Walter Reed Army Medical Center. Truy cập 8 tháng 1 năm 2007.
- ^ Metchnikoff, Elie; Dịch bởi F.G. Binnie. (1905). Immunity in Infective Diseases (Miễn dịch bệnh truyền nhiễm) (Full Text Version: Google Books). Cambridge University Press. LCCN 68025143
- ^ The Nobel Prize in Physiology or Medicine 1908 (Giải Nobel cho Sinh lý học và dược học năm 1908) Nobelprize.org Truy cập 8 tháng 1 năm 2007
- ^ a b Litman GW, Cannon JP, Dishaw LJ (tháng 11 năm 2005). "Reconstructing immune phylogeny: new perspectives"(Góc nhìn mới, tái cấu trúc và tiến hóa của miễn dịch). Nature Reviews. Immunology. 5 (11): 866–79. doi:10.1038/nri1712. PMC 3683834 . PMID 16261174.
- ^ Restifo NP, Gattinoni L (tháng 10 năm 2013). "Lineage relationship of effector and memory T cells" (Mối liên kết giữa chất ảnh hưởng và TB T nhớ). Current Opinion in Immunology.25 (5): 556–63. doi:[ 10.1016/j.coi.2013.09.003]. PMC 3858177 . PMID 24148236.
- ^ Kurosaki T, Kometani K, Ise W (tháng 3 năm 2015). "Memory B cells" (Tế bào B nhớ). Nature Reviews. Immunology. 15 (3): 149–59. doi:10.1038/nri3802. PMID 25677494.
- ^ Smith A.D. (Ed) Oxford dictionary of biochemistry and molecular biology. (Từ điển Oxford về hóa sinh và sinh học phân tử) (1997) Oxford University Press. ISBN 0-19-854768-4
- ^ a b c d e f g h Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walters P (2002). Molecular Biology of the Cell (Sinh học phân tử của tế bào) (Tái bản lần 4). New York and London: Garland Science. ISBN 978-0-8153-3218-3.
- ^ Medzhitov R (tháng 10 năm 2007). "Recognition of microorganisms and activation of the immune response" (Nhận diện vi sinh vật và kích hoạt đáp ứng miễn dịch). Nature. 449 (7164): 819–26.
- ^ Matzinger P (tháng 4 năm 2002). "The danger model: a renewed sense of self" (Mô hình nguy hiểm: cảm nhận mới của chính cơ thể) (PDF).Science. 296 (5566): 301–5. Bibcode:2002Sci...296..301M.doi:10.1126/science.1071059. PMID 11951032.
- ^ Boyton RJ, Openshaw PJ (2002). "Pulmonary defences to acute respiratory infection" (Bảo vệ phổi đối với nhiễm trùng hô hấp cấp). British Medical Bulletin. 61 (1): 1–12. doi:10.1093/bmb/61.1.1.PMID 11997295.
- ^ Agerberth B, Gudmundsson GH (2006). "Host antimicrobial defence peptides in human disease"(Peptide kháng khuẩn bảo vệ ở các bệnh ở người). Current Topics in Microbiology and Immunology. Current Topics in Microbiology and Immunology. 306: 67–90. doi:10.1007/3-540-29916-5_3.ISBN 978-3-540-29915-8. PMID 16909918
- ^ Moreau JM, Girgis DO, Hume EB, Dajcs JJ, Austin MS, O'Callaghan RJ (tháng 9 năm 2001). "Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus".(Phospholipase A (2) trong nước mắt của thỏ: sự phòng vệ vật chủ đối với tụ cầu khuẩn màu vàng) Investigative Ophthalmology & Visual Science. 42(10): 2347–54. PMID 11527949
- ^ Hankiewicz J, Swierczek E (tháng 12 năm 1974). "Lysozyme in human body fluids" (Lysozyme trong dịch cơ thể).Clinica Chimica Acta; International Journal of Clinical Chemistry. 57 (3): 205–9.doi:10.1016/0009-8981(74)90398-2. PMID 4434640
- ^ Fair WR, Couch J, Wehner N (tháng 2 năm 1976). "Prostatic antibacterial factor. Identity and significance" (Yếu tố kháng khuẩn tuyến tiền liệt: nhận diện và vai trò). Urology. 7 (2): 169–77. doi:10.1016/0090-4295(76)90305-8.PMID 54972
- ^ Yenugu S, Hamil KG, Birse CE, Ruben SM, French FS, Hall SH (tháng 6 năm 2003)."Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli".(Tính chất kháng khuẩn của các protein gắn kết tinh trùng và các họ peptide của mào tinh hoàn (HE2); độ nhạy của muối, sự phụ thuộc cấu trúc và sự tương tác của chúng với các màng ngoài và tế bào chất của Escherichia coli) The Biochemical Journal. 372 (Pt 2): 473–83. doi:10.1042/BJ20030225
- ^ Gorbach SL (tháng 2 năm 1990). "Lactic acid bacteria and human health" (Vi khuẩn lactic và sức khỏe con người). Annals of Medicine. 22 (1): 37–41. doi:10.3109/07853899009147239. PMID 2109988
- ^ Hill LV, Embil JA (tháng 2 năm 1986). "Vaginitis: current microbiologic and clinical concepts" (Viêm âm đạo: các khái niệm vi sinh và lâm sàng hiện tại). CMAJ. 134 (4): 321–31. PMC 1490817 . PMID 3510698
- ^ Reid G, Bruce AW (tháng 8 năm 2003). "Urogenital infections in women: can probiotics help?" (Đường sinh dục nhiễm trùng ở phụ nữ: probiodic có thể giúp đỡ?). Postgraduate Medical Journal. 79 (934): 428–32.doi:10.1136/pmj.79.934.428. PMC 1742800 . PMID 1295495
- ^ Salminen SJ, Gueimonde M, Isolauri E (tháng 5 năm 2005). "Probiotics that modify disease risk".(Probiodic thay đổi nguy cơ bệnh) The Journal of Nutrition. 135 (5): 1294–8. PMID 15867327
- ^ Reid G, Jass J, Sebulsky MT, McCormick JK (tháng 10 năm 2003). "Potential uses of probiotics in clinical practice".(Cơ hội sử dụng probiodic trên thực tế lâm sàng) Clinical Microbiology Reviews. 16 (4): 658–72.doi:10.1128/CMR.16.4.658-672.2003. PMC 207122 . PMID 14557292
- ^ Kawai T, Akira S (Feb 2006). "Innate immune recognition of viral infection" (Miễn dịch bẩm sinh nhận diện nhiễm virus).Nature Immunology. 7 (2): 131–7. doi:10.1038/ni1303. PMID 16424890
- ^ Miller SB (Aug 2006). "Prostaglandins in health and disease: an overview" (Tổng quan prostaglandin trong sức khỏe và bệnh tật).Seminars in Arthritis and Rheumatism. 36 (1): 37–49.doi:10.1016/j.semarthrit.2006.03.005. PMID 16887467
- ^ Ogawa Y, Calhoun WJ (Oct 2006). "The role of leukotrienes in airway inflammation" (Vai trò của bạch cầu trong viêm khí quản). The Journal of Allergy and Clinical Immunology. 118 (4): 789–98; quiz 799–800. doi:10.1016/j.jaci.2006.08.009. PMID 17030228
- ^ Le Y, Zhou Y, Iribarren P, Wang J (Apr 2004). "Chemokines and chemokine receptors: their manifold roles in homeostasis and disease" ("Chemokine và thụ thể chemokine: vai trò đa dạng của chúng trong cân bằng nội môi và bệnh) (PDF). Cellular & Molecular Immunology. 1 (2): 95–104. PMID 16212895.
- ^ Martin P, Leibovich SJ (Nov 2005). "Inflammatory cells during wound repair: the good, the bad and the ugly" (Tế bào viêm trong khi vết thương hồi phục: lợi, hại và xấu xa). Trends in Cell Biology. 15 (11): 599–607.doi:10.1016/j.tcb.2005.09.002. PMID 16202600.
- ^ a b Rus H, Cudrici C, Niculescu F (2005). "The role of the complement system in innate immunity" (Vai trò bổ thể trong hệ miễn dịch bẩm sinh). Immunologic Research. 33 (2): 103–12. doi:10.1385/IR:33:2:103. PMID 16234578
- ^ Degn SE, Thiel S (August 2013). "Humoral pattern recognition and the complement system" (Nhận diện thể dịch và hệ thống bổ thể). Scandinavian Journal of Immunology. 78 (2): 181–93. doi:10.1111/sji.12070. PMID 23672641
- ^ a b c d Janeway CA, Jr. (2005). Immunobiology (Sinh học miễn dịch) (6th ed.). Garland Science. ISBN 0-443-07310-4.
- ^ Liszewski MK, Farries TC, Lublin DM, Rooney IA, Atkinson JP (1996). "Control of the complement system" (Sự điều khiển của hệ thống bổ thể). Advances in Immunology. Advances in Immunology. 61: 201–83. doi:10.1016/S0065-2776(08)60868-8. ISBN 978-0-12-022461-6. PMID 883449
- ^ Sim RB, Tsiftsoglou SA (Feb 2004). "Proteases of the complement system" (Thủy phân Protein trong hệ thống bổ thể) (PDF). Biochemical Society Transactions. 32 (Pt 1): 21–7. doi:10.1042/BST0320021. PMID 14748705.
- ^ May RC, Machesky LM (Mar 2001). "Phagocytosis and the actin cytoskeleton".(Thực bào và sợi actin của bộ khung xương TB) Journal of Cell Science. 114 (Pt 6): 1061–77. PMID 11228151
- ^ Withers DR (June 2016). "Innate lymphoid cell regulation of adaptive immunity".(Điều chỉnh tế bào lympho bẩm sinh trong miễn dịch thu được) Immunology. 149: 123–30. doi:10.1111/imm.12639. PMC 5011676 . PMID 27341319
- ^ Ryter A (1985). "Relationship between ultrastructure and specific functions of macrophages"(Mối quan hệ giữa siêu cấu trúc và chức năng đặc thù của đại thực bào) Comparative Immunology, Microbiology and Infectious Diseases. 8 (2): 119–33. doi:10.1016/0147-9571(85)90039-6. PMID 391034
- ^ Langermans JA, Hazenbos WL, van Furth R (Sep 1994). "Antimicrobial functions of mononuclear phagocytes".(Chức năng kháng khuẩn của Tb thực bào đơn nhân) Journal of Immunological Methods. 174 (1–2): 185–94. doi:10.1016/0022-1759(94)90021-3. PMID 8083520
- ^ Salzet M, Tasiemski A, Cooper E (2006). "Innate immunity in lophotrochozoans: the annelids" (Miễn dịch bẩm sinh ở con lophotrochozoas: họ Hoàn tiết) Current Pharmaceutical Design. 12 (24): 3043–50. doi:10.2174/138161206777947551. PMID 16918433
- ^ Zen K, Parkos CA (thang 10 2003). "Leukocyte-epithelial interactions".(Tương tác bạch cầu biểu mô) Current Opinion in Cell Biology. 15 (5): 557–64. doi:10.1016/S0955-0674(03)00103-0. PMID 14519390
- ^ a b tvrtinová V, Jakubovský J, Hulín I (1995). Inflammation and Fever from Pathophysiology: Principles of Disease. (Viêm và Sốt trong Sinh lý bệnh học: Nguyên tắc của bệnh) Computing Centre, Slovak Academy of Sciences: Academic Electronic Press. ISBN 80-967366-1-2. Archived from the original on ngày 11 tháng 7 năm 2001. Truy cập ngày 1 tháng 1 năm 2007.
- ^ Rua R, McGavern DB (tháng 9 năm 2015). "Elucidation of monocyte/macrophage dynamics and function by intravital imaging" (Xác định động lực bạch cầu đơn nhân/đại thực bào và chức năng trong đời sống) (. Journal of Leukocyte Biology. 98 (3): 319–32. doi:10.1189/jlb.4RI0115-006RR. PMC 4763596 . PMID 26162402
- ^ Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S (2002). "Antigen presentation and T cell stimulation by dendritic cells". (Trình diện kháng nguyên và kích thích tế bào T ở TB nhiều nhánh) Annual Review of Immunology. 20 (1): 621–67. doi:10.1146/annurev.immunol.20.100301.064828. PMID 11861614
- ^ Krishnaswamy G, Ajitawi O, Chi DS (2006). "The human mast cell: an overview" (Tổng quan về dưỡng bào ở người). Methods in Molecular Biology. 315: 13–34. PMID 1611014 6
- ^ Kariyawasam HH, Robinson DS (thang 4 2006). "The eosinophil: the cell and its weapons, the cytokines, its locations" (Bạch cầu ưa axit: tế bào và vũ khí của nó, cytokine, vị trí của chúng). Seminars in Respiratory and Critical Care Medicine. 27 (2): 117–27. doi:10.1055/s-2006-939514 Lưu trữ 2018-11-16 tại Wayback Machine. PMID 16612762.
- ^ Middleton D, Curran M, Maxwell L (tháng 8 năm 2002). "Natural killer cells and their receptors" (TB giết tự nhiên và thụ thể của chúng). Transplant Immunology. 10 (2–3): 147–64. doi:10.1016/S0966-3274(02)00062-X. PMID 12216946.
- ^ Gabrielli S, Ortolani C, Del Zotto G, Luchetti F, Canonico B, Buccella F, Artico M, Papa S, Zamai L (2016). "The Memories of NK Cells: Innate-Adaptive Immune Intrinsic Crosstalk".(Trí nhớ của TB NK: Bản chất giao thoa miễn dịch bẩm sinh-thu được) Journal of Immunology Research. 2016: 1376595. doi:10.1155/2016/1376595.
- ^ Rajalingam R (2012). "Overview of the killer cell immunoglobulin-like receptor system" (Tổng quan về hệ KIR). Methods in Molecular Biology. Methods in Molecular Biology™. 882: 391–414. doi:10.1007/978-1-61779-842-9_23. ISBN 978-1-61779-841-2. PMID 22665247.
- ^ Pancer Z, Cooper MD (2006). "The evolution of adaptive immunity".(Sự tiến hóa của miễn dịch thu được) Annual Review of Immunology. 24 (1): 497–518. doi:10.1146/annurev.immunol.24.021605.090542. PMID 1655125
- ^ a b Holtmeier W, Kabelitz D (2005). "gammadelta T cells link innate and adaptive immune responses".(Gammadelta T nối miễn dịch bẩm sinh và thu được) Chemical Immunology and Allergy. Chemical Immunology and Allergy. 86: 151–83. doi:10.1159/000086659. ISBN 3-8055-7862-8. PMID 15976493
- ^ Venturi, S, Venturi. M (2009). "Iodine, thymus, and immunity" (Iod, tuyến ức và miễn dịch). Nutrition. 25(9): 977–979. doi:10.1016/j.nut.2009.06.002/
- ^ Harty JT, Tvinnereim AR, White DW (2000). "CD8+ T cell effector mechanisms in resistance to infection".(TB T CD8+ ảnh hưởng cơ chế trong chống nhiễm khuẩn) Annual Review of Immunology. 18 (1): 275–308. doi:10.1146/annurev.immunol.18.1.275. PMID 10837060Harty JT, Tvinnereim AR, White DW (2000). "CD8+ T cell effector mechanisms in resistance to infection". Annual Review of Immunology. 18 (1): 275–308. doi:10.1146/annurev.immunol.18.1.275. PMID 10837060
- ^ a b Radoja S, Frey AB, Vukmanovic S (2006). "T-cell receptor signaling events triggering granule exocytosis".(Tín hiệu TCR dẫn đến xuất bào các hạt nhỏ-granule) Critical Reviews in Immunology. 26 (3): 265–90.doi:10.1615/CritRevImmunol.v26.i3.40. PMID 1692818
- ^ Abbas AK, Murphy KM, Sher A (thang 10 1996). "Functional diversity of helper T lymphocytes".(Đa dạng chức năng của TB T hỗ trợ) Nature. 383 (6603): 787–93. Bibcode:1996Natur.383..787A.doi:10.1038/383787a0. PMID 8893001.
- ^ McHeyzer-Williams LJ, Malherbe LP, McHeyzer-Williams MG (2006). "Helper T cell-regulated B cell immunity". (TB T hỗ trợ điều chỉnh hoạt động TB B) Current Topics in Microbiology and Immunology. Current Topics in Microbiology and Immunology. 311: 59–83. doi:10.1007/3-540-32636-7_3. ISBN 978-3-540-32635-9. PMID 17048705.
- ^ Kovacs B, Maus MV, Riley JL, Derimanov GS, Koretzky GA, June CH, Finkel TH (thang 11 2002). "Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation" (Các tế bào T CD8 + ở người không đòi hỏi sự phân cực của các mảng lipid để kích hoạt và tăng sinh) Proceedings of the National Academy of Sciences of the United States of America. 99 (23): 15006–11.Bibcode:2002PNAS...9915006K. doi:10.1073/pnas.232058599. PMC 137535 . PMID 12419850.
- ^ Grewal IS, Flavell RA (1998). "CD40 and CD154 in cell-mediated immunity".(CD40 và CD154 trong miễn dịch qua trung gian tế bào) Annual Review of Immunology. 16 (1): 111–35.doi:10.1146/annurev.immunol.16.1.111. PMID 9597126.
- ^ Girardi M (thang 1 2006). "Immunosurveillance and immunoregulation by gammadelta T cells" (Giám sát miễn dịch và điều hòa miễn dịch bởi tế bào T gammadelta) The Journal of Investigative Dermatology. 126 (1): 25–31.
- ^ "Understanding the Immune System: How it Works" (Hiểu về miễn dịch: Chúng hoạt động thế nào) (PDF). National Institute of Allergy and Infectious Diseases (NIAID). Lưu tại the original (PDF) 3 tháng 1 năm 2007. Truy cập 1 tháng 1 2007.
- ^ Sproul TW, Cheng PC, Dykstra ML, Pierce SK (2000). "A role for MHC class II antigen processing in B cell development" (Vai trò của MHC lớp II trong xử lý kháng nguyên). International Reviews of Immunology. 19 (2–3): 139–55. doi:10.3109/08830180009088502.PMID 10763706.
- ^ Kehry MR, Hodgkin PD (1994). "B-cell activation by helper T-cell membranes" (Hoạt hóa tế bào B bởi màng TB T hỗ trợ) Critical Reviews in Immunology. 14 (3–4): 221–38.doi:10.1615/CritRevImmunol.v14.i3-4.20. PMID 7538767.
- ^ Murphy K, Weaver C (2016). "10: The Humoral Immune Response".(Đáp ứng miễn dịch thể dịch) Immunobiology (9 ed.). Garland Science. ISBN 978-0-8153-4505-3.
- ^ Alder MN, Rogozin IB, Iyer LM, Glazko GV, Cooper MD, Pancer Z (tháng 12 năm 2005). "Diversity and function of adaptive immune receptors in a jawless vertebrate".(Đa dạng và chức năng của thụ thể thích nghi ở ĐV không có xương hàm).Science. 310 (5756): 1970–3.Bibcode:2005Sci...310.1970A.doi:10.1126/science.1119420. PMID 16373579.
- ^ Saji F, Samejima Y, Kamiura S, Koyama M (thang 51999). "Dynamics of immunoglobulins at the feto-maternal interface".(Năng động của kháng thể tại điểm giao thai-mẹ) Reviews of Reproduction. 4 (2): 81–9. doi:10.1530/ror.0.0040081. PMID 10357095.
- ^ Van de Perre P (thang 7 2003). "Transfer of antibody via mother's milk" (Truyền kháng tể qua sữa non). Vaccine. 21 (24): 3374–6.doi:10.1016/S0264-410X(03)00336-0.PMID 12850343.
- ^ Keller MA, Stiehm ER (tháng 10 năm 2000). "Passive immunity in prevention and treatment of infectious diseases".(Miễn dịch thụ động trong phòng và chữa bệnh phơi nhiễm) Clinical Microbiology Reviews.13 (4): 602–14. doi:10.1128/CMR.13.4.602-614.2000. PMC 88952 . PMID 11023960.
- ^ Death and DALY estimates for 2002 by cause for WHO Member States. (Ước tính tử vong và DALY năm 2002 theo nguyên nhân của các Quốc gia thành viên của WHO) World Health Organization. Truy cập 1 tháng 1 năm 2007.
- ^ Singh M, O'Hagan D (Nov 1999). "Advances in vaccine adjuvants". (Lợi thế của chất bổ trợ vaccine) Nature Biodechnology. 17 (11): 1075–81. doi:10.1038/15058. PMID 10545912.
- ^ Aw D, Silva AB, Palmer DB (tháng 4 năm 2007). "Immunosenescence: emerging challenges for an ageing population".(Lão hóa miễn dịch: thách thức ghê gớm cho một dân số đang già hóa) Immunology. 120 (4): 435–46. doi:10.1111/j.1365-2567.2007.02555.x. PMC 2265901 . PMID 17313487.
- ^ a b c Chandra RK (tháng 8 năm 1997). "Nutrition and the immune system: an introduction" (Dinh dưỡng và hệ miễn dọch: giới thiệu). The American Journal of Clinical Nutrition. 66 (2): 460S–463S. PMID 9250133.
- ^ Miller JF (tháng 7 năm 2002). "The discovery of thymus function and of thymus-derived lymphocytes" (Sự khám phá ra chức năng tuyến ức và các huyết bào nguồn từ tuyến ức). Immunological Reviews. 185 (1): 7–14. doi:10.1034/j.1600-065X.2002.18502.x. PMID 12190917.
- ^ Joos L, Tamm M (2005). "Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy" (Phân tách bảo vệ vật chủ ở phổi trong cơ thể bị suy giảm miễn dịch: hóa trị ung thư)(. Proceedings of the American Thoracic Society. 2 (5): 445–8. doi:10.1513/pats.200508-097JS. PMID 16322598
- ^ Copeland KF, Heeney JL (tháng 12 năm 1996). "T helper cell activation and human retroviral pathogenesis" (Tế bào T hỗ trợ và các bệnh học các retrovirus ở người). Microbiological Reviews. 60 (4): 722–42. PMC 239461 . PMID 8987361.
- ^ Miller JF (1993). "Self-nonself discrimination and tolerance in T and B lymphocytes" (Phân biệt "của bản thân"-"không của bản thân" và chống chịu của huyết bào T và B). Immunologic Research. 12 (2): 115–30. doi:10.1007/BF02918299. PMID 8254222.
- ^ a b c d Ghaffar, Abdul (2006). "Immunology — Chapter Seventeen: Hypersensitivity States" (Miễn dịch học-chương 17: Đáp ứng quá mẫn). Microbiology and Immunology On-line. University of South Carolina School of Medicine. Truy cập 29 tháng 5 2016.
- ^ Kawai T, Akira S (tháng 2 năm 2006). "Innate immune recognition of viral infection" (Hệ miễn dịch bẩm sinh nhận diện nhiễm virut). Nature Immunology. 7 (2): 131–7. doi:10.1038/ni1303. PMID 16424890.
- ^ Miller SB (tháng 8 năm 2006). "Prostaglandins in health and disease: an overview" (Prostaglandin trong sức khỏe và bệnh tật: Tổng quan). Seminars in Arthritis and Rheumatism. 36 (1): 37–49. doi:10.1016/j.semarthrit.2006.03.005. PMID 16887467.
- ^ Ogawa Y, Calhoun WJ (tháng 10 năm 2006). "The role of leukotrienes in airway inflammation" (Vai trò của leukotrienes trong viêm tức thời). The Journal of Allergy and Clinical Immunology. 118 (4): 789–98; quiz 799–800. doi:10.1016/j.jaci.2006.08.009. PMID 17030228.
- ^ Le Y, Zhou Y, Iribarren P, Wang J (tháng 4 năm 2004). "Chemokines and chemokine receptors: their manifold roles in homeostasis and disease" (Chemokines và thụ thể của chúng: chức năng đa dạng của chúng trong cân bằng nội môi và bệnh tật) (PDF). Cellular & Molecular Immunology. 1 (2): 95–104. PMID 16212895.
- ^ Martin P, Leibovich SJ (tháng 11 năm 2005). "Inflammatory cells during wound repair: the good, the bad and the ugly" (Tế bào viêm trong khi phục hồi vết thương: Lợi, hại và xấu xa). Trends in Cell Biology. 15 (11): 599–607. doi:10.1016/j.tcb.2005.09.002. PMID 16202600.
- ^ Bickle TA, Krüger DH (tháng 6 năm 1993). "Biology of DNA restriction" (Sinh học của kìm hãm DNA). Microbiological Reviews. 57 (2): 434–50. PMC 372918 . PMID 8336674.
- ^ Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, Romero DA, Horvath P (tháng 3 năm 2007). "CRISPR provides acquired resistance against viruses in prokaryotes" (CRISSP tạo ra miễn dịch thu được chống virut ở nhân sơ). Science. 315 (5819): 1709–12. Bibcode:2007Sci...315.1709B. doi:10.1126/science.1138140. PMID 17379808.
- ^ Brouns SJ, Jore MM, Lundgren M, Westra ER, Slijkhuis RJ, Snijders AP, Dickman MJ, Makarova KS, Koonin EV, van der Oost J (tháng 8 năm 2008). "Small CRISPR RNAs guide antiviral defense in prokaryotes" (Trình tự RNA CRISSPR nhỏ tạo nên cơ chế chống virut ở nhân sơ). Science. 321 (5891): 960–4. Bibcode:2008Sci...321..960B. doi:10.1126/science.1159689. PMID 18703739.
- ^ Hille, Frank; Charpentier, Emmanuelle (2016). "CRISPR-Cas: biology, mechanisms and relevance" (CRISSPR-Cas: sinh học, cơ chế và liên quan). Philosophical Transactions of the Royal Society B. 371: 20150496.
- ^ Koonin, Eugene V. (2017). "Evolution of RNA- and DNA-guided antivirus defense systems in prokaryotes and eukaryotes: common ancestry vs convergence" (TIến hóa của RNA và DNA dẫn đến cơ chế chống virus ở nhân sơ và nhân thực: tổ tiên chung và đồng qui). Biology Direct. 12: 5. doi:10.1186/s13062-017-0177-2. ISSN 1745-6150. PMC 5303251 . PMID 28187792.
- ^ Bayne CJ (2003). "Origins and evolutionary relationships between the innate and adaptive arms of immune systems".(Mối quan hệ giữa nguồn gốc và tiến hóa: giữa hệ miễn dịch bẩm sinh và thu được) Integr. Comp. Biol. 43 (2): 293–299. doi:10.1093/icb/43.2.293. PMID 21680436.
- ^ Stram Y, Kuzntzova L (tháng 6 năm 2006). "Inhibition of viruses by RNA interference" (Ngăn chặn virus bằng RNA can thiệp). Virus Genes. 32 (3): 299–306. doi:10.1007/s11262-005-6914-0. PMID 16732482.
- ^ a b Schneider, David. "Innate Immunity — Lecture 4: Plant immune responses" (Miễn dịch bẩm sinh - đáp ứng miễn dịch của thực vật) (PDF). Stanford University Department of Microbiology and Immunology. Truy cập 1 tháng 1 2007.
- ^ Jones JD, Dangl JL (tháng 11 năm 2006). "The plant immune system" (Hệ miễn dịch của cây). Nature. 444 (7117): 323–9. Bibcode:2006Natur.444..323J. doi:10.1038/nature05286. PMID 17108957.
- ^ Baulcombe D (tháng 9 năm 2004). "RNA silencing in plants" (Câm lặng RNA ở thực vật). Nature. 431 (7006): 356–63. Bibcode:2004Natur.431..356B. doi:10.1038/nature02874. PMID 15372043.
- ^ Morgan RA, Dudley ME, Wunderlich JR, et al. (tháng 10 năm 2006). "Cancer Regression in Patients After Transfer of Genetically Engineered Lymphocytes" (Sự hồi phục của bệnh nhân sau khi chuyển các tế bào lymphô đã được biến đổi gen). (Science. 314(5796): 126–9. Bibcode:2006Sci...314..126M. doi:10.1126/science.1129003. PMC 2267026 . PMID 16946036.
- ^ a b Andersen MH, Schrama D, Thor Straten P, Becker JC (tháng 1 năm 2006). "Cytotoxic T cells" (Tế bào T độc). The Journal of Investigative Dermatology. 126 (1): 32–41. doi:10.1038/sj.jid.5700001. PMID 16417215.
- ^ Boon T, van der Bruggen P (tháng 3 năm 1996). "Human tumor antigens recognized by T lymphocytes" (Khối u ở người được nhận diện bởi huyết bào T). The Journal of Experimental Medicine. 183 (3): 725–9. doi:10.1084/jem.183.3.725. PMC 2192342 . PMID 8642276.
- ^ Castelli C, Rivoltini L, Andreola G, Carrabba M, Renkvist N, Parmiani Gthang (tháng 3 năm 2000). "T-cell recognition of melanoma-associated antigens" (Tế bào T nhận diện ung thư hắc tố kết hợp kháng nguyên). Journal of Cellular Physiology. 182 (3): 323–31. doi:10.1002/(SICI)1097-4652(200003)182:3<323::AID-JCP2>3.0.CO;2-#. PMID 10653598.
- ^ a b Romero P, Cerottini JC, Speiser DE (2006). "The human T cell response to melanoma antigens" (Tế bào T phản ứng với kháng nguyên ung thư hắc tố). Advances in Immunology. Advances in Immunology. 92: 187–224. doi:10.1016/S0065-2776(06)92005-7. ISBN 978-0-12-373636-9. PMID 17145305.
- ^ a b Guevara-Patiño JA, Turk MJ, Wolchok JD, Houghton AN (2003). "Immunity to cancer through immune recognition of altered self: studies with melanoma" (Miễn dịch với ung thư qua nhận diện miễn dịch tự suy biến: Nghiên cứu ung thư hắc tố). Advances in Cancer Research. Advances in Cancer Research. 90: 157–77. doi:10.1016/S0065-230X(03)90005-4. ISBN 978-0-12-006690-2. PMID 14710950.
- ^ Renkvist N, Castelli C, Robbins PF, Parmiani G (tháng 3 năm 2001). "A listing of human tumor antigens recognized by T cells" (Danh sách các kháng nguyên khôi u nhận diện bởi tế bào T). Cancer Immunology, Immunotherapy. 50 (1): 3–15. doi:10.1007/s002620000169. PMID 11315507.
- ^ Gerloni M, Zanetti M (tháng 6 năm 2005). "CD4 T cells in tumor immunity" (Tế bào T CD4 trong miễn dịch khối u) Springer Seminars in Immunopathology. 27(1): 37–48. doi:10.1007/s00281-004-0193-z. PMID 15965712.
- ^ a b Seliger B, Ritz U, Ferrone S (tháng 1 năm 2006). "Molecular mechanisms of HLA class I antigen abnormalities following viral infection and transformation" (Cơ chế phân tử của HLA lớp 1 kháng nguyên bất thường theo sau nhiễm virut và chuyển dạng). International Journal of Cancer. 118 (1): 129–38. doi:10.1002/ijc.21312. PMID 16003759.
- ^ Hayakawa Y, Smyth MJ (2006). "Innate immune recognition and suppression of tumors" (Nhận diện miễn dịch bẩm sinh và ức chế khối u). Advances in Cancer Research. Advances in Cancer Research. 95: 293–322. doi:10.1016/S0065-230X(06)95008-8. ISBN 978-0-12-006695-7. PMID 16860661.
- ^ a b c d e f Syn, Nicholas L; Teng, Michele W L; Mok, Tony S K; Soo, Ross A. "De-novo and acquired resistance to immune checkpoint targeting" ("De-novo và miễn dịch tập nhiễm đối với mục tiêu kiểm soát miễn dịch). The Lancet Oncology. 18(12): e731–e741. doi:10.1016/s1470-2045(17)30607-1.
- ^ a b Seliger B (2005). "Strategies of tumor immune evasion" (Chiến thuật của tế bào khối u chống hệ miễn dịch). BioDrugs. 19 (6): 347–54. doi:10.2165/00063030-200519060-00002. PMID 16392887.
- ^ Frumento G, Piazza T, Di Carlo E, Ferrini S (tháng 9 năm 2006). "Targeting tumor-related immunosuppression for cancer immunotherapy" (Nhắm đến các tế bào khối u ức chế miễn dịch cho liệu pháp miễn dịch chống ung thư). Endocrine, Metabolic & Immune Disorders Drug Targets. 6 (3): 233–7. doi:10.2174/187153006778250019. PMID 17017974.
- ^ Stix G (tháng 7 năm 2007). "A malignant flame. Understanding chronic inflammation, which contributes to heart disease, Alzheimer's and a variety of other ailments, may be a key to unlocking the mysteries of cancer" (Ngọn lửa ác tính. Hiểu được viêm mãn tính, góp phần vào bệnh tim, bệnh Alzheimer và một loạt các bệnh khác, có thể là chìa khoá để mở khóa những bí ẩn của ung thư ") (PDF). Scientific American. 297 (1): 60–7. doi:10.1038/scientificamerican0707-60. PMID 17695843. Archived from [1] (PDF) on ngày 16 tháng 7 năm 2011.
- ^ WICK, G.; HU, Y.; SCHWARZ, S.; KROEMER, G. (1993-10-01). "Immunoendocrine Communication via the Hypothalamo-Pituitary-Adrenal Axis in Autoimmune Diseases*" ("Truyền tin miễn dịch nội tiết qua trục Vùng dưới đồi-Tuyến yên-Tuyến trên thận trong Bệnh tự miễn". Endocrine Reviews. 14 (5): 539–563. doi:10.1210/edrv-14-5-539. ISSN 0163-769X.
- ^ Kroemer, Guido; Brezinschek, Hans-Peter; Faessler, Reinhard; Schauenstein, Konrad; Wick, Georg (1988-01-01). "Physiology and pathology of an immunoendocrine feedback loop" (Sinh lý học và bệnh học của vòng phản hồi miễn dịch nội tiết). Immunology Today. 9 (6): 163–165. doi:10.1016/0167-5699(88)91289-3.
- ^ Trakhtenberg, Ephraim F.; Goldberg, Jeffrey L. (2011-10-07). "Neuroimmune Communication" (Thông tin trong miễn dịch não). Science. 334 (6052): 47–48. doi:10.1126/science.1213099. ISSN 0036-8075. PMID 21980100
- ^ Veiga-Fernandes, Henrique; Mucida, Daniel (2016-05-05). "Neuro-Immune Interactions at Barrier Surfaces" (Tương tác miễn dịch não tại vùng hàng rào). Cell. 165 (4): 801–811. doi:10.1016/j.cell.2016.04.041. ISSN 1097-4172. PMC 4871617 . PMID 27153494.
- ^ "Neuroimmune communication" (Thông tin trong miễn dịch não). Nature Neuroscience. 20 (2): 127–127. February 2017. doi:10.1038/nn.4496. ISSN 1097-6256.
- ^ Wira CR, Crane-Godreau M, Grant K (2004). "Endocrine regulation of the mucosal immune system in the female reproductive tract" (Điều hòa nội tiết đến hệ miễn dịch ở lớp nhầy của đường sinh dục phụ nữ). In Ogra PL, Mestecky J, Lamm ME, Strober W, McGhee JR, Bienenstock J. Mucosal Immunology. San Francisco: Elsevier. ISBN 0-12-491543-4.
- ^ Lang TJ (tháng 12 năm 2004). "Estrogen as an immunomodulator" (Estrogen với vai trò điều hòa miễn dịch). Clinical Immunology. 113 (3): 224–30. doi:10.1016/j.clim.2004.05.011. PMID 15507385. Moriyama A, Shimoya K, Ogata I, Kimura T, Nakamura T, Wada H, Ohashi K, Azuma C, Saji F, Murata Y (thang 7 1999). "Secretory leukocyte protease inhibitor (SLPI) concentrations in cervical mucus of women with normal menstrual cycle" ("Nồng độ chất tiết protease bạch huyết ức chế (SLPI) trong dịch nhầy cổ tử cung của phụ nữ có chu kỳ kinh nguyệt bình thường"). Molecular Human Reproduction. 5(7): 656–61. doi:10.1093/molehr/5.7.656. PMID 10381821. Cutolo M, Sulli A, Capellino S, Villaggio B, Montagna P, Seriolo B, Straub RH (2004). "Sex hormones influence on the immune system: basic and clinical aspects in autoimmunity" (Ảnh hưởng hormone sinh dục đến hệ miễn dịch: cơ bản và khía cạnh lâm sàng trong tự miễn). Lupus. 13 (9): 635–8. doi:10.1191/0961203304lu1094oa. PMID 15485092. King AE, Critchley HO, Kelly RW (tháng 2 năm 2000). "Presence of secretory leukocyte protease inhibitor in human endometrium and first trimester decidua suggests an antibacterial protective role" ("Sự hiện diện của chất protease ức chế bạch cầu tiết ra trong tử cung người và màng rụng 3 tháng đầu gợi ý vai trò bảo vệ chống vi khuẩn"). Molecular Human Reproduction. 6 (2): 191–6. doi:10.1093/molehr/6.2.191. PMID 10655462.
- ^ Fimmel S, Zouboulis CC (2005). "Influence of physiological androgen levels on wound healing and immune status in men" (Ảnh hưởng của nồng độ androgen sinh lý đến việc lành vết thương và miễn dịch ở nam giới). The Aging Male. 8 (3–4): 166–74. doi:10.1080/13685530500233847. PMID 16390741.
- ^ Dorshkind K, Horseman ND (tháng 6 năm 2000). "The roles of prolactin, growth hormone, insulin-like growth factor-I, and thyroid hormones in lymphocyte development and function: insights from genetic models of hormone and hormone receptor deficiency" (Vai trò của prolactin, GH, IGF-1 hormone tuyến giáp trong phát triển và chức năng của lymphocyte: xuyên suốt từ các mô hình di truyền của hoocmon và thiếu hụt thụ thể hoocmon). Endocrine Reviews. 21 (3): 292–312. doi:10.1210/er.21.3.292. PMID 10857555.
- ^ Nagpal S, Na S, Rathnachalam R (tháng 8 năm 2005). "Noncalcemic actions of vitamin D receptor ligands" (Tác động không calci của chất gắn thụ thể vitamin D) Endocrine Reviews. 26 (5): 662–87. doi:10.1210/er.2004-0002. PMID 15798098.
- ^ von Essen MR, Kongsbak M, Schjerling P, Olgaard K, Odum N, Geisler C (tháng 4 năm 2010). "Vitamin D controls T cell antigen receptor signaling and activation of human T cells" (Vitamin D điều khiển tín hiệu thụ thể kháng nguyên tế bào T và hoạt hóa tế bào T ở người). Nature Immunology. 11 (4): 344–9. doi:10.1038/ni.1851. PMID 20208539.
- ^ Sigmundsdottir H, Pan J, Debes GF, Alt C, Habtezion A, Soler D, Butcher EC (tháng 3 năm 2007). "DCs metabolize sunlight-induced vitamin D3 to 'program' T cell attraction to the epidermal chemokine CCL27" ("Chuyển hoá DC vitamin D3 "lập trình" các tế bào T tới chemokine biểu bì CCL27). Nature Immunology. 8(3): 285–93. doi:10.1038/ni1433. PMID 17259988.
- ^ Hertoghe T (tháng 12 năm 2005). "The "multiple hormone deficiency" theory of aging: is human senescence caused mainly by multiple hormone deficiencies?" (Lý thuyết lão hóa do thiếu hụt nhiều hormone: sự lão hoá của con người gây ra chủ yếu do thiếu hụt nhiều hoocmon). Annals of the New York Academy of Sciences. 1057 (1): 448–65. Bibcode:2005NYASA1057..448H. doi:10.1196/annals.1322.035. PMID 16399912.
- ^ Klein JR (tháng 3 năm 2006). "The immune system as a regulator of thyroid hormone activity" (Hệ miễn dịch điều hòa hoạt động hormone tuyến giáp). Experimental Biology and Medicine. 231 (3): 229–36. PMC 2768616 . PMID 16514168.
- ^ Mosekilde L (tháng 3 năm 2005). "Vitamin D and the elderly" (Vitamin D và sự lão hóa). Clinical Endocrinology. 62 (3): 265–81. doi:10.1111/j.1365-2265.2005.02226.x. PMID 15730407.
- ^ Lange T, Perras B, Fehm HL, Born J (2003). "Sleep enhances the human antibody response to hepatitis A vaccination" (Ngủ làm tăng cường hoạt động kháng thể đáp ứng với vắc-xin viêm gan A) (PDF). Psychosomatic Medicine. 65 (5): 831–5. doi:10.1097/01.PSY.0000091382.61178.F1. PMID 14508028.
- ^ Bryant PA, Trinder J, Curtis N (tháng 6 năm 2004). "Sick and tired: Does sleep have a vital role in the immune system?" (Ốm và mệt mỏi: Liệu ngủ có vai trò quan trọng trong hệ miễn dịch). Nature Reviews. Immunology. 4 (6): 457–67. doi:10.1038/nri1369. PMID 15173834.
- ^ Krueger JM, Majde JA (tháng 5 năm 2003). "Humoral links between sleep and the immune system: research issues" (Liên hệ thể dịch giữa ngủ và hệ miễn dịch). Annals of the New York Academy of Sciences. 992 (1): 9–20. Bibcode:2003NYASA.992....9K. doi:10.1111/j.1749-6632.2003.tb03133.x. PMID 12794042.
- ^ Majde JA, Krueger JM (tháng 12 năm 2005). "Links between the innate immune system and sleep" (Mối liên kết giữa miễn dịch bẩm sinh và ngủ). The Journal of Allergy and Clinical Immunology. 116 (6): 1188–98. doi:10.1016/j.jaci.2005.08.005. PMID 16337444.
- ^ "Sleep's Effects On Your Immune System Revealed In New Body Clock Study" (Tác dụng của ngủ lên hệ miễn dịch được hé lộ trong nghiên cứu về nhịp sinh học). Truy cập 2014-04-28.
- ^ a b Besedovsky L, Lange T, Born J (tháng 1 năm 2012). "Sleep and immune function" (Ngủ và chức năng miễn dịch). Pflügers Archiv. 463 (1): 121–37. doi:10.1007/s00424-011-1044-0. PMC 3256323 . PMID 22071480.
- ^ "Can Better Sleep Mean Catching fewer Colds?" (Ngủ nhiều hơn khiến ít bị cảm hơn?). Lưu trữ nguyên bản the original ngày 9 -5- 2014. Truy cập 2014-04-28.
- ^ R.M. Suskind, C.L. Lachney, J.N. Udall, Jr., "Malnutrition and the Immune Response", (Dinh dưỡng và đáp ứng miễn dịch) in: Dairy products in human health and nutrition, M. Serrano-Ríos, ed., CRC Press, 1994, trang. 285–300
- ^ Pond CM (tháng 7 năm 2005). "Adipose tissue and the immune system" (Mô mỡ và đáp ứng miễn dịch). Prostaglandins, Leukotrienes, and Essential Fatty Acids. 73 (1): 17–30. doi:10.1016/j.plefa.2005.04.005. PMID 15946832.
- ^ Langley-Evans SC, Carrington LJ (2006). "Diet and the developing immune system" (Ăn kiêng và phát triển hệ miễn dịch). Lupus. 15 (11): 746–52. doi:10.1177/0961203306070001. PMID 17153845.
- ^ Park, Julie E.; Barbul, Adrian (2004-05-01). "Understanding the role of immune regulation in wound healing".(Hiểu về điều hòa miễn dịch trong hồi phục vết thương) The American Journal of Surgery. 187(5): S11–S16. doi:10.1016/s0002-9610(03)00296-4. ISSN 0002-9610. PMID 15147986.
- ^ Burzyn, Dalia; Kuswanto, Wilson; Kolodin, Dmitriy; Shadrach, Jennifer L.; Cerletti, Massimiliano; Jang, Young; Sefik, Esen; Tan, Tze Guan; Wagers, Amy J. (2013-12-05). "A Special Population of Regulatory T Cells Potentiates Muscle Repair".(Lực lượng đặc biệt của tế bào T điều hòa có thể hồi phục cơ) Cell. 155 (6): 1282–1295. doi:10.1016/j.cell.2013.10.054. ISSN 0092-8674. PMC 3894749 . PMID 24315098.
- ^ Leoni, G.; Neumann, P.-A.; Sumagin, R.; Denning, T. L.; Nusrat, A. (tháng 9 năm 2015). "Wound repair: role of immune–epithelial interactions" (Lành vết thương: cai trò của tương tác miễn dịch-biểu mô). Mucosal Immunology. 8 (5): 959–968. doi:10.1038/mi.2015.63. ISSN 1933-0219. PMC 4916915 . PMID 26174765.
- ^ Wynn, Thomas A.; Vannella, Kevin M. (2016-03-15). "Macrophages in Tissue Repair, Regeneration, and Fibrosis" (Đại thực bào trong hồi phục mô, tái sinh và xơ hóa). Immunity. 44 (3): 450–462. doi:10.1016/j.immuni.2016.02.015. ISSN 1074-7613. PMC 4794754 . PMID 26982353.
- ^ a b Laurent, Paôline; Jolivel, Valérie; Manicki, Pauline; Chiu, Lynn; Contin-Bordes, Cécile; Truchetet, Marie-Elise; Pradeu, Thomas (2017). "Immune-Mediated Repair: A Matter of Plasticity" (Miễn dic-Trung gian hồi phục: Vấn đề của dẻo dai). Frontiers in Immunology. 8. doi:10.3389/fimmu.2017.00454. ISSN 1664-3224. PMC 5403426 . PMID 28484454.
- ^ Eming, Sabine A.; Hammerschmidt, Matthias; Krieg, Thomas; Roers, Axel (2009-07-01). "Interrelation of immunity and tissue repair or regeneration" (Tương tác giữa Miễn dịch và Sửa chữa mô hay phục hồi). Seminars in Cell & Developmental Biology. Regenerative Biology and Medicine: INuclear Transport in Development and Disease. 20 (5): 517–527. doi:10.1016/j.semcdb.2009.04.009.
- ^ Godwin, James W.; Pinto, Alexander R.; Rosenthal, Nadia A. (tháng 1 năm 2017). "Chasing the recipe for a pro-regenerative immune system".(Theo đuổi công thức cho tiền hồi phục hệ miễn dịch) Seminars in Cell & Developmental Biology. Innate immune pathways in wound healingPeromyscus as a model system. 61: 71–79. doi:10.1016/j.semcdb.2016.08.008. PMC 5338634 . PMID 27521522.
- ^ a b Taylor AL, Watson CJ, Bradley JA (tháng 10 năm 2005). "Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy" (Nhân tố ức chế miễn dịch trong chuyển ghép nội tạng. Cơ chế hành động và hiệu quả điều trị). Critical Reviews in Oncology/Hematology. 56(1): 23–46. doi:10.1016/j.critrevonc.2005.03.012. PMID 16039869.
- ^ Barnes PJ (tháng 3 năm 2006). "Corticosteroids: the drugs to beat" (Corticosteroids: thuốc nổi trội). European Journal of Pharmacology. 533 (1–3): 2–14. doi:10.1016/j.ejphar.2005.12.052. PMID 16436275.
- ^ Masri MA (tháng 7 năm 2003). "The mosaic of immunosuppressive drugs" (Khảm trong thuốc ức chế miễn dịch). Molecular Immunology. 39 (17–18): 1073–7. doi:10.1016/S0161-5890(03)00075-0. PMID 12835079.
- ^ Silverstein A (1989). A History of Immunology (Lịch sử của miễn dịch học). New York: Academic Press.
- ^ Tauber AI & Chernyak L (1991). Metchnikoff and the Origins of Immunology (Metchnioff và nguồn gốc của miễn dịch học). New York: Oxford University Press.
- ^ a b Tauber AI (1994). The Immune Self: Theory or Metaphor?. (Miễn dịch bản thân: Lý thuyết hay Ẩn dụ) Cambridge: Cambridge University Press.
- ^ Jerne NK (tháng 11 năm 1955). "THE NATURAL-SELECTION THEORY OF ANTIBODY FORMATION" (Lý thuyết chọn lọc tự nhiên đối với kháng thể). Proceedings of the National Academy of Sciences of the United States of America. 41 (11): 849–57. doi:10.1073/pnas.41.11.849. PMC 534292 . PMID 16589759.
- ^ Burnet FM (1959). The Clonal Selection Theory of Acquired Immunity (Lý thuyết chọn lọc dòng với miễn dịch thu được). Cambridge: Cambridge University Press.
- ^ Burnet FM (1969). Cellular Immunology: Self and Notself. (Miễn dịch tế bào: Bản thân và Không của bản thân) Cambridge: Cambridge University Press.
- ^ Bretscher P; Cohn M (1970). "A theory of self-nonself discrimination" (Lý thuyết về sự phân biệt bản thân/không của bản thân). Science. 169 (3950): 1042–49. doi:10.1126/science.169.3950.1042.
- ^ a b Matzinger P (tháng 4 năm 2002). "The danger model: a renewed sense of self" (Mô hình nguy hiểm: làm mới tri thức về thuyết bản thân) (PDF). Science. 296 (5566): 301–5. doi:10.1126/science.1071059. PMID 11951032.
- ^ Pradeu (2012). The Limits of the Self: Immunology and Biological Identity. (Các giới hạn của thuyến bản thân: Miễn dịch học và nhận dạng sinh học) New York: Oxford University Press.
- ^ Langman RE, Cohn M (tháng 6 năm 2000). "A minimal model for the self-nonself discrimination: a return to the basics" (Mô hình thu nhỏ cho thuyết phân biệt bản thân-không của bản thân: trở lại căn bản). Seminars in Immunology. 12 (3): 189–95; discussion 257–344. doi:10.1006/smim.2000.0231. PMID 10910739.
- ^ Clark WR (2008). In Defense of Self: How the Immune System Really Works (Sự phòng vệ của bản thân: hệ miễn dịch hoạt động ra sao). New York: Oxford University Press.
- ^ Coutinho A; et al. (1984). "From an antigen-centered, clonal perspective of immune responses to an organism-centered network perspective of autonomous reactivity of self-referential immune systems" (Từ kháng nguyên làm trung tâm, quan điểm dòng của đáp ứng miễn dịch đến sinh vật làm trung tâm, quan điểm mạng lưới phản ứng bán tự động của hệ thống miễn dịch phân biệt bản thân/không bản thân). Immunological Reviews. 79: 151–168. doi:10.1111/j.1600-065x.1984.tb00492.x.
- ^ Irun C (2000). Tending Adam’s garden: Evolving the cognitive immune self. (Chăm sóc vườn của Adam: Phát triển miễn dịch nhận thức) San Diego: Academic Press.
- ^ Pradeu T, Carosella ED (tháng 11 năm 2006). "On the definition of a criterion of immunogenicity" (Về việc định nghĩa một tiêu chí gây miễn dịch). Proceedings of the National Academy of Sciences of the United States of America. 103 (47): 17858–61. doi:10.1073/pnas.0608683103. PMC 1693837 . PMID 17101995.
- ^ Pradeu T, Jaeger S, Vivier E (tháng 10 năm 2013). "The speed of change: towards a discontinuity theory of immunity?" (Tốc độ thay đổi: sắp đến là thuyết miễn dịch gián đoạn?). Nature Reviews. Immunology. 13 (10): 764–9. doi:10.1038/nri3521. PMID 23995627.
- ^ Pradeu, Thomas; Vivier, Eric (14-7-2016). "The discontinuity theory of immunity" Lưu trữ 2021-05-14 tại Wayback Machine (Thuyết miễn dịch gián đoạn). Science Immunology. 1 (1): aag0479–aag0479. doi:10.1126/sciimmunol.aag0479 Lưu trữ 2021-05-14 tại Wayback Machine. ISSN 2470-9468. PMC 5321532 . PMID 28239677.
- ^ Janeway CA, Goodnow CC, Medzhitov R (tháng 5 năm 1996). "Danger - pathogen on the premises! Immunological tolerance" (Nguy hiểm-mầm bệnh đặt ở vị trí khởi điểm! Miễn dịch chống chịu). Current Biology. 6 (5): 519–22. doi:10.1016/S0960-9822(02)00531-6. PMID 8805259.
- ^ Vance RE (2000). "Cutting edge commentary: a Copernican revolution? Doubts about the danger theory" (Bình luận mới nhất: một cuộc cách mạng động trời như Copernich? Nghi ngờ về thuyết nguy hiểm). Journal of Immunology. 165 (4): 1725–1728. doi:10.4049/jimmunol.165.4.1725.
- ^ Matzinger P (tháng 5 năm 2012). "The evolution of the danger theory. Interview by Lauren Constable, Commissioning Editor" (Tiến hóa của thuyết nguy hiểm: Phỏng vấn bởi Lauren Constable, Biên tập viên). Expert Review of Clinical Immunology. 8 (4): 311–7. doi:10.1586/eci.12.21. PMID 22607177.
- ^ Pradeu T, Cooper EL (2012). "The danger theory: 20 years later" (20 năm sau mô hình nguy hiểm). Frontiers in Immunology. 3: 287. doi:10.3389/fimmu.2012.00287. PMC 3443751 . PMID 23060876.
- ^ Welling GW, Weijer WJ, van der Zee R, Welling-Wester S (tháng 9 năm 1985). "Prediction of sequential antigenic regions in proteins" (Dự đoán trình tự vùng kháng nguyên ở protein). FEBS Letters. 188 (2): 215–8. doi:10.1016/0014-5793(85)80374-4. PMID 2411595.
- ^ Söllner J, Mayer B (2006). "Machine learning approaches for prediction of linear B-cell epitopes on proteins" (Máy tính học cách tiếp cận dự đoán kháng nguyên dạng thẳng tế bào B của protein). Journal of Molecular Recognition. 19 (3): 200–8. doi:10.1002/jmr.771. PMID 16598694.
- ^ Saha S, Bhasin M, Raghava GP (2005). "Bcipep: a database of B-cell epitopes" (Bcipep: dữ liệu cho kháng nguyên tế bào B). BMC Genomics. 6: 79. doi:10.1186/1471-2164-6-79. PMC 1173103 . PMID 15921533.
- ^ Flower DR, Doytchinova IA (2002). "Immunoinformatics and the prediction of immunogenicity" (Miễn dịch thông tin học và dự đoán về khả năng tạo miễn dịch). Applied Bioinformatics. 1 (4): 167–76. PMID 15130835.
- ^ a b Finlay BB, McFadden G (tháng 2 năm 2006). "Anti-immunology: evasion of the host immune system by bacterial and viral pathogens" (Xâm nhập chống miễn dịch vật chủ bởi vi khuẩn và mầm bệnh virus). Cell. 124 (4): 767–82. doi:10.1016/j.cell.2006.01.034. PMID 16497587.
- ^ Cianciodto NP (tháng 12 năm 2005). "Type II secretion: a protein secretion system for all seasons" (Hệ thống tiết protein loại II cho mọi lúc). Trends in Microbiology. 13 (12): 581–8. doi:10.1016/j.tim.2005.09.005. PMID 16216510.
- ^ Winstanley C, Hart CA (tháng 2 năm 2001). "Type III secretion systems and pathogenicity islands" (Hệ thống tiết III và đảo sinh bệnh). Journal of Medical Microbiology. 50 (2): 116–26. doi:10.1099/0022-1317-50-2-116. PMID 11211218.
- ^ Finlay BB, Falkow S (tháng 6 năm 1997). "Common themes in microbial pathogenicity revisited" (Tông chủ đạo trong khả năng sinh bệnh của vi sinh vật khi tái phát). Microbiology and Molecular Biology Reviews. 61 (2): 136–69. PMC 232605 . PMID 9184008.
- ^ Kobayashi H (2005). "Airway biofilms: implications for pathogenesis and therapy of respiratory tract infections" (Màng sinh học trong không khí: Ám hiệu cho khả năng sinh bệnh và trị liệu trong đường hô hấp). Treatments in Respiratory Medicine. 4 (4): 241–53. doi:10.2165/00151829-200504040-00003. PMID 16086598.
- ^ Housden NG, Harrison S, Roberts SE, Beckingham JA, Graille M, Stura E, Gore MG (tháng 6 năm 2003). "Immunoglobulin-binding domains: Protein L from Peptostreptococcus magnus" (Vùng gắn với globulin miễn dịch: Protein L của bọn Peptostreptococcus magnus). Biochemical Society Transactions. 31 (Pt 3): 716–8. doi:10.1042/BST0310716. PMID 12773190.
- ^ Burton DR, Stanfield RL, Wilson IA (tháng 10 năm 2005). "Antibody vs. HIV in a clash of evolutionary titans" (Kháng thể đấu với HIV trong cuộc cách mạng của các vị thần). Proceedings of the National Academy of Sciences of the United States of America. 102 (42): 14943–8. Bibcode:2005PNAS..10214943B. doi:10.1073/pnas.0505126102. PMC 1257708 . PMID 16219699.
- ^ Taylor JE, Rudenko G (tháng 11 năm 2006). "Switching trypanosome coats: what's in the wardrobe?" (Trypanosome thay áo: Tủ quần áo nó chứa cái gì?) Tryp. Trends in Genetics. 22 (11): 614–20. doi:10.1016/j.tig.2006.08.003. PMID 16908087.
- ^ Cantin R, Méthot S, Tremblay MJ (tháng 6 năm 2005). "Plunder and stowaways: incorporation of cellular proteins by enveloped viruses" ("Cướp bóc và tẩu thoát: sự kết hợp của các protein tế bào bằng các vỏ của virus). Journal of Virology. 79 (11): 6577–87. doi:10.1128/JVI.79.11.6577-6587.2005. PMC 1112128 . PMID 15890896.
Liên kết ngoài
[sửa | sửa mã nguồn]Chú ý: Tất cả liên kết chứa bài viết tiếng Anh, chỉ phần tên liên kết được dịch
- Miễn dịch tại Từ điển bách khoa Việt Nam
- Immune system (physiology) tại Encyclopædia Britannica (tiếng Anh)
- Hệ miễn dịch Lưu trữ 2019-05-02 tại Wayback Machine – từ trường Đại học Hartford (trình độ trung học/đại học-cử nhân)
- Vi sinh học và Miễn dịch học – từ trường Đại học Y dược South Carolina (trình độ đại học-cử nhân)
- Miễn dịch sinh học, Tái bản lần 5 – phiên bản trực tuyến từ sách của Charles Janeway (trình độ cử nhân nâng cao)
- Bài nói chuyện của Stanley Falkow: "Tương tác vật chủ-mầm bệnh và bệnh ở người"
![[Tập hiểu sâu]: Vì sao Bạn luôn KHÔNG ỔN?](https://images.spiderum.com/sp-images/f5ab2630336211eea9e7ef608f381f46.png) GIẢM
12%
GIẢM
12%
![[Review Sách] Sống thực tế giữa đời thực dụng - Khi nỗ lực trở thành bản năng](https://down-tx-vn.img.susercontent.com/sg-11134201-7qve1-lj0r8adyezkf95.webp) GIẢM
10%
GIẢM
10%
 GIẢM
49%
GIẢM
49%
 GIẢM
30%
GIẢM
30%
 GIẢM
24%
GIẢM
24%