Vắc-xin COVID-19
| Một phần của một loạt bài về |
| Đại dịch COVID-19 |
|---|
 |
|
|
|


Vắc xin COVID-19 là vắc-xin nhằm cung cấp khả năng miễn dịch thu được chống lại coronavirus 2 với hội chứng hô hấp cấp tính nghiêm trọng (SARS‑CoV‑2), loại vi rút gây ra bệnh coronavirus 2019 (COVID‑19). Trước đại dịch COVID-19, một nhóm kiến thức đã được thiết lập đã tồn tại về cấu trúc và chức năng của coronavirus gây ra các bệnh như hội chứng hô hấp cấp tính nghiêm trọng (SARS) và hội chứng hô hấp Trung Đông (MERS). Các kiến thức này đã thúc đẩy sự phát triển của các công nghệ vắc xin khác nhau vào đầu năm 2020.[1] Vào ngày 10 tháng 1 năm 2020, dữ liệu trình tự di truyền SARS-CoV-2 được chia sẻ thông qua GISAID, và vào ngày 19 tháng 3 năm 2020, ngành công nghiệp dược phẩm toàn cầu đã công bố một cam kết cơ bản nhằm giải quyết bệnh COVID-19.[2] Vắc xin COVID-19 được công nhận rộng rãi vì vai trò của chúng trong việc giảm sự lây lan, mức độ nghiêm trọng và tử vong do COVID-19 gây ra.[3]
Trong các thử nghiệm Giai đoạn III, một số vắc xin COVID-19 đã chứng minh hiệu quả cao tới 95% trong việc ngăn ngừa nhiễm trùng COVID-19 có triệu chứng. Tính đến tháng 7 năm 2021[cập nhật], 20 loại vắc xin được ít nhất một cơ quan quản lý quốc gia cho phép sử dụng công cộng: hai vắc xin RNA (Pfizer–BioNTech và Moderna), chín vắc xin bất hoạt thông thường (BBIBP-CorV, Học viện Khoa học Y tế Trung Quốc, CoronaVac, Covaxin, CoviVac, COVIran Barekat, Minhai-Kangtai, QazVac và WIBP-CorV), năm vắc xin vectơ virus (Sputnik Light, Sputnik V, Oxford–AstraZeneca, Convidecia và Janssen) và bốn vắc xin tiểu đơn vị protein (Abdala, EpiVacCorona, Soberana 02 và ZF2001).[4][5] Tính đến tháng 7 năm 2021[cập nhật], đã có 330 ứng viên vắc xin đang trong các giai đoạn phát triển khác nhau, với 102 vắc xin đang được nghiên cứu lâm sàng, trong đó có 30 vắc xin đang trong giai đoạn I, 30 vắc xin trong giai đoạn I-II, 25 vắc xin trong Giai đoạn III và 8 vắc xin trong giai đoạn IV phát triển.[4][6]
Nhiều quốc gia đã thực hiện các kế hoạch phân bổ theo từng giai đoạn ưu tiên những người có nguy cơ biến chứng cao nhất, chẳng hạn như người cao tuổi và những người có nguy cơ phơi nhiễm và lây truyền cao, chẳng hạn như nhân viên y tế.[7] Việc sử dụng tạm thời một liều đang được xem xét để mở rộng tiêm chủng cho càng nhiều người càng tốt cho đến khi tình trạng sẵn có của vắc xin được cải thiện.[8][9][10][11][12]
Tính đến ngày 14 tháng 7 năm 2021, 3,54 tỷ liều vắc xin COVID-19 đã được sử dụng trên toàn thế giới dựa trên các báo cáo chính thức từ các cơ quan y tế quốc gia.[13] AstraZeneca dự kiến sản xuất 3 tỷ liều vào năm 2021, Pfizer–BioNTech 1,3 tỷ liều và Sputnik V, Sinopharm, Sinovac và Johnson & Johnson mỗi loại 1 tỷ liều. Moderna đặt mục tiêu sản xuất 600 triệu liều và Convidecia 500 triệu liều vào năm 2021.[14] Đến tháng 12 năm 2020, hơn 10 tỷ liều vắc xin đã được các quốc gia đặt hàng trước,[15] với khoảng một nửa số liều được các quốc gia có thu nhập cao, chiếm 14% dân số thế giới, đặt mua.[16]
Bối cảnh
[sửa | sửa mã nguồn]Nhiều loại vắc-xin dùng cho động vật đã được sản xuất để phòng chống các bệnh do coronavirus gây ra, bao gồm virus corona ở chim, virus corona ở chó và virus corona ở mèo.[17]
Các nỗ lực trước đó trong việc phát triển vắc-xin phòng chống những virus trong họ Coronaviridae gây bệnh ở người, cụ thể là SARS-CoV gây hội chứng hô hấp cấp tính nặng (SARS) và MERS-CoV gây hội chứng hô hấp Trung Đông (MERS). Vắc-xin phòng chống SARS[18] và MERS[19] đã được thử nghiệm trên các mô hình động vật không phải con người. Đến năm 2020, chưa có vắc-xin chữa và bảo vệ dành cho SARS mà cho thấy sự an toàn và hiệu quả trên người.[20][21] Theo một số tài liệu nghiên cứu xuất bản từ 2005 đến 2006, xác định và phát triển một loại vắc-xin mới và thuốc để điều trị SARS là một trong những ưu tiên của chính phủ và các cơ quan sức khỏe công cộng trên toàn thế giới.[22][23][24]
Cũng chưa có vắc-xin phòng chống MERS nào được kiểm chứng.[25] Khi MERS trở nên phổ biến, các nghiên cứu SARS đã tồn tại trước đó được tin rằng có thể sẽ cung cấp một bản mẫu hữu ích trong việc phát triển vắc-xin và liệu pháp chữa trị cho bệnh nhân nhiễm MERS-CoV.[20][26] Đến tháng 3 năm 2020 có 1 vắc-xin MERS (gốc DNA) đã hoàn thiện pha I thử nghiệm lâm sàng trên con người,[27] và ba loại khác đang trong quá trình phát triển, tất cả đều là vắc-xin vector virus, hai vector virus Adeno (ChAdOx1-MERS,[28][29] BVRS-GamVac[30]) và một vector MVA (MVA-MERS-S[31])[32]
Các loại vắc xin
[sửa | sửa mã nguồn]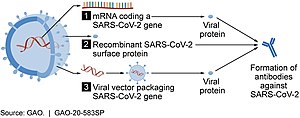
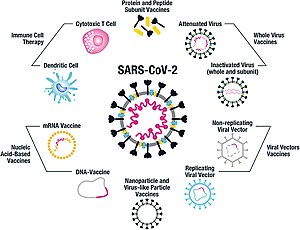
Tính đến tháng 1 năm 2021, ít nhất chín nền tảng công nghệ khác nhau đang được nghiên cứu và phát triển để tạo ra vắc xin hiệu quả chống lại COVID‑19.[4][34] Hầu hết các nền tảng của các ứng cử viên vắc-xin trong các thử nghiệm lâm sàng đều tập trung vào protein gai của coronavirus và các biến thể của nó như là kháng nguyên chính của nhiễm trùng COVID-19.[34] Các nền tảng đang được phát triển vào năm 2020 liên quan đến công nghệ axit nucleic (RNA và DNA thông tin biến đổi nucleoside, vectơ virus không sao chép, peptit, protein tái tổ hợp, virus sống giảm độc lực và virus bất hoạt.[34][35][36][37]
Nhiều công nghệ vắc-xin đang được phát triển cho COVID-19 không giống như vắc-xin đã được sử dụng để ngăn ngừa bệnh cúm, mà đang sử dụng các chiến lược "thế hệ tiếp theo" để nhắm mục tiêu chính xác vào các cơ chế lây nhiễm COVID-19.[34][36][37] Một số vắc-xin tổng hợp sử dụng đột biến 2P để khóa protein gai vào cấu hình trước khi tiêm chủng của nó, kích thích phản ứng miễn dịch đối với virus trước cả khi nó gắn vào tế bào người.[38] Các nền tảng vắc-xin đang được phát triển có thể cải thiện tính linh hoạt trong thao tác kháng nguyên và hiệu quả đối với cơ chế nhắm mục tiêu của nhiễm COVID-19 ở các nhóm dân số nhạy cảm, chẳng hạn như nhân viên y tế, người già, trẻ em, phụ nữ mang thai và những người có hệ miễn dịch suy yếu.[34][36]
Vắc xin RNA
[sửa | sửa mã nguồn]
Vắc xin RNA chứa RNA, khi được đưa vào mô, sẽ hoạt động như một RNA thông tin (mRNA) để khiến các tế bào tạo ra protein lạ và kích thích phản ứng miễn dịch thu được, giúp cơ thể biết cách xác định và tiêu diệt mầm bệnh hoặc tế bào ung thư tương ứng. Các vắc xin RNA thường, nhưng không phải lúc nào cũng sử dụng RNA thông tin biến đổi nucleoside. Việc phân phối mRNA đạt được nhờ việc đồng hình thành của phân tử thành các hạt nano lipid để bảo vệ các sợi RNA và giúp hấp thụ chúng vào tế bào.[39][40][41][42]
Vắc xin RNA là vắc xin COVID-19 đầu tiên được cho phép ở Vương quốc Anh, Hoa Kỳ và Liên minh Châu Âu.[43][44] Tính đến tháng 1 năm 2021, các loại vắc xin được ủy quyền thuộc loại này là vắc xin Pfizer–BioNTech COVID-19[45][46][47] và vắc xin Moderna COVID-19.[48][49] Tính đến tháng 7 năm 2021, vắc-xin CVnCoV của CureVac đã thất bại trong các thử nghiệm lâm sàng.[50] Ngày 23 tháng 8 năm 2021, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chính thức đưa ra chấp thuận hoàn toàn đối với vaccine Pfizer-BioNTech.[51]
Các phản ứng dị ứng nghiêm trọng là rất hiếm. Vào tháng 12 năm 2020, 1.893.360 liều vắc xin COVID ‑ 19 Pfizer–BioNTech đầu tiên đã dẫn đến 175 trường hợp phản ứng dị ứng nghiêm trọng, trong đó có 21 trường hợp sốc phản vệ.[52] Đối với 4.041.396 liều vắc xin COVID‑19 Moderna trong tháng 12 năm 2020 và tháng 1 năm 2021, chỉ có mười trường hợp phản vệ đã được báo cáo.[52] Các hạt nano lipid rất có thể là nguyên nhân gây ra các phản ứng dị ứng trên.[52]
Vắc xin vectơ adenovirus
[sửa | sửa mã nguồn]Các vắc xin này là các ví dụ về vắc xin vectơ virus không sao chép, sử dụng vỏ virus adeno chứa DNA mã hóa protein SARS‑CoV‑2.[53][54] Các vắc-xin dựa trên vector virus chống lại COVID-19 là không sao chép, có nghĩa là chúng không tạo ra các phần tử virus mới, mà chỉ tạo ra kháng nguyên tạo ra phản ứng miễn dịch toàn thân.[53]
Tính đến tháng 1 năm 2021[cập nhật], các vắc xin loại này là vắc xin Oxford–AstraZeneca,[55][56][57] Sputnik V,[58] Convidecia, và Janssen.[59][60]
Vắc xin Convidecia và vắc xin Janssen đều là vắc xin tiêm một mũi, cung cấp dịch vụ hậu cần ít phức tạp hơn và có thể được bảo quản trong tủ lạnh thông thường trong vài tháng.[61][62]
Vắc xin Sputnik V sử dụng Ad26 cho liều đầu tiên, giống với liều duy nhất của Janssen và Ad5 cho liều thứ hai, giống với liều duy nhất của Convidecia.[63]
Vắc xin virus bất hoạt
[sửa | sửa mã nguồn]Vắc xin bất hoạt bao gồm các phần tử virus đã được nuôi cấy và sau đó bị tiêu diệt bằng phương pháp như dùng nhiệt hoặc formaldehyde để làm mất khả năng sinh bệnh, trong khi vẫn kích thích phản ứng miễn dịch.[64]
Tính đến tháng 1 năm 2021, các loại vắc xin được cấp phép thuộc loại này là CoronaVac[65][66][67], BBIBP-CorV[68] và WIBP-CorV của Trung Quốc; Covaxin của Ấn Độ; cuối năm 2021 sẽ có CoviVac của Nga[69]; và vắc xin QazVac của Kazakhstan[70]. Các loại vắc xin đang thử nghiệm lâm sàng bao gồm vắc xin Valneva COVID-19.[71][nguồn không đáng tin?][72]
Vắc xin tiểu đơn vị
[sửa | sửa mã nguồn]Vắc xin tiểu đơn vị đưa ra một hoặc nhiều kháng nguyên mà không đưa toàn bộ hạt mầm bệnh vào. Các kháng nguyên liên quan thường là các tiểu đơn vị protein, nhưng có thể là bất kỳ phân tử nào là một đoạn của mầm bệnh.[73]
Tính đến tháng 4 năm 2021, hai vắc xin loại này được cấp phép là vắc xin peptide EpiVacCorona[74] và ZF2001[4]. Các vắc xin đang chờ cấp phép bao gồm vắc xin Novavax COVID-19,[75] Soberana 02 (vắc xin liên hợp) và vắc xin Sanofi – GSK. Vắc-xin V451 trước đây đang trong giai đoạn thử nghiệm lâm sàng đã bị ngừng do người ta phát hiện ra rằng vắc-xin này có khả năng gây ra kết quả không chính xác cho các xét nghiệm HIV tiếp theo.[76][77]
Các loại khác
[sửa | sửa mã nguồn]Các loại vắc xin bổ sung đang trong giai đoạn thử nghiệm lâm sàng bao gồm vắc xin dạng hạt giống virus, vắc xin đa plasmid DNA,[78][79][80][81][82], ít nhất hai vắc xin vectơ lentivirus[83][84], vắc xin liên hợp và vi rút viêm miệng dạng mụn nước hiển thị protein gai của SARS-CoV‑2.[85]
Các vắc xin uống và vắc xin tiêm vào mũi đang được phát triển và nghiên cứu.[86]
Các nhà khoa học đã điều tra xem liệu các loại vắc xin hiện có cho các bệnh không liên quan có thể nâng cao hệ thống miễn dịch và làm giảm mức độ nghiêm trọng của việc lây nhiễm COVID-19 hay không.[87] Có bằng chứng thực nghiệm cho thấy vắc-xin BCG phòng bệnh lao có tác dụng không đặc hiệu trên hệ thống miễn dịch, nhưng không có bằng chứng nào cho thấy vắc-xin này có hiệu quả chống lại COVID-19.[88]
Công thức
[sửa | sửa mã nguồn]Tính đến tháng 9 năm 2020, mười một ứng cử viên vắc xin trong quá trình phát triển lâm sàng sử dụng tá dược để tăng cường tính sinh miễn dịch[89]. Chất bổ trợ miễn dịch là một chất được pha chế với vắc xin để nâng cao phản ứng miễn dịch với kháng nguyên, chẳng hạn như vi rút COVID-19 hoặc vi rút cúm[90]. Cụ thể, chất bổ trợ có thể được sử dụng trong công thức vắc-xin COVID-19 để tăng cường tính sinh miễn dịch và hiệu quả của nó nhằm giảm hoặc ngăn ngừa nhiễm COVID-19 ở những người được tiêm chủng[90][91]. Các chất bổ trợ được sử dụng trong công thức vắc-xin COVID-19 có thể đặc biệt hiệu quả đối với các công nghệ sử dụng vi-rút COVID-19 bất hoạt và vắc-xin dựa trên vectơ hoặc protein tái tổ hợp[91]. Muối nhôm, được gọi là "alum", là tá dược đầu tiên được sử dụng cho các vắc xin được cấp phép và là chất bổ trợ được lựa chọn trong khoảng 80% vắc xin bổ trợ[91]. Chất bổ trợ alum bắt đầu các cơ chế phân tử và tế bào đa dạng để tăng cường khả năng sinh miễn dịch, bao gồm giải phóng các cytokine tiền viêm nhiễm.[90][91]
Lập kế hoạch và phát triển
[sửa | sửa mã nguồn]Kể từ tháng 1 năm 2020, việc phát triển vắc xin đã được xúc tiến thông qua sự hợp tác chặt chẽ chưa từng có trong ngành dược phẩm đa quốc gia và giữa các chính phủ.[34][92]
Nhiều bước dọc theo toàn bộ lộ trình phát triển được đánh giá, bao gồm:[35][93]
- Mức độ độc hại có thể chấp nhận được của vắc xin (tính an toàn của vắc xin),
- Nhắm mục tiêu đến các nhóm dân cư dễ bị tổn thương,
- Nhu cầu đột phá về hiệu quả của vắc xin,
- Thời gian bảo vệ tiêm chủng,
- Hệ thống phân phối đặc biệt (chẳng hạn như miệng hoặc mũi, thay vì tiêm),
- Chế độ liều lượng,
- Đặc tính ổn định và lưu trữ,
- Cấp phép sử dụng khẩn cấp trước khi cấp phép chính thức,
- Sản xuất tối ưu để có thể sản xuất đến hàng tỷ liều, và
- Phổ biến vắc xin đã được cấp phép.
Các thách thức
[sửa | sửa mã nguồn]Đã có một số thách thức riêng với việc phát triển vắc-xin COVID-19.
Sự cấp thiết tạo ra vắc xin cho COVID ‑ 19 dẫn đến lịch trình nén rút ngắn thời gian phát triển vắc xin tiêu chuẩn, trong một số trường hợp kết hợp các bước thử nghiệm lâm sàng trong nhiều tháng, vốn là một quá trình thường được tiến hành tuần tự trong nhiều năm.[94]
Tiến trình thực hiện nghiên cứu lâm sàng – thường là một quá trình tuần tự đòi hỏi nhiều năm – đang được nén thành các thử nghiệm an toàn, hiệu quả và có thời gian thực hiện chạy song song đồng thời trong nhiều tháng, có khả năng ảnh hưởng đến việc đảm bảo an toàn.[94][95] Ví dụ, các nhà phát triển vắc-xin Trung Quốc và Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh của chính phủ Trung Quốc bắt đầu nỗ lực vào tháng 1 năm 2020,[96] và đến tháng 3 đã theo đuổi nhiều ứng cử viên trong các mốc thời gian ngắn, với mục tiêu thể hiện sức mạnh công nghệ của Trung Quốc so với các Hoa Kỳ, và để trấn an người dân Trung Quốc về chất lượng vắc xin được sản xuất tại Trung Quốc.[94][97]
Sự phát triển nhanh chóng và cấp bách của việc sản xuất vắc xin phòng đại dịch COVID-19 có thể làm tăng rủi ro và tỷ lệ thất bại trong việc cung cấp vắc xin an toàn, hiệu quả.[36][37][98] Ngoài ra, việc nghiên cứu tại các trường đại học bị giãn cách xã hội và việc đóng cửa các phòng thí nghiệm làm cản trở.[99][100]
Các vắc xin phải tiến hành qua nhiều giai đoạn thử nghiệm lâm sàng để kiểm tra tính an toàn, khả năng sinh miễn dịch, hiệu quả, mức liều và tác dụng phụ của vắc xin đó.[101][102] Các nhà phát triển vắc xin phải đầu tư nguồn lực quốc tế để tìm đủ người tham gia cho Giai đoạn Thử nghiệm lâm sàng II – III khi vi rút đã được chứng minh là "mục tiêu di động" của việc thay đổi tốc độ lây truyền trong và ngoài nước, buộc các công ty phải cạnh tranh để có được những người tham gia thử nghiệm.[103] Những người tổ chức thử nghiệm lâm sàng cũng có thể gặp phải những người không muốn tiêm chủng do ngần ngại tiêm vắc-xin[104] hoặc không tin tưởng vào cơ sở khoa học của công nghệ vắc-xin và khả năng ngăn ngừa viêm nhiễm của nó.[105] Do vắc-xin mới được phát triển trong đại dịch COVID-19, giấy phép cho các ứng viên vắc-xin COVID-19 yêu cầu nộp hồ sơ đầy đủ thông tin về chất lượng phát triển và sản xuất.[106][107][108]
Tổ chức
[sửa | sửa mã nguồn]Trên bình diện quốc tế, Access to COVID-19 Tools Accelerator là một sáng kiến của G20 và Tổ chức Y tế Thế giới (WHO) được công bố vào tháng 4 năm 2020.[109][110] Đây là một cấu trúc hỗ trợ liên ngành để cho phép các đối tác của nó chia sẻ tài nguyên và kiến thức. Tổ chức này bao gồm bốn trụ cột, mỗi trụ cột được quản lý bởi hai đến ba đối tác hợp tác: Vắc xin (còn gọi là "COVAX"), Chẩn đoán, Trị liệu và Kết nối Hệ thống Y tế.[111] "R&D Blueprint (for the) novel Coronavirus" của WHO đã ghi lại một "thử nghiệm lâm sàng đối chứng ngẫu nhiên lớn, đa địa điểm, được kiểm soát ngẫu nhiên riêng lẻ" để cho phép "đánh giá đồng thời những lợi ích và rủi ro của từng loại vắc-xin ứng viên đầy hứa hẹn trong vòng 3–6 tháng, trong số đó sẽ được cung cấp bản dùng thử." Liên minh vắc xin của WHO sẽ ưu tiên loại vắc xin nào nên được đưa vào Giai đoạn II và Thử nghiệm lâm sàng III và xác định giai đoạn hài hòa Quy trình III cho tất cả các vắc xin qua được giai đoạn thử nghiệm quan trọng.[112]
Chính phủ các quốc gia cũng đã tham gia vào việc phát triển vắc-xin. Canada đã công bố tài trợ cho 96 dự án nghiên cứu vắc xin tại các công ty và trường đại học của Canada, với kế hoạch thiết lập một "ngân hàng vắc xin" có thể được sử dụng nếu một đợt bùng phát coronavirus khác xảy ra,[113] và để hỗ trợ các thử nghiệm lâm sàng và phát triển chuỗi sản xuất và cung ứng vắc xin.[114]
Trung Quốc đã cung cấp các khoản vay lãi suất thấp cho một nhà phát triển vắc xin thông qua ngân hàng trung ương của nước này, và "nhanh chóng dành đất cho công ty" để xây dựng các nhà máy sản xuất.[95] Ba công ty vắc xin và viện nghiên cứu của Trung Quốc được chính phủ hỗ trợ tài chính để nghiên cứu, thực hiện các công đoạn thử nghiệm lâm sàng và sản xuất.[115]
Vương quốc Anh đã thành lập lực lượng đặc nhiệm vắc xin COVID-19 vào tháng 4 năm 2020 để kích thích các nỗ lực của địa phương nhằm tăng tốc phát triển vắc xin thông qua sự hợp tác của các ngành công nghiệp, các trường đại học và các cơ quan chính phủ, bao gồm mọi giai đoạn phát triển từ nghiên cứu đến sản xuất.[116]
Tại Hoa Kỳ, Cơ quan Nghiên cứu và Phát triển Tiên tiến Y sinh (BARDA), một cơ quan liên bang tài trợ cho công nghệ chống dịch bệnh, đã công bố các khoản đầu tư để hỗ trợ phát triển vắc-xin COVID-19 của Mỹ và sản xuất các ứng cử viên triển vọng nhất.[95][117] Vào tháng 5 năm 2020, chính phủ Hoa Kỳ công bố tài trợ cho một chương trình tốc độ nhanh có tên Operation Warp Speed.[118][119] Tính đến tháng 3 năm 2021, BARDA đã tài trợ ước tính 19,3 tỷ đô la cho việc phát triển vắc xin COVID-19.[120]
Các công ty dược phẩm lớn có kinh nghiệm sản xuất vắc xin trên quy mô lớn, bao gồm Johnson & Johnson, AstraZeneca và GlaxoSmithKline (GSK), đã thành lập liên minh với các công ty công nghệ sinh học, chính phủ và trường đại học để đẩy nhanh tiến độ hướng tới vắc xin có hiệu quả.[94][95]
Lịch sử
[sửa | sửa mã nguồn]Vi rút gây ra COVID-19, SARS-CoV-2, đã được phân lập vào cuối năm 2019[121]. Trình tự di truyền của nó được công bố vào ngày 11 tháng 1 năm 2020, gây ra phản ứng quốc tế khẩn cấp để chuẩn bị cho sự bùng phát và đẩy nhanh sự phát triển của vắc-xin COVID-19 để phòng ngừa[36][122][123]. Kể từ năm 2020, việc phát triển vắc xin đã được xúc tiến thông qua sự hợp tác chưa từng có trong ngành dược phẩm đa quốc gia và giữa các chính phủ.[36] Đến tháng 6 năm 2020, các tập đoàn, chính phủ, tổ chức y tế quốc tế và các nhóm nghiên cứu đại học đã đầu tư hàng chục tỷ đô la để phát triển hàng chục ứng cử viên vắc xin và chuẩn bị cho các chương trình tiêm chủng toàn cầu để chủng ngừa nhiễm COVID-19.[122][124][125][126] Theo Liên minh Đổi mới Chuẩn bị sẵn sàng Dịch bệnh (CEPI), phân bố địa lý của quá trình phát triển vắc xin COVID-19 cho thấy các thực thể Bắc Mỹ có khoảng 40% hoạt động, so với 30% ở châu Á và Úc, 26% ở châu Âu, và ít dự án ở Nam Mỹ và Châu Phi.[36][127]
Vào tháng 2 năm 2020, Tổ chức Y tế Thế giới (WHO) cho biết họ không mong chờ một loại vắc xin chống lại SARS‑CoV‑2 sẽ có sẵn trong vòng chưa đầy 18 tháng nữa[6]. Nhà virus học Paul Offit nhận xét rằng, nhìn nhận lại, việc phát triển một loại vắc-xin an toàn và hiệu quả trong vòng 11 tháng là một kỳ tích đáng kể[128]. Tỷ lệ lây nhiễm COVID-19 ngày càng tăng nhanh trên toàn thế giới trong năm 2020 đã kích thích các liên minh quốc tế và chính phủ nỗ lực gấp rút tổ chức các nguồn lực để sản xuất nhiều loại vắc xin trong thời gian ngắn, với bốn ứng viên vắc xin sẽ được đánh giá trên người vào tháng 3.[36][129]
Vào ngày 24 tháng 6 năm 2020, Trung Quốc đã phê duyệt vắc-xin CanSino để sử dụng hạn chế trong quân đội và hai vắc-xin vi-rút bất hoạt để sử dụng khẩn cấp trong các nghề có nguy cơ cao[67]. Vào ngày 11 tháng 8 năm 2020, Nga đã công bố phê duyệt vắc xin Sputnik V của họ để sử dụng khẩn cấp, mặc dù một tháng sau đó, chỉ một lượng nhỏ vắc xin đã được phân phối để sử dụng ngoài thử nghiệm giai đoạn 3.[59]
Đối tác Pfizer–BioNTech đã đệ trình yêu cầu Cấp phép Sử dụng Khẩn cấp (EUA) cho Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đối với vắc xin mRNA BNT162b2 (thành phần hoạt chất tozinameran) vào ngày 20 tháng 11 năm 2020[60][78]. Vào ngày 2 tháng 12 năm 2020, Thuốc và Chăm sóc sức khỏe của Vương quốc Anh sản phẩm Cơ quan quản lý (MHRA) đã phê duyệt tạm thời theo quy định đối với vắc xin Pfizer–BioNTech[80][130], qua đó trở thành quốc gia đầu tiên phê duyệt vắc xin và là quốc gia đầu tiên ở phương Tây chấp thuận sử dụng một loại vắc xin COVID-19[131][132][133]. Kể từ ngày 21 tháng 12 năm 2020, nhiều quốc gia và Liên minh Châu Âu đã cho phép hoặc phê duyệt vắc xin Pfizer–BioNTech COVID‑19.[134] Bahrain và Các Tiểu vương quốc Ả Rập Thống nhất đã cấp phép tiếp thị khẩn cấp cho BBIBP-CorV, do Sinopharm sản xuất[135][136]. Vào ngày 11 tháng 12 năm 2020, FDA đã cấp EUA cho vắc xin Pfizer–BioNTech COVID‑19[137]. Một tuần sau, họ đã cấp EUA cho mRNA-1273 (thành phần hoạt chất elasomeran), vắc xin Moderna.[138][139][140][141]
Vào ngày 31 tháng 3 năm 2021, chính phủ Nga thông báo rằng họ đã đăng ký vắc xin COVID-19 đầu tiên cho động vật[142]. Được đặt tên là Carnivac-Cov, nó là một loại vắc-xin bất hoạt dành cho động vật ăn thịt, bao gồm cả vật nuôi, nhằm mục đích ngăn ngừa các đột biến xảy ra trong quá trình truyền bệnh SARS-CoV-2 giữa các loài khác nhau.[143]
Vào tháng 6 năm 2021, một báo cáo tiết lộ rằng vắc-xin UB-612, được phát triển bởi COVAXX có trụ sở tại Hoa Kỳ, là một dự án liên doanh thu lợi nhuận do Erik Prince, người sáng lập Blackwater khởi xướng. Trong một loạt tin nhắn văn bản cho Paul Behrends, cộng sự thân cận được tuyển dụng cho dự án COVAXX, Prince đã mô tả khả năng thu lợi nhuận khi bán vắc-xin COVID-19. COVAXX không cung cấp dữ liệu từ các thử nghiệm lâm sàng về tính an toàn hoặc hiệu quả. Trách nhiệm tạo ra các mạng lưới phân phối được giao cho một thực thể có trụ sở tại Abu Dhabi, được đề cập là "Windward Capital" trên giấy tiêu đề COVAXX nhưng thực chất là Windward Holdings. Cổ đông duy nhất của công ty, nơi xử lý "các hoạt động chuyên môn, khoa học và kỹ thuật", là Erik Prince. Vào tháng 3 năm 2021, COVAXX đã huy động được 1,35 tỷ đô la trong một đợt phát hành riêng lẻ.[144]
Thử nghiệm và cấp phép
[sửa | sửa mã nguồn]Các thử nghiệm ở giai đoạn I chủ yếu kiểm tra độ an toàn và liều lượng sơ bộ ở vài chục đối tượng khỏe mạnh, trong khi thử nghiệm giai đoạn II – tiếp theo thành công trong Giai đoạn I – đánh giá khả năng sinh miễn dịch, mức liều (hiệu quả dựa trên dấu ấn sinh học) và tác dụng phụ của vắc xin ứng cử viên, thường với hàng trăm người.[101][102] Một thử nghiệm giai đoạn I–II bao gồm thử nghiệm tính sinh miễn dịch và an toàn sơ bộ, thường là ngẫu nhiên, có đối chứng với giả dược, đồng thời xác định liều chính xác hơn, hiệu quả hơn.[102] Thử nghiệm giai đoạn III thường liên quan đến nhiều người tham gia hơn tại nhiều địa điểm, bao gồm một nhóm đối chứng và thử nghiệm hiệu quả của vắc-xin để ngăn ngừa bệnh (thử nghiệm "can thiệp" hoặc "chủ chốt"), đồng thời theo dõi các tác dụng phụ ở liều tối ưu.[101][102] Định nghĩa về tính an toàn, hiệu quả và các tiêu chí lâm sàng của vắc xin trong một Thử nghiệm giai đoạn III có thể khác nhau giữa các thử nghiệm của các công ty khác nhau, chẳng hạn như xác định mức độ tác dụng phụ, nhiễm trùng hoặc số lượng lây truyền, và liệu vắc xin ngăn ngừa nhiễm COVID-19 mức độ trung bình hay nặng.[103][145][146]
Một thiết kế thử nghiệm lâm sàng đang được tiến hành có thể được sửa đổi thành "thiết kế thích ứng" nếu dữ liệu tích lũy trong thử nghiệm cung cấp những hiểu biết sớm về hiệu quả tích cực hoặc tiêu cực của phương pháp điều trị.[147][148] Các thiết kế thích ứng trong Thử nghiệm giai đoạn II–III đang diễn ra lâm sàng trên vắc xin ứng viên có thể rút ngắn thời gian thử nghiệm và sử dụng ít đối tượng hơn, có thể đẩy nhanh các quyết định về việc kết thúc sớm hoặc thành công, tránh trùng lặp các nỗ lực nghiên cứu và tăng cường phối hợp các thay đổi thiết kế cho thử nghiệm mang tính thống nhất trên khắp các địa điểm quốc tế của nó.[147][149]
Danh sách các loại vắc xin được ủy quyền và phê duyệt
[sửa | sửa mã nguồn]Quy định hàng hóa trị liệu cấp quốc gia đã cấp phép sử dụng khẩn cấp cho 15 loại vắc xin. Sáu trong số đó đã được chấp thuận cho sử dụng khẩn cấp hoặc đầy đủ bởi ít nhất một Danh sách các cơ quan quản lý nghiêm ngặt được WHO công nhận. Đơn xin cấp phép sinh học cho vắc xin Pfizer – BioNTech và Moderna COVID ‑ 19 đã được nộp cho Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA).[150][151]
Tính hiệu quả
[sửa | sửa mã nguồn]
Hiệu quả của vắc-xin là sự giảm thiểu nguy cơ mắc bệnh của những người tham gia được tiêm chủng trong một thử nghiệm có đối chứng so với nguy cơ mắc bệnh của những người tham gia không được tiêm chủng.[153] Hiệu quả bằng 0% có nghĩa là vắc-xin không hoạt động (giống với giả dược). Hiệu quả 50% có nghĩa là có một nửa số trường hợp nhiễm trùng như ở những người không được tiêm chủng.[cần dẫn nguồn]
Hiệu quả của vắc-xin có thể bị ảnh hưởng xấu nếu cánh tay được giữ không đúng cách hoặc siết chặt để vắc-xin được tiêm dưới da thay vì tiêm vào cơ.[154][155] Hướng dẫn của CDC là không lặp lại các liều đã được tiêm dưới da.[156]
Không dễ dàng so sánh hiệu quả của các loại vắc-xin khác nhau vì các thử nghiệm được thực hiện với các quần thể, khu vực địa lý và các biến thể khác nhau của virus.[157] Trong trường hợp COVID-19, hiệu quả của vắc-xin là 67% có thể đủ để làm chậm đại dịch, nhưng điều này giả định rằng vắc-xin tạo ra khả năng miễn dịch tiệt trùng, điều này cần thiết để ngăn ngừa sự lây truyền. Hiệu quả của vắc xin phản ánh khả năng phòng bệnh, một chỉ số kém về khả năng lây truyền của SARS‑CoV ‑ 2 vì những người không có triệu chứng có thể bị lây nhiễm rất cao.[158] Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) và Cơ quan Y tế Châu Âu (EMA) đặt mức giới hạn 50% vì hiệu quả cần thiết để phê duyệt vắc-xin COVID-19, với giới hạn dưới của khoảng tin cậy 95% là lớn hơn 30%.[159][160][161] Đặt mục tiêu đạt tỷ lệ bao phủ tiêm chủng thực tế trên dân số là 75% và tùy thuộc vào số lượng sinh sản cơ bản thực tế, hiệu quả cần thiết của vắc xin COVID-19 được mong đợi cần phải đạt ít nhất 70% để ngăn chặn dịch bệnh và ít nhất 80% để dập tắt dịch bệnh mà không cần các biện pháp khác, chẳng hạn như giãn cách xã hội.[162]
Các khoảng dưới đây là khoảng tin cậy 95% trừ khi có chỉ định khác và tất cả các giá trị dành cho tất cả những người tham gia bất kể tuổi tác, theo các tài liệu tham khảo cho từng thử nghiệm. Theo định nghĩa, độ chính xác của các ước tính không có khoảng tin cậy liên quan không được biết công khai. Hiệu quả chống lại COVID-19 nghiêm trọng là quan trọng nhất, vì các trường hợp nhập viện và tử vong là gánh nặng sức khỏe cộng đồng mà việc phòng ngừa là ưu tiên hàng đầu.[163] Các loại vắc xin được cấp phép và phê duyệt đã cho thấy những hiệu quả sau:
Các nghiên cứu thực tế về hiệu quả của vắc-xin đo lường mức độ mà một loại vắc-xin nhất định đã thành công trong việc ngăn ngừa nhiễm COVID-19, các triệu chứng, nhập viện và tử vong cho những người được tiêm chủng trong một quần thể lớn trong điều kiện thông thường kém hơn lý tưởng.[164]
- Tại Israel, trong số 715.425 người được tiêm vắc xin Moderna hoặc Pfizer-BioNTech trong khoảng thời gian từ ngày 20 tháng 12 năm 2020 đến ngày 28 tháng 1 năm 2021, đã quan sát thấy trong khoảng thời gian bắt đầu từ bảy ngày sau mũi thứ hai, chỉ có 317 người (0,04%) bị bệnh với các triệu chứng Covid-19 nhẹ / trung bình và chỉ có 16 người (0,002%) phải nhập viện.[165]
- Theo báo cáo của Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Hoa Kỳ (CDC), vắc xin Pfizer-BioNTech và Moderna Covid-19 mang lại hiệu quả bảo vệ cao. Trong điều kiện thực tế, hiệu quả của vắc xin mRNA khi tiêm chủng đầy đủ (≥14 ngày sau liều thứ hai) là 90% chống lại nhiễm trùng SARS-CoV-2 bất kể tình trạng triệu chứng; Hiệu quả vắc xin của việc tiêm chủng một phần (≥14 ngày sau liều đầu tiên nhưng trước liều thứ hai) là 80%.[166]
- 15.121 nhân viên y tế từ 104 bệnh viện ở Anh, tất cả đều đã xét nghiệm âm tính với kháng thể COVID-19 trước khi nghiên cứu, được theo dõi bằng xét nghiệm RT-PCR hai lần một tuần từ ngày 7 tháng 12 năm 2020 đến ngày 5 tháng 2 năm 2021, trong thời gian mà biến thể Alpha (dòng B.1.1.7) đang hoành hành với tư cách là biến thể thống trị. Nghiên cứu so sánh kết quả tích cực đối với 90,7% tỷ lệ được tiêm chủng trong nhóm của họ với 9,3% tỷ lệ chưa được tiêm chủng và phát hiện ra rằng vắc xin Pfizer-BioNTech làm giảm tất cả các trường hợp nhiễm trùng (bao gồm cả không có triệu chứng), với tỷ lệ giảm 72% (58-86%) sau ba tuần liều đầu tiên và 86% (76-97%) một tuần sau liều thứ hai.[167][Cần cập nhật]
- Một nghiên cứu về dân số nói chung ở Israel được thực hiện từ ngày 17 tháng 1 đến ngày 6 tháng 3 năm 2021, trong thời gian biến thể Alpha đang hoành hành với tư cách là biến thể nổi trội, đã phát hiện ra rằng vắc-xin Pfizer làm giảm 94% trường hợp nhiễm COVID-19 không có triệu chứng và 97% trường hợp nhiễm COVID-19 có triệu chứng.[168]
- Một nghiên cứu giữa các bệnh nhân trước phẫu thuật trên toàn hệ thống Mayo Clinic ở Hoa Kỳ cho thấy rằng vắc xin mRNA có khả năng bảo vệ 80% đối với các lây nhiễm không có triệu chứng.[169]
- Một nghiên cứu ở Anh cho thấy rằng một liều vắc-xin Oxford – AstraZeneca COVID-19 có hiệu quả khoảng 73% ở những người từ 70 tuổi trở lên.[170]
Các biến thể
[sửa | sửa mã nguồn]Sự tác động lẫn nhau giữa virus SARS-CoV-2 và vật chủ là con người của nó ban đầu là tự nhiên, nhưng hiện đang bị thay đổi do sự có mặt nhanh chóng của vắc xin.[171] Sự xuất hiện tiềm năng của một biến thể SARS-CoV-2 có khả năng kháng vừa phải hoặc hoàn toàn với đáp ứng kháng thể do vắc-xin COVID-19 tạo ra có thể đòi hỏi phải thay đổi các vắc-xin.[172] Các thử nghiệm cho thấy nhiều loại vắc xin được phát triển cho chủng ban đầu có hiệu quả thấp hơn đối với một số biến thể chống lại COVID-19 có triệu chứng.[173] Tính đến tháng 2 năm 2021[cập nhật], Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ tin rằng tất cả các vắc xin được FDA cho phép vẫn có hiệu quả trong việc bảo vệ chống lại các chủng SARS-CoV-2 đang lưu hành.[172]
Alpha (dòng B.1.1.7)
[sửa | sửa mã nguồn]Vào tháng 12 năm 2020, một biến thể SARS‑CoV‑2 mới, biến thể Alpha hoặc dòng B.1.1.7, đã được xác định ở Anh.[174]
Các kết quả ban đầu cho thấy vắc xin Pfizer-BioNTech và Moderna có khả năng bảo vệ người được tiêm trước các biến thể này.[175][176] Một nghiên cứu chỉ ra rằng vắc xin Oxford–AstraZeneca COVID-19 có hiệu quả chống lại biến thể Alpha là 42–89%, so với 71–91% đối với các biến thể khác.[177]
Bằng chứng hạn chế từ các nghiên cứu sơ bộ khác nhau được WHO xem xét đã chỉ ra hiệu lực/hiệu quả được duy trì chống lại bệnh tật từ virus biến thể Alpha khi áp dụng các vắc xin Oxford–AstraZeneca, Pfizer–BioNTech và Novavax, nhưng chưa có dữ liệu cho các vắc xin khác. Liên quan đến cách vắc xin có thể chấm dứt đại dịch bằng cách ngăn ngừa nhiễm trùng không có triệu chứng, họ cũng đã chỉ ra khả năng chống virus của kháng thể thu được của người đã tiêm vắc xin có khả năng chống lại biến thể Alpha với hầu hết các loại vắc xin được phân phối rộng rãi (Sputnik V, Pfizer–BioNTech, Moderna, CoronaVac, BBIBP-CorV, Covaxin), tối thiểu để giảm vừa phải với Oxford-AstraZeneca và chưa có dữ liệu cho các loại vắc xin khác.[178][179]
Beta (dòng B.1.351)
[sửa | sửa mã nguồn]Bằng chứng hạn chế từ các nghiên cứu sơ bộ khác nhau được WHO xem xét đã chỉ ra hiệu quả/hiệu quả chống lại bệnh do biến thể Beta giảm xuống với vắc xin Oxford – AstraZeneca (có thể đáng kể), Novavax (vừa phải), Pfizer – BioNTech và Janssen (tối thiểu), không có dữ liệu cho các loại khác. Liên quan đến cách vắc xin có thể làm chấm dứt đại dịch bằng cách ngăn ngừa nhiễm trùng không có triệu chứng, các nghiên cứu trên cũng đã chỉ ra rằng có thể làm giảm khả năng phòng chống virus của kháng thể thu được của người đã tiêm vắc xin với hầu hết các loại vắc xin được phân phối rộng rãi (Oxford – AstraZeneca, Sputnik V, Janssen, Pfizer–BioNTech, Moderna, Novavax; tối thiểu để giảm đáng kể) ngoại trừ CoronaVac và BBIBP-CorV (giảm tối thiểu đến khiêm tốn), và chưa có dữ liệu cho các vắc xin khác.[180]
Gamma (dòng P.1)
[sửa | sửa mã nguồn]Bằng chứng hạn chế từ các nghiên cứu sơ bộ khác nhau được WHO xem xét đã chỉ ra hiệu lực/hiệu quả có khả năng được duy trì đối với bệnh do biến thể Gamma với CoronaVac và BBIBP-CorV, chưa có dữ liệu cho các vắc xin khác. Liên quan đến cách vắc-xin có thể chấm dứt đại dịch bằng cách ngăn ngừa nhiễm trùng không có triệu chứng, họ cũng đã chỉ ra khả năng phòng chống bệnh với kháng thể thu được của người đã tiêm vắc xin có thể chống lại virus biến thể Gamma bằng Oxford-AstraZeneca và CoronaVac (không giảm hoặc chỉ giảm ở mức tối thiểu) và giảm nhẹ khả năng phòng chống với các vắc xin Pfizer – BioNTech và Moderna (giảm tối thiểu đến trung bình), chưa có dữ liệu cho các loại vắc xin khác.[181]
Delta (dòng B.1.617)
[sửa | sửa mã nguồn]Bằng chứng hạn chế từ các nghiên cứu sơ bộ khác nhau được WHO xem xét đã chỉ ra hiệu lực/hiệu quả chống virus biến thể Delta được duy trì với vắc xin Oxford–AstraZeneca và Pfizer–BioNTech, chưa có dữ liệu cho các vắc xin khác. Liên quan đến cách vắc-xin có thể chấm dứt đại dịch bằng cách ngăn ngừa nhiễm trùng không có triệu chứng, họ cũng đã chỉ ra rằng các kháng thể thu được chống lại biến thể Delta đã bị giảm đối với vắc xin Oxford – AstraZeneca (giảm đáng kể), Pfizer – BioNTech và Covaxin (giảm nhẹ đến trung bình), chưa có dữ liệu cho các loại vắc-xin khác.[182]
Tác dụng của kháng thể trung hòa
[sửa | sửa mã nguồn]Một nghiên cứu cho thấy rằng nồng độ trong ống nghiệm (hiệu giá) của các kháng thể trung hòa được tạo ra bởi vắc-xin COVID-19 là một mối tương quan chặt chẽ của khả năng bảo vệ miễn dịch. Mối quan hệ giữa hoạt động bảo vệ và trung hòa là phi tuyến. Một tỷ lệ kháng thể trung hòa nồng độ thấp nhất là 3% của mức độ nghỉ dưỡng cho kết quả 50% hiệu quả chống lại bệnh nặng, với nồng độ 20% (14-28%) dẫn đến 50% hiệu quả chống lại nhiễm trùng có thể phát hiện được. Lớp bảo vệ chống lại sự lây nhiễm nhanh chóng bị phân hủy, khiến những người dễ bị nhiễm trùng nhẹ, trong khi lớp bảo vệ chống lại bệnh nặng phần lớn được giữ lại và lâu bền hơn nhiều. Thời gian bán hủy quan sát được của hiệu giá trung hòa là 65 ngày đối với vắc xin mRNA ( Pfizer–BioNTech và Moderna) trong 4 tháng đầu tiên, tăng lên 108 ngày trong 8 tháng. Hiệu quả ban đầu cao hơn chống lại sự lây nhiễm có khả năng dẫn đến mức độ bảo vệ cao hơn chống lại bệnh hiểm nghèo về lâu dài (hơn 10 năm, như đã thấy trong các loại vắc xin khác như đậu mùa, sởi, quai bị và rubella), mặc dù các tác giả thừa nhận rằng chúng chỉ mô phỏng xem xét việc bảo vệ khỏi các kháng thể trung hòa và bỏ qua các cơ chế bảo vệ miễn dịch khác, chẳng hạn như miễn dịch qua trung gian tế bào, có thể có tác dụng lâu bền hơn. Quan sát này cũng áp dụng cho hiệu quả chống lại các biến thể và đặc biệt có ý nghĩa đối với vắc xin có hiệu quả ban đầu thấp hơn; ví dụ, giảm 5 lần trung hòa sẽ cho thấy hiệu quả ban đầu giảm từ 95% xuống 77% đối với một biến thể cụ thể và từ hiệu quả thấp hơn 70% xuống 32% đối với biến thể đó. Đối với vắc-xin Oxford-AstraZeneca, hiệu quả quan sát được thấp hơn khoảng tin cậy 95% dự đoán. Hiệu quả trên là cao hơn đối với Sputnik V và phản ứng dưỡng bệnh, và nằm trong khoảng thời gian dự đoán đối với các vắc xin khác được đánh giá ( Pfizer – BioNTech, Moderna, Janssen, CoronaVac, Covaxin, Novavax).[183]
Phản ứng của bệnh nhân mắc các bệnh đã có từ trước
[sửa | sửa mã nguồn]Ung thư máu
[sửa | sửa mã nguồn]Trong một nghiên cứu về phản ứng huyết thanh với vắc-xin ARN thông tin COVID-19 ở bệnh nhân ung thư hạch, bệnh bạch cầu và u tủy, người ta thấy rằng một phần tư số bệnh nhân không tạo ra kháng thể có thể đo được, thay đổi theo loại ung thư máu. Những bệnh nhân mắc các tình trạng này cần phải thực hiện các biện pháp phòng ngừa để tránh tiếp xúc với COVID-19.[184]
Tác dụng phụ
[sửa | sửa mã nguồn]Các tác dụng phụ nghiêm trọng liên quan đến việc nhận vắc xin mới nhắm mục tiêu COVID-19 đang được công chúng quan tâm.[185] Tất cả các loại vắc xin được sử dụng qua việc tiêm bắp thịt, bao gồm cả vắc xin COVID-19, có tác dụng phụ liên quan đến chấn thương nhẹ liên quan đến thủ thuật và đưa chất lạ vào cơ thể.[186] Chúng bao gồm đau nhức, mẩn đỏ, phát ban và viêm tại chỗ tiêm. Các tác dụng phụ thường gặp khác bao gồm mệt mỏi, nhức đầu, đau mỏi cơ, và đau khớp mà sẽ tự khỏi trong vòng vài ngày.[187] Một tác dụng phụ ít thường xuyên hơn (thường xảy ra ở dưới 1/1.000 người) là quá mẫn cảm (dị ứng) với một hoặc nhiều thành phần của vắc-xin, trong một số trường hợp hiếm gặp có thể gây ra phản vệ.[188][189][190][191][192]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Các tác dụng phụ nghiêm trọng hơn rất hiếm khi xảy ra bởi vì vắc xin sẽ không được chấp thuận ngay cả khi sử dụng khẩn cấp nếu nó có bất kỳ tác dụng phụ nghiêm trọng thường xuyên nào đã biết. Ví dụ, vắc xin Janssen COVID-19 đã báo cáo sự hình thành huyết khối hiếm gặp trong mạch máu kết hợp với mức độ thấp của tiểu cầu trong máu được gọi là huyết khối với hội chứng giảm tiểu cầu (TTS) xảy ra với tỷ lệ khoảng 7 trên 1 triệu phụ nữ được tiêm chủng ở độ tuổi. 18–49 tuổi; và thậm chí hiếm hơn đối với các quần thể khác.[194] Theo CDC, một số ca bệnh hiếm của chứng viêm cơ tim và viêm màng ngoài tim đã được báo cáo ở Hoa Kỳ, với tỷ lệ khoảng 13 phần triệu người trẻ (chủ yếu là nam giới và chủ yếu trên 16 tuổi), sau khi tiêm chủng vắc xin Pfizer–BioNTech's hoặc Moderna.[195] Theo báo cáo, sự phục hồi sau những tác dụng phụ hiếm gặp này diễn ra nhanh chóng ở hầu hết mọi người, sau khi điều trị và nghỉ ngơi đầy đủ.[196]
Tiếp cận
[sửa | sửa mã nguồn]

Các quốc gia cam kết mua liều vắc-xin COVID-19 trước khi vắc xin được đưa ra thị trường. Mặc dù các quốc gia có thu nhập cao chỉ chiếm 14% dân số toàn cầu, nhưng tính đến ngày 15 tháng 11 năm 2020, các quốc gia này đã ký hợp đồng mua 51% tất cả các liều thuốc đã được bán trước. Một số quốc gia có thu nhập cao đã mua nhiều liều hơn mức cần thiết để tiêm chủng cho toàn bộ dân số của họ.[197]
Vào ngày 18 tháng 1 năm 2021, Tổng Giám đốc WHO Tedros Adhanom Ghebreyesus cảnh báo về các vấn đề trong việc phân phối vắc xin một cách công bằng: "Hơn 39 triệu liều vắc xin hiện đã được tiêm ở ít nhất 49 quốc gia có thu nhập cao hơn. Chỉ 25 liều đã được tiêm ở một quốc gia có thu nhập thấp nhất. Không phải 25 triệu; không phải 25 nghìn; chỉ 25 liều."[198]
Vào tháng 3, có thông tin tiết lộ rằng Mỹ đã cố gắng thuyết phục Brazil không mua vắc xin Sputnik V COVID-19 vì lo ngại "ảnh hưởng của Nga" ở Mỹ Latinh.[199] Một số quốc gia liên quan đến các tranh chấp lãnh thổ lâu đời được cho là đã bị các quốc gia cạnh tranh ngăn chặn quyền tiếp cận vắc-xin; Palestine cáo buộc Israel ngăn chặn việc cung cấp vắc xin tới Gaza, trong khi Đài Loan cho rằng Trung Quốc đã cản trở nỗ lực mua vắc xin của họ.[200][201][202]
Theo nhà miễn dịch học, Tiến sĩ Anthony Fauci, các chủng virus đột biến và việc phân phối vắc xin hạn chế gây ra những rủi ro liên tục và ông nói: "Chúng ta phải tiêm chủng cho toàn thế giới, không chỉ riêng đất nước của chúng ta."[203] Edward Bergmark và Arick Wierson đang kêu gọi một nỗ lực tiêm chủng toàn cầu và viết rằng tâm lý "bản thân là trên hết" của các quốc gia giàu có cuối cùng có thể phản tác dụng, bởi vì sự lây lan của virus ở các quốc gia nghèo hơn sẽ dẫn đến nhiều biến thể hơn, khiến việc chống lại vắc xin trở nên kém hiệu quả.[204]
Vào ngày 10 tháng 3 năm 2021, Hoa Kỳ, Anh, các quốc gia thuộc Liên minh Châu Âu và các thành viên khác của WTO đã ngăn chặn việc thúc đẩy hơn 80 quốc gia đang phát triển từ bỏ quyền bằng sáng chế vắc xin COVID-19 trong nỗ lực thúc đẩy sản xuất vắc xin cho các quốc gia nghèo.[205] Vào ngày 5 tháng 5 năm 2021, chính quyền Biden thông báo rằng họ ủng hộ việc từ bỏ các biện pháp bảo vệ quyền sở hữu trí tuệ đối với vắc xin COVID-19.[206] Các thành viên của Nghị viện Châu Âu đã ủng hộ một kiến nghị yêu cầu tạm thời dỡ bỏ các quyền sở hữu trí tuệ đối với vắc xin COVID-19.[207] Phó chủ tịch Ủy ban Valdis Dombrovskis nhấn mạnh rằng trong khi EU sẵn sàng thảo luận về vấn đề miễn trừ bằng sáng chế, các giải pháp được đề xuất của họ bao gồm hạn chế xuất khẩu, giải quyết nghẽn cổ chai trong quá trình sản xuất, xem xét cấp phép bắt buộc, đầu tư vào năng lực sản xuất ở các nước đang phát triển và tăng cường đóng góp cho kế hoạch phân phối vắc xin COVAX.[208]


Trong một cuộc họp vào tháng 4 năm 2021, ủy ban khẩn cấp của Tổ chức Y tế Thế giới đã giải quyết những lo ngại về sự bất bình đẳng dai dẳng trong việc phân phối vắc xin toàn cầu.[209] Mặc dù 9 phần trăm dân số thế giới sống ở 29 quốc gia nghèo nhất, các quốc gia này chỉ nhận được 0,3% tổng số vắc xin được sử dụng tính đến tháng 5 năm 2021.[210] Trong một bài báo của Agência Pública từ ngày 15 tháng 3 năm 2021, Brazil đã tiêm chủng cho người da trắng nhiều hơn gấp đôi so với người da đen và nhận thấy thực tế là tỷ lệ tử vong do COVID-19 ở người da đen lớn hơn.[211]
Vào tháng 5 năm 2021, UNICEF đã đưa ra lời kêu gọi khẩn cấp đối với các quốc gia công nghiệp phát triển để gộp lượng vắc xin COVID-19 dư thừa của các nước này để bù đắp khoảng trống 125 triệu liều trong chương trình COVAX. Chương trình chủ yếu dựa vào vắc-xin Oxford – AstraZeneca COVID-19 do SRI sản xuất, vốn phải đối mặt với các vấn đề nghiêm trọng về nguồn cung do nhu cầu vắc-xin trong nước tăng lên ở Ấn Độ từ tháng 3 đến tháng 6 năm 2021. Chỉ có một số lượng vắc xin hạn chế có thể được phân phối hiệu quả, và sự thiếu hụt vắc xin ở Nam Mỹ và các khu vực của châu Á là do thiếu nguồn tài trợ thích hợp của các quốc gia giàu có hơn. Các tổ chức viện trợ quốc tế đã chỉ ra Nepal, Sri Lanka và Maldives cũng như Argentina và Brazil, và một số khu vực của Caribe là những khu vực có vấn đề, với nguồn cung vắc xin đang thiếu hụt. UNICEF cũng rất tập trung vào việc đề xuất tài trợ vắc xin Moderna và Pfizer vì chúng không được dự kiến giao cho đến nửa cuối năm 2021 hoặc đầu năm 2022.[212]
Vào ngày 1 tháng 7 năm 2021, những người đứng đầu Nhóm Ngân hàng Thế giới, Quỹ Tiền tệ Quốc tế, Tổ chức Y tế Thế giới và Tổ chức Thương mại Thế giới cho biết trong một tuyên bố chung: "Do nhiều quốc gia đang phải vật lộn với các biến thể mới và làn sóng thứ ba nhiễm COVID-19, đang gia tăng tiếp cận với vắc xin càng trở nên quan trọng hơn để chấm dứt đại dịch ở khắp mọi nơi và đạt được sự phát triển trên diện rộng. Chúng tôi quan tâm sâu sắc đến các loại vắc xin, phương pháp điều trị, chẩn đoán và hỗ trợ cung cấp cho các nước đang phát triển. "[213][214] Vào tháng 7 năm 2021, BMJ báo cáo rằng các quốc gia đã vứt đi hơn 250.000 liều vắc xin do cung vượt quá cầu và luật nghiêm ngặt ngăn cản việc chia sẻ vắc xin.[215] Một cuộc khảo sát của The New York Times cho thấy hơn một triệu liều vắc-xin đã bị vứt bỏ ở mười tiểu bang của Hoa Kỳ.[216]
Việc tối ưu hóa lợi ích xã hội của việc tiêm chủng có thể được hưởng lợi từ một chiến lược phù hợp với tình trạng đại dịch, nhân khẩu học của một quốc gia, độ tuổi của người nhận, sự sẵn có của vắc xin và nguy cơ mắc bệnh nặng của cá nhân: Ở Anh, khoảng thời gian giữa liều chính và liều tăng cường đã được kéo dài để tiêm chủng càng sớm càng tốt cho nhiều người,[217] nhiều quốc gia đang bắt đầu tiêm bổ sung một mũi tăng cường cho người bị ức chế miễn dịch[218][219] và người cao tuổi,[220] và nghiên cứu dự đoán một lợi ích bổ sung của việc cá nhân hóa liều lượng vắc-xin trong bối cảnh khả năng sử dụng vắc-xin hạn chế khi một làn sóng các biến thể đáng lo ngại của virus này tấn công một quốc gia.[221]

Mặc dù vắc-xin làm giảm đáng kể xác suất nhiễm trùng, nhưng những người được tiêm chủng đầy đủ vẫn có thể mắc và lây lan COVID-19.[222] Các cơ quan y tế đã khuyến cáo những người được tiêm chủng tiếp tục sử dụng các biện pháp phòng bệnh (đeo khẩu trang, giữ khoảng cách xã hội, rửa tay) để tránh lây nhiễm cho người khác, đặc biệt là những người dễ bị tổn thương, đặc biệt ở những vùng có cộng đồng lây lan cao. Các chính phủ đã chỉ ra rằng các khuyến nghị như vậy sẽ giảm xuống khi tỷ lệ tiêm chủng tăng lên và sự lây lan trong cộng đồng giảm.[223]
Trách nhiệm pháp lý
[sửa | sửa mã nguồn]Về luật pháp, có những lá chắn trách nhiệm được áp dụng để bảo vệ các công ty dược phẩm như Pfizer và Moderna khỏi những tuyên bố sơ suất liên quan đến vắc xin COVID-19 (và phương pháp điều trị). Các lá chắn trách nhiệm này có hiệu lực vào ngày 4 tháng 2 năm 2020, khi Bộ trưởng Bộ Y tế và Dịch vụ Nhân sinh Hoa Kỳ Alex Azar công bố thông báo tuyên bố theo Đạo luật Sẵn sàng Công và Chuẩn bị Khẩn cấp (Đạo luật PREP) cho các biện pháp y tế chống lại COVID ‑ 19, bao gồm "bất kỳ loại vắc xin nào, được sử dụng để điều trị, chẩn đoán, chữa bệnh, ngăn ngừa hoặc giảm thiểu COVID ‑ 19, hoặc sự lây truyền SARS-CoV-2 hoặc virus đột biến từ đó ". Tuyên bố loại trừ "các khiếu nại về trách nhiệm pháp lý cáo buộc nhà sản xuất sơ suất trong việc tạo ra vắc-xin hoặc do nhà cung cấp dịch vụ chăm sóc sức khỏe sơ suất trong việc kê đơn sai liều lượng, không có hành vi cố ý". Nói cách khác, không có "hành vi sai trái cố ý", các công ty này không thể bị kiện đòi tiền bồi thường thiệt hại cho bất kỳ thương tích nào xảy ra từ năm 2020 đến năm 2024 do việc quản lý vắc-xin và phương pháp điều trị liên quan đến COVID-19.[224] Tuyên bố có hiệu lực tại Hoa Kỳ kể từ ngày 1 tháng 10 năm 2024.[224]
Vào tháng 12 năm 2020, chính phủ Vương quốc Anh đã cho phép Pfizer không phải chịu trách nhiệm luật pháp đối với vắc xin COVID-19 của mình.[225][225]
Tại Liên minh Châu Âu, vắc-xin COVID-19 được cấp phép theo Giấy phép Tiếp thị Có Điều kiện, không miễn trừ cho các nhà sản xuất khỏi các khiếu nại về trách nhiệm dân sự và hành chính.[226] Mặc dù các hợp đồng mua bán với các nhà sản xuất vắc xin vẫn được giữ bí mật, nhưng chúng không bao gồm việc miễn trừ trách nhiệm ngay cả đối với các tác dụng phụ chưa được biết tại thời điểm cấp phép.[227]
Cục Báo chí Điều tra, một tổ chức tin tức phi lợi nhuận, đã báo cáo trong một cuộc điều tra rằng các quan chức giấu tên ở một số quốc gia, chẳng hạn như Argentina và Brazil, nói rằng Pfizer yêu cầu bảo đảm chống lại các chi phí pháp lý do các tác động bất lợi dưới hình thức miễn trừ trách nhiệm và chủ quyền. các tài sản như dự trữ ngân hàng liên bang, tòa nhà đại sứ quán hoặc căn cứ quân sự, vượt xa dự kiến từ các quốc gia khác như Mỹ.[228] Trong cuộc điều tra của quốc hội về đại dịch ở Brazil, đại diện của Pfizer nói rằng các điều khoản của họ đối với Brazil cũng giống như đối với tất cả các quốc gia khác mà họ đã ký kết các thỏa thuận.[229]
Những tin đồn và thông tin sai lệch
[sửa | sửa mã nguồn]Truyền thông trên các mạng xã hội đã thúc đẩy một thuyết âm mưu cho rằng virus đằng sau COVID-19, SARS-CoV-2, đã được biết đến từ trước và đã có vắc-xin, nhưng thực tế là vẫn chưa có. Các tài liệu nghiên cứu được các bài viết truyền thông xã hội dẫn nguồn là các nghiên cứu đã tồn tại về giải mã trình tự bộ gen và vắc-xin cho những chủng coronavirus khác, ví dụ như SARS coronavirus.[230][231]
Chú thích
[sửa | sửa mã nguồn]- ^ Li YD, Chi WY, Su JH, Ferrall L, Hung CF, Wu TC (tháng 12 năm 2020). “Coronavirus vaccine development: from SARS and MERS to COVID-19”. Journal of Biomedical Science. 27 (1): 104. doi:10.1186/s12929-020-00695-2. PMC 7749790. PMID 33341119.
- ^ “No one is safe unless everyone is safe”. BusinessWorld. 24 tháng 2 năm 2021. Truy cập ngày 24 tháng 2 năm 2021.
- ^ Vergano, Dan (5 tháng 6 năm 2021). “COVID-19 Vaccines Work Way Better Than We Had Ever Expected. Scientists Are Still Figuring Out Why”. BuzzFeed News. Truy cập ngày 24 tháng 6 năm 2021.
- ^ a b c d “COVID-19 vaccine tracker (Refresh URL to update)”. vac-lshtm.shinyapps.io. London School of Hygiene & Tropical Medicine. 12 tháng 7 năm 2021. Truy cập ngày 10 tháng 3 năm 2021.
- ^ “Approved Vaccines”. COVID 19 Vaccine Tracker, McGill University. 12 tháng 7 năm 2021.
- ^ a b “"COVID-19 vaccine development pipeline (Refresh URL to update)". Vaccine Centre, London School of Hygiene and Tropical Medicine. 1 March 2021. Retrieved 10 March 2021”.
- ^ Beaumont, Peter (18 tháng 11 năm 2020). “Covid-19 vaccine: who are countries prioritising for first doses?”. The Guardian. ISSN 0261-3077. Truy cập ngày 26 tháng 12 năm 2020.
- ^ Plotkin, Stanley A.; Halsey, Neal (tháng 1 năm 2021). “Accelerate COVID-19 Vaccine Rollout by Delaying the Second Dose of mRNA Vaccines”. Clinical Infectious Diseases. doi:10.1093/cid/ciab068. PMC 7929065. PMID 33502467.
- ^ Epperly D (tháng 1 năm 2021). “Evidence For COVID-19 Vaccine Deferred Dose 2 Boost Timing”. SSRN 3760833.
- ^ Wang X (tháng 2 năm 2021). “Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine”. N Engl J Med (letter). 384 (11): 1576–78. doi:10.1056/NEJMc2036242. PMID 33596350.
- ^ “More Evidence: Evidence For COVID-19 Vaccine Deferred Dose 2 Boost Timing”. ReallyCorrect.com. 25 tháng 5 năm 2021.
- ^ “Wang X (February 2021). "Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine". N Engl J Med (letter). 384 (11): 1576–78. doi:10.1056/NEJMc2036242. PMID 33596350”.
- ^ “"Coronavirus (COVID-19) Vaccinations – Statistics and Research". Our World in Data. Retrieved 7 February 2021”.
- ^ “"Which companies will likely produce the most COVID-19 vaccine in 2021?". Pharmaceutical Processing World. 5 February 2021. Retrieved 1 March 2021”.
- ^ “Mullard A (November 2020). "How COVID vaccines are being divvied up around the world". Nature. doi:10.1038/d41586-020-03370-6. PMID 33257891. S2CID 227246811”.
- ^ “So AD, Woo J (December 2020). "Reserving coronavirus disease 2019 vaccines for global access: cross sectional analysis". BMJ. 371: m4750. doi:10.1136/bmj.m4750. PMC 7735431. PMID 33323376”.
- ^ Cavanagh, Dave (2003). “Severe acute respiratory syndrome vaccine development: Experiences of vaccination against avian infectious bronchitis coronavirus”. Avian Pathology. 32 (6): 567–582. doi:10.1080/03079450310001621198. PMID 14676007.
- ^ Gao, Wentao; Tamin, Azaibi; Soloff, Adam; d'Aiuto, Leonardo; Nwanegbo, Edward; Robbins, Paul D.; Bellini, William J.; Barratt-Boyes, Simon; Gambotto, Andrea (2003). “Effects of a SARS-associated coronavirus vaccine in monkeys”. The Lancet. 362 (9399): 1895–1896. doi:10.1016/S0140-6736(03)14962-8. PMID 14667748.
- ^ Kim, Eun; Okada, Kaori; Kenniston, Tom; Raj, V. Stalin; Alhajri, Mohd M.; Farag, Elmoubasher A.B.A.; Alhajri, Farhoud; Osterhaus, Albert D.M.E.; Haagmans, Bart L.; Gambotto, Andrea (2014). “Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/C mice”. Vaccine. 32 (45): 5975–5982. doi:10.1016/j.vaccine.2014.08.058. PMID 25192975.
- ^ a b Jiang, Shibo; Lu, Lu; Du, Lanying (2013). “Development of SARS vaccines and therapeutics is still needed”. Future Virology. 8 (1): 1–2. doi:10.2217/fvl.12.126.
- ^ “SARS (severe acute respiratory syndrome)”. National Health Service. ngày 5 tháng 3 năm 2020. Lưu trữ bản gốc ngày 9 tháng 3 năm 2020. Truy cập ngày 31 tháng 1 năm 2020.
- ^ Greenough, Thomas C.; Babcock, Gregory J.; Roberts, Anjeanette; Hernandez, Hector J.; và đồng nghiệp (ngày 15 tháng 2 năm 2005). “Development and Characterization of a Severe Acute Respiratory Syndrome–Associated Coronavirus–Neutralizing Human Monoclonal Antibody That Provides Effective Immunoprophylaxis in Mice”. The Journal of Infectious Diseases. 191 (4): 507–14. doi:10.1086/427242. PMID 15655773.
- ^ Tripp, Ralph A.; Haynes, Lia M.; Moore, Deborah; Anderson, Barbara; và đồng nghiệp (tháng 9 năm 2005). “Monoclonal antibodies to SARS-associated coronavirus (SARS-CoV): Identification of neutralizing and antibodies reactive to S, N, M and E viral proteins”. Journal of Virological Methods. 128 (1–2): 21–8. doi:10.1016/j.jviromet.2005.03.021. PMID 15885812.
- ^ Roberts, Anjeanette; Thomas, William D.; Guarner, Jeannette; Lamirande, Elaine W.; và đồng nghiệp (tháng 3 năm 2006). “Therapy with a Severe Acute Respiratory Syndrome–Associated Coronavirus–Neutralizing Human Monoclonal Antibody Reduces Disease Severity and Viral Burden in Golden Syrian Hamsters”. The Journal of Infectious Diseases. 193 (5): 685–92. doi:10.1086/500143. PMID 16453264.
- ^ Shehata, M.M., Gomaa, M.R., Ali, M.A. et al. Middle East respiratory syndrome coronavirus: a comprehensive review. Front. Med. 10, 120–136 (2016). doi:10.1007/s11684-016-0430-6
- ^ Butler, Declan (tháng 10 năm 2012). “SARS veterans tackle coronavirus”. Nature. 490 (7418): 20. Bibcode:2012Natur.490...20B. doi:10.1038/490020a. PMID 23038444.
- ^ “Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial”. doi:10.1016/S1473-3099(19)30266-X. PMID 31351922. Chú thích journal cần
|journal=(trợ giúp) - ^ “Safety and Immunogenicity of a Candidate MERS-CoV Vaccine (MERS001)”. Truy cập ngày 18 tháng 3 năm 2020.
- ^ “Safety and Immunogenicity of a Candidate MERS-CoV Vaccine (MERS002)”. Truy cập ngày 18 tháng 3 năm 2020.
- ^ “Study of Safety and Immunogenicity of BVRS-GamVac”. Truy cập ngày 18 tháng 3 năm 2020.
- ^ “Safety, Tolerability and Immunogenicity of Vaccine Candidate MVA-MERS-S”. Truy cập ngày 18 tháng 3 năm 2020.
- ^ “Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus”. doi:10.3389/fmicb.2019.01781. PMID 31428074. Chú thích journal cần
|journal=(trợ giúp) - ^ Flanagan KL, Best E, Crawford NW, Giles M, Koirala A, Macartney K, và đồng nghiệp (2020). “Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines”. Frontiers in Immunology. 11: 579250. doi:10.3389/fimmu.2020.579250. PMC 7566192. PMID 33123165.
- ^ a b c d e f Le TT, Cramer JP, Chen R, Mayhew S (tháng 10 năm 2020). “Evolution of the COVID-19 vaccine development landscape”. Nature Reviews. Drug Discovery. 19 (10): 667–68. doi:10.1038/d41573-020-00151-8. PMID 32887942.
- ^ a b Gates B (30 tháng 4 năm 2020). “The vaccine race explained: What you need to know about the COVID-19 vaccine”. The Gates Notes. Lưu trữ bản gốc ngày 14 tháng 5 năm 2020. Truy cập ngày 2 tháng 5 năm 2020.
- ^ a b c d e f g h Thanh Le T, Andreadakis Z, Kumar A, Gómez Román R, Tollefsen S, Saville M, Mayhew S (tháng 5 năm 2020). “The COVID-19 vaccine development landscape”. Nature Reviews. Drug Discovery. 19 (5): 305–06. doi:10.1038/d41573-020-00073-5. PMID 32273591.
- ^ a b c Diamond MS, Pierson TC (tháng 5 năm 2020). “The Challenges of Vaccine Development against a New Virus during a Pandemic”. Cell Host & Microbe. 27 (5): 699–703. doi:10.1016/j.chom.2020.04.021. PMC 7219397. PMID 32407708.
- ^ Cross, Ryan (29 tháng 9 năm 2020). “The tiny tweak behind COVID-19 vaccines”. Chemical & Engineering News. 98 (38).
- ^ Krammer F (tháng 10 năm 2020). “SARS-CoV-2 vaccines in development”. Nature. 586 (7830): 516–27. Bibcode:2020Natur.586..516K. doi:10.1038/s41586-020-2798-3. PMID 32967006.
- ^ Park KS, Sun X, Aikins ME, Moon JJ (tháng 2 năm 2021). “Non-viral COVID-19 vaccine delivery systems”. Advanced Drug Delivery Reviews. 169: 137–51. doi:10.1016/j.addr.2020.12.008. PMC 7744276. PMID 33340620.
- ^ Kowalski PS, Rudra A, Miao L, Anderson DG (tháng 4 năm 2019). “Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery”. Molecular Therapy. 27 (4): 710–28. doi:10.1016/j.ymthe.2019.02.012. PMC 6453548. PMID 30846391.
- ^ Verbeke R, Lentacker I, De Smedt SC, Dewitte H (tháng 10 năm 2019). “Three decades of messenger RNA vaccine development”. Nano Today. 28: 100766. doi:10.1016/j.nantod.2019.100766.
- ^ “COVID-19 ACIP Vaccine Recommendations”. U.S. Centers for Disease Control and Prevention (CDC). Truy cập ngày 18 tháng 2 năm 2021.
- ^ “Safe COVID-19 vaccines for Europeans”. European Commission – European Commission. Truy cập ngày 19 tháng 2 năm 2021.
- ^ “Regulatory Decision Summary – Pfizer–BioNTech COVID-19 Vaccine”. Health Canada, Government of Canada. 9 tháng 12 năm 2020. Truy cập ngày 9 tháng 12 năm 2020.
- ^ “Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults”. ClinicalTrials.gov. 30 tháng 4 năm 2020. NCT04368728. Lưu trữ bản gốc ngày 11 tháng 10 năm 2020. Truy cập ngày 14 tháng 7 năm 2020.
- ^ “A Multi-site Phase I/II, 2-Part, Dose-Escalation Trial Investigating the Safety and Immunogenicity of four Prophylactic SARS-CoV-2 RNA Vaccines Against COVID-19 Using Different Dosing Regimens in Healthy Adults”. EU Clinical Trials Register. European Union. 14 tháng 4 năm 2020. EudraCT 2020-001038-36. Lưu trữ bản gốc ngày 22 tháng 4 năm 2020. Truy cập ngày 22 tháng 4 năm 2020.
- ^ “A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19”. ClinicalTrials.gov. 14 tháng 7 năm 2020. NCT04470427. Lưu trữ bản gốc ngày 11 tháng 10 năm 2020. Truy cập ngày 27 tháng 7 năm 2020.
- ^ “COVID-19 vaccine candidate heads to widespread testing in U.S.”. NPR. 27 tháng 7 năm 2020. Bản gốc lưu trữ ngày 11 tháng 10 năm 2020. Truy cập ngày 27 tháng 7 năm 2020.
- ^ “CureVac Final Data from Phase 2b/3 Trial of First-Generation COVID-19 Vaccine Candidate, CVnCoV, Demonstrates Protection in Age Group of 18 to 60” (Thông cáo báo chí). 30 tháng 6 năm 2021. Truy cập ngày 2 tháng 7 năm 2021.
- ^ Commissioner, Office of the (24 tháng 9 năm 2021). “Comirnaty and Pfizer-BioNTech COVID-19 Vaccine”. FDA (bằng tiếng Anh).
- ^ a b c Moghimi SM (2021). “Allergic Reactions and Anaphylaxis to LNP-Based COVID-19 Vaccines”. Molecular Therapy. 29 (3): 898–900. doi:10.1016/j.ymthe.2021.01.030. PMC 7862013. PMID 33571463.
- ^ a b “What are viral vector-based vaccines and how could they be used against COVID-19?”. Gavi, the Vaccine Alliance (GAVI). 2020. Truy cập ngày 26 tháng 1 năm 2021.
- ^ “Understanding Viral Vector COVID-19 Vaccines”. U.S. Centers for Disease Control and Prevention (CDC). 13 tháng 4 năm 2021. Truy cập ngày 19 tháng 4 năm 2021.
- ^ “Investigating a Vaccine Against COVID-19”. ClinicalTrials.gov. 26 tháng 5 năm 2020. NCT04400838. Lưu trữ bản gốc ngày 11 tháng 10 năm 2020. Truy cập ngày 14 tháng 7 năm 2020.
- ^ “A Phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19”. EU Clinical Trials Register. European Union. 21 tháng 4 năm 2020. EudraCT 2020-001228-32. Lưu trữ bản gốc ngày 5 tháng 10 năm 2020. Truy cập ngày 3 tháng 8 năm 2020.
- ^ O'Reilly P (26 tháng 5 năm 2020). “A Phase III study to investigate a vaccine against COVID-19”. doi:10.1186/ISRCTN89951424. ISRCTN89951424. Chú thích journal cần
|journal=(trợ giúp) - ^ “How Gamaleya's Vaccine Works”. The New York Times. 8 tháng 1 năm 2021. Truy cập ngày 27 tháng 1 năm 2021.
- ^ a b “A Study of Ad26.COV2.S in Adults”. 4 tháng 8 năm 2020. Lưu trữ bản gốc ngày 16 tháng 9 năm 2020. Truy cập ngày 23 tháng 8 năm 2020.
- ^ a b “A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants”. US National Library of Medicine. Lưu trữ bản gốc ngày 26 tháng 9 năm 2020.
- ^ “Johnson & Johnson seeks emergency FDA authorization for single-shot coronavirus vaccine”. The Washington Post.
- ^ “It's not just Johnson & Johnson: China has a single-dose COVID-19 vaccine that's 65% effective”. Fortune. Truy cập ngày 28 tháng 2 năm 2021.
- ^ Wu S, Zhong G, Zhang J, Shuai L, Zhang Z, Wen Z, và đồng nghiệp (tháng 8 năm 2020). “A single dose of an adenovirus-vectored vaccine provides protection against SARS-CoV-2 challenge”. Nat Commun. 11 (1): 4081. Bibcode:2020NatCo..11.4081W. doi:10.1038/s41467-020-17972-1. PMC 7427994. PMID 32796842.
- ^ Petrovsky N, Aguilar JC (tháng 10 năm 2004). “Vaccine adjuvants: current state and future trends”. Immunology and Cell Biology. 82 (5): 488–96. doi:10.1111/j.0818-9641.2004.01272.x. PMID 15479434.
- ^ “Safety and Immunogenicity Study of Inactivated Vaccine for Prevention of SARS-CoV-2 Infection (COVID-19) (Renqiu)”. ClinicalTrials.gov. 12 tháng 5 năm 2020. NCT04383574. Lưu trữ bản gốc ngày 11 tháng 10 năm 2020. Truy cập ngày 14 tháng 7 năm 2020.
- ^ “Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV)”. ClinicalTrials.gov. 2 tháng 7 năm 2020. NCT04456595. Lưu trữ bản gốc ngày 11 tháng 10 năm 2020. Truy cập ngày 3 tháng 8 năm 2020.
- ^ a b PT. Bio Farma (10 tháng 8 năm 2020). “A Phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-COV-2 inactivated vaccine in healthy adults aged 18–59 years in Indonesia”. Registri Penyakit Indonesia. Truy cập ngày 15 tháng 8 năm 2020.
- ^ Chen W, Al Kaabi N (18 tháng 7 năm 2020). “A Phase III clinical trial for inactivated novel coronavirus pneumonia (COVID-19) vaccine (Vero cells)”. Chinese Clinical Trial Registry. Bản gốc lưu trữ ngày 11 tháng 10 năm 2020. Truy cập ngày 15 tháng 8 năm 2020.
- ^ Ivanova P (20 tháng 2 năm 2021). “Russia approves its third COVID-19 vaccine, CoviVac”. Reuters. Truy cập ngày 11 tháng 4 năm 2021.
- ^ “Kazakhstan rolls out its own COVID-19 vaccine”. Reuters. 27 tháng 4 năm 2021. Truy cập ngày 2 tháng 7 năm 2021.
- ^ “VLA2001 COVID-19 Vaccine”. Precision Vaccinations. 31 tháng 12 năm 2020. Truy cập ngày 11 tháng 1 năm 2021.
- ^ “Dose Finding Study to Evaluate Safety, Tolerability and Immunogenicity of an Inactiviated Adjuvanted Sars-Cov-2 Virus Vaccine Candidate Against Covid-19 in Healthy Adults”. U.S. National Library of Medicine. 30 tháng 12 năm 2020. Truy cập ngày 11 tháng 1 năm 2021.
- ^ “Module 2 – Subunit vaccines”. WHO Vaccine Safety Basics.
- ^ “Study of the Safety, Reactogenicity and Immunogenicity of "EpiVacCorona" Vaccine for the Prevention of COVID-19 (EpiVacCorona)”. ClinicalTrials.gov. 22 tháng 9 năm 2020. NCT04368988. Truy cập ngày 16 tháng 11 năm 2020.
- ^ “Evaluation of the Safety and Immunogenicity of a SARS-CoV-2 rS (COVID-19) Nanoparticle Vaccine With/Without Matrix-M Adjuvant”. ClinicalTrials.gov. 30 tháng 4 năm 2020. NCT04368988. Lưu trữ bản gốc ngày 14 tháng 7 năm 2020. Truy cập ngày 14 tháng 7 năm 2020.
- ^ “A Study on the Safety, Tolerability and Immune Response of SARS-CoV-2 Sclamp (COVID-19) Vaccine in Healthy Adults”. ClinicalTrials.gov. 3 tháng 8 năm 2020. NCT04495933. Lưu trữ bản gốc ngày 11 tháng 10 năm 2020. Truy cập ngày 4 tháng 8 năm 2020.
- ^ “UQ-CSL V451 Vaccine”. precisionvaccinations.com. Truy cập ngày 11 tháng 12 năm 2020.
- ^ a b “A prospective, randomized, adaptive, phase I/II clinical study to evaluate the safety and immunogenicity of Novel Corona Virus −2019-nCov vaccine candidate of M/s Cadila Healthcare Limited by intradermal route in healthy subjects”. ctri.nic.in. Clinical Trials Registry – India. 15 tháng 12 năm 2020. CTRI/2020/07/026352. Lưu trữ bản gốc ngày 22 tháng 11 năm 2020.
- ^ “Safety, Tolerability and Immunogenicity of INO-4800 for COVID-19 in Healthy Volunteers”. ClinicalTrials.gov. 7 tháng 4 năm 2020. NCT04336410. Lưu trữ bản gốc ngày 11 tháng 10 năm 2020. Truy cập ngày 14 tháng 7 năm 2020.
- ^ a b “IVI, INOVIO, and KNIH to partner with CEPI in a Phase I/II clinical trial of INOVIO's COVID-19 DNA vaccine in South Korea”. International Vaccine Institute. 16 tháng 4 năm 2020. Truy cập ngày 23 tháng 4 năm 2020.
- ^ “Study of COVID-19 DNA Vaccine (AG0301-COVID19)”. ClinicalTrials.gov. 9 tháng 7 năm 2020. NCT04463472. Lưu trữ bản gốc ngày 11 tháng 10 năm 2020. Truy cập ngày 14 tháng 7 năm 2020.
- ^ “Safety and Immunogenicity Study of GX-19, a COVID-19 Preventive DNA Vaccine in Healthy Adults”. ClinicalTrials.gov. 24 tháng 6 năm 2020. NCT04445389. Lưu trữ bản gốc ngày 11 tháng 10 năm 2020. Truy cập ngày 14 tháng 7 năm 2020.
- ^ “Safety and Immunity of Covid-19 aAPC Vaccine”. ClinicalTrials.gov. 9 tháng 3 năm 2020. NCT04299724. Lưu trữ bản gốc ngày 11 tháng 10 năm 2020. Truy cập ngày 14 tháng 7 năm 2020.
- ^ “Immunity and Safety of Covid-19 Synthetic Minigene Vaccine”. ClinicalTrials.gov. 19 tháng 2 năm 2020. NCT04276896. Lưu trữ bản gốc ngày 11 tháng 10 năm 2020. Truy cập ngày 14 tháng 7 năm 2020.
- ^ “A Phase I/II Randomized, Multi-Center, Placebo-Controlled, Dose-Escalation Study to Evaluate the Safety, Immunogenicity and Potential Efficacy of an rVSV-SARS-CoV-2-S Vaccine (IIBR-100) in Adults”. ClinicalTrials.gov. 1 tháng 11 năm 2020. NCT04608305.
- ^ Palca, Joe (6 tháng 4 năm 2021). “Scientists Race to Develop Next Generation of COVID Vaccines”. NPR.
- ^ Johnson, Carolyn Y.; Mufson, Steven (11 tháng 6 năm 2020). “Can old vaccines from science's medicine cabinet ward off coronavirus?”. The Washington Post. ISSN 0190-8286. Truy cập ngày 31 tháng 12 năm 2020.
- ^ “Bacille Calmette-Guérin (BCG) vaccination and COVID-19”. World Health Organization (WHO). 12 tháng 4 năm 2020. Lưu trữ bản gốc ngày 30 tháng 4 năm 2020. Truy cập ngày 1 tháng 5 năm 2020.
- ^ Le TT, Cramer JP, Chen R, Mayhew S (tháng 10 năm 2020). “Evolution of the COVID-19 vaccine development landscape”. Nature Reviews. Drug Discovery. 19 (10): 667–68. doi:10.1038/d41573-020-00151-8. PMID 32887942. S2CID 221503034.
- ^ a b c Tregoning JS, Russell RF, Kinnear E (tháng 3 năm 2018). “Adjuvanted influenza vaccines”. Human Vaccines & Immunotherapeutics. 14 (3): 550–64. doi:10.1080/21645515.2017.1415684. PMC 5861793. PMID 29232151.
- ^ a b c d Wang J, Peng Y, Xu H, Cui Z, Williams RO (tháng 8 năm 2020). “The COVID-19 Vaccine Race: Challenges and Opportunities in Vaccine Formulation”. AAPS PharmSciTech. 21 (6): 225. doi:10.1208/s12249-020-01744-7. PMC 7405756. PMID 32761294.
- ^ Vuong, Quan-Hoang; Le, Tam-Tri; La, Viet-Phuong; Nguyen, Huyen Thanh Thanh; Ho, Manh-Toan; Van Khuc, Quy; Nguyen, Minh-Hoang (18 tháng 1 năm 2022). “Covid-19 vaccines production and societal immunization under the serendipity-mindsponge-3D knowledge management theory and conceptual framework”. Humanities and Social Sciences Communications (bằng tiếng Anh). 9 (1): 1–12. doi:10.1057/s41599-022-01034-6. ISSN 2662-9992.
- ^ Simpson S, Kaufmann MC, Glozman V, Chakrabarti A (tháng 5 năm 2020). “Disease X: accelerating the development of medical countermeasures for the next pandemic”. The Lancet. Infectious Diseases. 20 (5): e108–15. doi:10.1016/S1473-3099(20)30123-7. PMC 7158580. PMID 32197097.
- ^ a b c d “With Pressure Growing, Global Race for a Vaccine Intensifies”. The New York Times. 2 tháng 5 năm 2020. ISSN 0362-4331. Bản gốc lưu trữ ngày 11 tháng 5 năm 2020. Truy cập ngày 2 tháng 5 năm 2020.
- ^ a b c d “Special Report: Countries, companies risk billions in race for coronavirus vaccine”. Reuters. 27 tháng 4 năm 2020. Bản gốc lưu trữ ngày 15 tháng 5 năm 2020. Truy cập ngày 2 tháng 5 năm 2020.
- ^ “Chinese scientists race to develop vaccine as coronavirus death toll jumps”. South China Morning Post. 26 tháng 1 năm 2020. Bản gốc lưu trữ ngày 26 tháng 1 năm 2020. Truy cập ngày 28 tháng 1 năm 2020.
- ^ “China's coronavirus vaccine drive empowers a troubled industry”. The New York Times. 4 tháng 5 năm 2020. ISSN 0362-4331. Bản gốc lưu trữ ngày 4 tháng 5 năm 2020. Truy cập ngày 4 tháng 5 năm 2020.
- ^ Thorp HH (tháng 3 năm 2020). “Underpromise, overdeliver”. Science. 367 (6485): 1405. Bibcode:2020Sci...367.1405T. doi:10.1126/science.abb8492. PMID 32205459.
- ^ “COVID-19 vaccine researchers say pandemic lockdown placing many serious obstacles to their work”. National Post. 20 tháng 4 năm 2020. Bản gốc lưu trữ ngày 23 tháng 4 năm 2020. Truy cập ngày 3 tháng 5 năm 2020.
- ^ Chen J (4 tháng 5 năm 2020). “Covid-19 has shuttered labs. It could put a generation of researchers at risk”. Stat. Lưu trữ bản gốc ngày 6 tháng 5 năm 2020. Truy cập ngày 4 tháng 5 năm 2020.
- ^ a b c “Vaccine Safety – Vaccines”. US Department of Health and Human Services. Lưu trữ bản gốc ngày 22 tháng 4 năm 2020. Truy cập ngày 13 tháng 4 năm 2020.
- ^ a b c d “The drug development process”. U.S. Food and Drug Administration (FDA). 4 tháng 1 năm 2018. Lưu trữ bản gốc ngày 22 tháng 2 năm 2020. Truy cập ngày 12 tháng 4 năm 2020.
- ^ a b Cohen J (tháng 6 năm 2020). “Pandemic vaccines are about to face the real test”. Science. 368 (6497): 1295–96. Bibcode:2020Sci...368.1295C. doi:10.1126/science.368.6497.1295. PMID 32554572.
- ^ Dubé E, Laberge C, Guay M, Bramadat P, Roy R, Bettinger J (tháng 8 năm 2013). “Vaccine hesitancy: an overview”. Human Vaccines & Immunotherapeutics. 9 (8): 1763–73. doi:10.4161/hv.24657. PMC 3906279. PMID 23584253.
- ^ “Fauci warns of 'anti-science bias' being a problem in US”. CNN. 18 tháng 6 năm 2020. Bản gốc lưu trữ ngày 21 tháng 6 năm 2020. Truy cập ngày 21 tháng 6 năm 2020.
- ^ “Vaccines: The Emergency Authorisation Procedure”. European Medicines Agency (EMA). 2020. Lưu trữ bản gốc ngày 24 tháng 9 năm 2020. Truy cập ngày 21 tháng 8 năm 2020.
- ^ Byrne J (19 tháng 10 năm 2020). “Moderna COVID-19 vaccine under rolling review process in Canada, EU”. BioPharma-Reporter.com, William Reed Business Media Ltd. Truy cập ngày 25 tháng 11 năm 2020.
- ^ “Pfizer files for emergency use of coronavirus vaccine in U.S. – what about in Canada?”. Global News. 20 tháng 11 năm 2020. Truy cập ngày 25 tháng 11 năm 2020.
- ^ “G20 launches initiative for health tools needed to combat the coronavirus”. The Globe and Mail. 25 tháng 4 năm 2020.
- ^ “Access to COVID-19 Tools (ACT) Accelerator” (PDF). World Health Organization (WHO). 24 tháng 4 năm 2020.
- ^ “The ACT-Accelerator: frequently asked questions (FAQ)”. World Health Organization (WHO). 2020. Truy cập ngày 16 tháng 12 năm 2020.
- ^ “Update on WHO Solidarity Trial – Accelerating a safe and effective COVID-19 vaccine”. World Health Organization (WHO). 27 tháng 4 năm 2020. Lưu trữ bản gốc ngày 30 tháng 4 năm 2020. Truy cập ngày 2 tháng 5 năm 2020.
It is vital that we evaluate as many vaccines as possible as we cannot predict how many will turn out to be viable. To increase the chances of success (given the high level of attrition during vaccine development), we must test all candidate vaccines until they fail. [The] WHO is working to ensure that all of them have the chance of being tested at the initial stage of development. The results for the efficacy of each vaccine are expected within three to six months and this evidence, combined with data on safety, will inform decisions about whether it can be used on a wider scale.
- ^ “Canada to spend $192M on developing COVID-19 vaccine”. Global News. 23 tháng 3 năm 2020. Bản gốc lưu trữ ngày 9 tháng 4 năm 2020. Truy cập ngày 24 tháng 3 năm 2020.
- ^ “Government of Canada's research response to COVID-19”. Government of Canada. 23 tháng 4 năm 2020. Lưu trữ bản gốc ngày 13 tháng 5 năm 2020. Truy cập ngày 4 tháng 5 năm 2020.
- ^ “US and China unleash wallets in race for coronavirus vaccine”. Nikkei Asian Review. 2 tháng 5 năm 2020. Bản gốc lưu trữ ngày 10 tháng 5 năm 2020. Truy cập ngày 3 tháng 5 năm 2020.
- ^ Morriss E (22 tháng 4 năm 2020). “Government launches coronavirus vaccine taskforce as human clinical trials start”. Pharmafield. Lưu trữ bản gốc ngày 17 tháng 6 năm 2020. Truy cập ngày 3 tháng 5 năm 2020.
- ^ “In quest for vaccine, US makes 'big bet' on company with unproven technology”. CNN. 1 tháng 5 năm 2020. Bản gốc lưu trữ ngày 13 tháng 5 năm 2020. Truy cập ngày 2 tháng 5 năm 2020.
- ^ Cohen J (tháng 5 năm 2020). “U.S. 'Warp Speed' vaccine effort comes out of the shadows”. Science. 368 (6492): 692–93. Bibcode:2020Sci...368..692C. doi:10.1126/science.368.6492.692. PMID 32409451.
- ^ Sink, Justin; Fabian, Jordan; Griffin, Riley (15 tháng 5 năm 2020). “Trump introduces 'Warp Speed' leaders to hasten COVID-19 vaccine”. Bloomberg. Bản gốc lưu trữ ngày 21 tháng 5 năm 2020. Truy cập ngày 15 tháng 5 năm 2020.
- ^ LaHucik, Kyle (17 tháng 6 năm 2021). “U.S. injects $3B-plus into COVID-19 research to develop antiviral pill within a year”. Fierce Biotech. Truy cập ngày 11 tháng 7 năm 2021.
- ^ Lỗi chú thích: Thẻ
<ref>sai; không có nội dung trong thẻ ref có tênwho-time - ^ a b Lỗi chú thích: Thẻ
<ref>sai; không có nội dung trong thẻ ref có têngates1 - ^ Fauci, Anthony S.; Lane, H. Clifford; Redfield, Robert R. (ngày 28 tháng 2 năm 2020). “Covid-19 — Navigating the Uncharted”. New England Journal of Medicine. doi:10.1056/nejme2002387. ISSN 0028-4793.
- ^ Lỗi chú thích: Thẻ
<ref>sai; không có nội dung trong thẻ ref có tênhbr - ^ Lỗi chú thích: Thẻ
<ref>sai; không có nội dung trong thẻ ref có têncbcr - ^ Lỗi chú thích: Thẻ
<ref>sai; không có nội dung trong thẻ ref có tênahmed - ^ Thanh Le T, Andreadakis Z, Kumar A, Gómez Román R, Tollefsen S, Saville M, Mayhew S (tháng 5 năm 2020). “The COVID-19 vaccine development landscape”. Nature Reviews. Drug Discovery. 19 (5): 305–306. doi:10.1038/d41573-020-00073-5. PMID 32273591.
- ^ Offit, Paul. “TWiV 720: With vaccines, Offit is on it”. This Week in Virology Podcast (bằng tiếng Anh). Vincent Racaniello Youtube Channel. Truy cập ngày 14 tháng 7 năm 2021.
- ^ Lỗi chú thích: Thẻ
<ref>sai; không có nội dung trong thẻ ref có tênyamey - ^ “Information for Healthcare Professionals on Pfizer/BioNTech COVID-19 vaccine”. Medicines & Healthcare products Regulatory Agency (MHRA). 8 tháng 12 năm 2020. Truy cập ngày 13 tháng 12 năm 2020.
- ^ “UK medicines regulator gives approval for first UK COVID-19 vaccine”. Medicines and Healthcare Products Regulatory Agency, Government of the UK. 2 tháng 12 năm 2020. Truy cập ngày 2 tháng 12 năm 2020.
- ^ Mueller, Benjamin (2 tháng 12 năm 2020). “U.K. Approves Pfizer Coronavirus Vaccine, a First in the West”. The New York Times. Truy cập ngày 2 tháng 12 năm 2020.
- ^ “GSK, Medicago launch phase 2/3 clinical trials of plant-derived COVID-19 vaccine”. PMLive. 13 tháng 11 năm 2020. Truy cập ngày 16 tháng 11 năm 2020.
- ^ “Questions and Answers: COVID-19 vaccination in the EU”. European Commission. 21 tháng 12 năm 2020. Truy cập ngày 21 tháng 12 năm 2020.
- ^ “Bahrain second in the world to approve the Pfizer/BioNTech Covid-19 vaccine”. Bahrain News Agency. 4 tháng 12 năm 2020. Truy cập ngày 9 tháng 12 năm 2020.
- ^ “UAE: Ministry of Health announces 86 per cent vaccine efficacy”. Gulf News. Truy cập ngày 9 tháng 12 năm 2020.
- ^ Thomas K, LaFraniere S, Weiland N, Goodnough A, Haberman M (12 tháng 12 năm 2020). “F.D.A. Clears Pfizer Vaccine, and Millions of Doses Will Be Shipped Right Away”. The New York Times. Truy cập ngày 12 tháng 12 năm 2020.
- ^ “FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine”. U.S. Food and Drug Administration (FDA) (Thông cáo báo chí). Truy cập ngày 18 tháng 12 năm 2020.
- ^ Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, và đồng nghiệp (tháng 1 năm 2021). “The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Moderna COVID-19 Vaccine - United States, December 2020” (PDF). MMWR Morbidity and Mortality Weekly Report. 69 (5152): 1653–56. doi:10.15585/mmwr.mm695152e1. PMID 33382675. S2CID 229945697.
- ^ Lovelace Jr B (19 tháng 12 năm 2020). “FDA approves second Covid vaccine for emergency use as it clears Moderna's for U.S. distribution”. CNBC. Truy cập ngày 19 tháng 12 năm 2020.
- ^ Corum J, Zimmer C. “How the Oxford-AstraZeneca Vaccine Works”. The New York Times.
- ^ Tétrault-Farber M, Vasilyeva G (31 tháng 3 năm 2021). “Russia registers world's first COVID-19 vaccine for animals”. Reuters (bằng tiếng Anh).
- ^ “В России зарегистрировали первую в мире вакцину против COVID-19 для животных” [The world's first COVID-19 vaccine for animals was registered in Russia]. TASS (bằng tiếng Nga). Moscow. 31 tháng 3 năm 2021. Truy cập ngày 19 tháng 5 năm 2021.
- ^ “EXCLUSIVE Blackwater founder Prince takes role in COVID vaccine venture”. Reuters. 4 tháng 6 năm 2021. Truy cập ngày 4 tháng 6 năm 2021.
- ^ “How flu vaccine effectiveness and efficacy are measured”. U.S. Centers for Disease Control and Prevention (CDC). 29 tháng 1 năm 2016. Lưu trữ bản gốc ngày 7 tháng 5 năm 2020. Truy cập ngày 6 tháng 5 năm 2020.
- ^ “Principles of epidemiology, Section 8: Concepts of disease occurrence”. U.S. Centers for Disease Control and Prevention (CDC). 18 tháng 5 năm 2012. Lưu trữ bản gốc ngày 6 tháng 4 năm 2020. Truy cập ngày 6 tháng 5 năm 2020.
- ^ a b Pallmann P, Bedding AW, Choodari-Oskooei B, Dimairo M, Flight L, Hampson LV, và đồng nghiệp (tháng 2 năm 2018). “Adaptive designs in clinical trials: why use them, and how to run and report them”. BMC Medicine. 16 (1): 29. doi:10.1186/s12916-018-1017-7. PMC 5830330. PMID 29490655.
- ^ “Adaptive designs for clinical trials of drugs and biologics: Guidance for industry” (PDF). U.S. Food and Drug Administration (FDA). 1 tháng 11 năm 2019. Lưu trữ bản gốc ngày 13 tháng 12 năm 2019. Truy cập ngày 3 tháng 4 năm 2020.
- ^ “An international randomised trial of candidate vaccines against COVID-19: Outline of Solidarity vaccine trial” (PDF). World Health Organization (WHO). 9 tháng 4 năm 2020. Lưu trữ (PDF) bản gốc ngày 12 tháng 5 năm 2020. Truy cập ngày 9 tháng 5 năm 2020.
- ^ “Pfizer and BioNTech Initiate Rolling Submission of Biologics License Application for U.S. FDA Approval of Their COVID 19 Vaccine” (Thông cáo báo chí). 7 tháng 5 năm 2021. Truy cập ngày 9 tháng 6 năm 2021.
- ^ “Moderna Announces Initiation of Rolling Submission of Biologics License Application (BLA) with U.S. FDA for the Moderna COVID-19 Vaccine” (Thông cáo báo chí). Moderna. 1 tháng 6 năm 2021. Truy cập ngày 9 tháng 6 năm 2021.
- ^ “FDA Briefing Document: Pfizer–BioNTech COVID-19 Vaccine” (PDF). U.S. Food and Drug Administration (FDA). 10 tháng 12 năm 2020. Truy cập ngày 1 tháng 1 năm 2021.
- ^ “2 Companies Say Their Vaccines Are 95% Effective. What Does That Mean? You might assume that 95 out of every 100 people vaccinated will be protected from Covid-19. But that's not how the math works”. The New York Times. 20 tháng 11 năm 2020. Truy cập ngày 21 tháng 11 năm 2020.
- ^ “#DoNotSqueezeMyArm: Doctor Sounds Alarm on How to Properly Inject COVID-19 Vaccine”.
- ^ Ng, Jia Yu (1 tháng 6 năm 2021). “Inadvertent subcutaneous injection of COVID-19 vaccine”. Postgraduate Medical Journal. 97 (1148): 400. doi:10.1136/postgradmedj-2021-139870. PMC 7886662. PMID 33589486 – qua pmj.bmj.com.
- ^ https://www.cdc.gov/vaccines/covid-19/downloads/covid19-vaccine-errors-deviations.pdf
- ^ Branswell H (2 tháng 2 năm 2021). “Comparing three Covid-19 vaccines: Pfizer, Moderna, J&J”. Stat. Truy cập ngày 28 tháng 2 năm 2021.
- ^ Randolph HE, Barreiro LB (tháng 5 năm 2020). “Herd Immunity: Understanding COVID-19”. Immunity. 52 (5): 737–41. doi:10.1016/j.immuni.2020.04.012. PMC 7236739. PMID 32433946.
- ^ “The FDA's cutoff for Covid-19 vaccine effectiveness is 50 percent. What does that mean?”. NBCNews.com. Truy cập ngày 8 tháng 1 năm 2021.
- ^ “EMA sets 50% efficacy goal – with flexibility – for COVID vaccines”. Regulatory Affairs Professionals Society (RAPS). Truy cập ngày 8 tháng 1 năm 2021.
- ^ Krause P, Fleming TR, Longini I, Henao-Restrepo AM, Peto R, Dean NE, và đồng nghiệp (12 tháng 9 năm 2020). “COVID-19 vaccine trials should seek worthwhile efficacy”. The Lancet. 396 (10253): 741–743. doi:10.1016/S0140-6736(20)31821-3. PMC 7832749. PMID 32861315.
- ^ Bartsch SM, O'Shea KJ, Ferguson MC, Bottazzi ME, Wedlock PT, Strych U, và đồng nghiệp (tháng 10 năm 2020). “Vaccine Efficacy Needed for a COVID-19 Coronavirus Vaccine to Prevent or Stop an Epidemic as the Sole Intervention”. American Journal of Preventive Medicine. 59 (4): 493–503. doi:10.1016/j.amepre.2020.06.011. PMC 7361120. PMID 32778354.
- ^ Dean N, Madewell Z (5 tháng 3 năm 2021). “Understanding the spectrum of vaccine efficacy measures”. The BMJ Opinion. Truy cập ngày 10 tháng 3 năm 2021.
- ^ “What is the difference between efficacy and effectiveness?”. Gavi, the Vaccine Alliance (GAVI). 18 tháng 11 năm 2020. Truy cập ngày 21 tháng 4 năm 2021.
- ^ Tal A, Cohen E (29 tháng 1 năm 2021). “Israel's health data suggests Pfizer and Moderna vaccines may be more effective than we thought”. CNN. Truy cập ngày 27 tháng 3 năm 2021.
- ^ Thompson MG, Burgess JL, Naleway AL, Tyner HL, Yoon SK, Meece J, và đồng nghiệp (tháng 4 năm 2021). “Interim Estimates of Vaccine Effectiveness of BNT162b2 and mRNA-1273 COVID-19 Vaccines in Preventing SARS-CoV-2 Infection Among Health Care Personnel, First Responders, and Other Essential and Frontline Workers - Eight U.S. Locations, December 2020-March 2021” (PDF). MMWR Morb Mortal Wkly Rep. 70 (13): 495–500. doi:10.15585/mmwr.mm7013e3. PMC 8022879. PMID 33793460.
- ^ Hall VJ, Foulkes S, Saei A, Andrews N, Oguti B, Charlett A, và đồng nghiệp (The SIREN Study Group) (tháng 2 năm 2021). “Effectiveness of BNT162b2 mRNA Vaccine Against Infection and COVID-19 Vaccine Coverage in Healthcare Workers in England, Multicentre Prospective Cohort Study (the SIREN Study)”. SSRN 3790399.
- ^ “Real-World Evidence Confirms High Effectiveness of Pfizer–BioNTech COVID-19 Vaccine and Profound Public Health Impact of Vaccination One Year After Pandemic Declared”. Pfizer. 11 tháng 3 năm 2021. Truy cập ngày 1 tháng 4 năm 2021.
- ^ Tande AJ, Pollock BD, Shah ND, Farrugia G, Virk A, Swift M, và đồng nghiệp (tháng 3 năm 2021). “Impact of the COVID-19 Vaccine on Asymptomatic Infection Among Patients Undergoing Pre-Procedural COVID-19 Molecular Screening”. Clinical Infectious Diseases. doi:10.1093/cid/ciab229. PMC 7989519. PMID 33704435.
- ^ Lopez Bernal J, Andrews N, Gower C, Robertson C, Stowe J, Tessier E, và đồng nghiệp (tháng 5 năm 2021). “Effectiveness of the Pfizer-BioNTech and Oxford-AstraZeneca vaccines on covid-19 related symptoms, hospital admissions, and mortality in older adults in England: test negative case-control study”. BMJ. 373: n1088. doi:10.1136/bmj.n1088. ISSN 1756-1833. PMC 8116636. PMID 33985964.
- ^ Burioni R, Topol EJ (21 tháng 6 năm 2021). “Has SARS-CoV-2 reached peak fitness?”. Nature Medicine. doi:10.1038/s41591-021-01421-7. PMID 34155413.
- ^ a b Office of the Commissioner (23 tháng 2 năm 2021). “Coronavirus (COVID-19) Update: FDA Issues Policies to Guide Medical Product Developers Addressing Virus Variants”. U.S. Food and Drug Administration (FDA). Truy cập ngày 7 tháng 3 năm 2021.
- ^ Mahase E (tháng 3 năm 2021). “Covid-19: Where are we on vaccines and variants?”. BMJ. 372: n597. doi:10.1136/bmj.n597. PMID 33653708.
- ^ “Inside the B.1.1.7 Coronavirus Variant”. The New York Times. 18 tháng 1 năm 2021. Truy cập ngày 29 tháng 1 năm 2021.
- ^ Muik A, Wallisch AK, Sänger B, Swanson KA, Mühl J, Chen W, và đồng nghiệp (tháng 3 năm 2021). “Neutralization of SARS-CoV-2 lineage B.1.1.7 pseudovirus by BNT162b2 vaccine-elicited human sera”. Science. 371 (6534): 1152–53. Bibcode:2021Sci...371.1152M. doi:10.1126/science.abg6105. PMC 7971771. PMID 33514629.
- ^ Wang P, Nair MS, Liu L, Iketani S, Luo Y, Guo Y, và đồng nghiệp (tháng 3 năm 2021). “Antibody Resistance of SARS-CoV-2 Variants B.1.351 and B.1.1.7”. Nature. 593 (7857): 130–35. Bibcode:2021Natur.593..130W. doi:10.1038/s41586-021-03398-2. PMID 33684923.
- ^ Emary KR, Golubchik T, Aley PK, Ariani CV, Angus BJ, Bibi S, và đồng nghiệp (tháng 2 năm 2021). “Efficacy of ChAdOx1 nCoV-19 (AZD1222) Vaccine Against SARS-CoV-2 VOC 202012/01 (B.1.1.7)”. SSRN 3779160.
- ^ Weekly epidemiological update on COVID-19 - 8 June 2021 (Situation report). World Health Organization. 8 tháng 6 năm 2021. Table 3. Truy cập ngày 14 tháng 6 năm 2021.
- ^ Weekly epidemiological update on COVID-19 - 8 June 2021 (Situation report). World Health Organization. 8 tháng 6 năm 2021. Table 3. Truy cập ngày 14 tháng 6 năm 2021.
- ^ Weekly epidemiological update on COVID-19 - 8 June 2021 (Situation report). World Health Organization. 8 tháng 6 năm 2021. Table 3. Truy cập ngày 14 tháng 6 năm 2021.
- ^ Weekly epidemiological update on COVID-19 - 8 June 2021 (Situation report). World Health Organization. 8 tháng 6 năm 2021. Table 3. Truy cập ngày 14 tháng 6 năm 2021.
- ^ Weekly epidemiological update on COVID-19 - 8 June 2021 (Situation report). World Health Organization. 8 tháng 6 năm 2021. Table 3. Truy cập ngày 14 tháng 6 năm 2021.
- ^ Khoury DS, Cromer D, Reynaldi A, Schlub TE, Wheatley AK, Juno JA, và đồng nghiệp (17 tháng 5 năm 2021). “Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection”. Nature Medicine. 27 (7): 1205–1211. doi:10.1038/s41591-021-01377-8. ISSN 1546-170X. PMID 34002089.
- ^ https://www.cell.com/cancer-cell/fulltext/S1535-6108(21)00389-5
- ^ Montgomery, Jay; Ryan, Margaret; Engler, Renata; Hoffman, Donna; McClenathan, Bruce; Collins, Limone; Loran, David; Hrncir, David; Herring, Kelsie (29 tháng 6 năm 2021). “Myocarditis Following Immunization With mRNA COVID-19 Vaccines in Members of the US Military”. JAMA Cardiology. doi:10.1001/jamacardio.2021.2833. PMC 8243257. PMID 34185045.
- ^ Polania Gutierrez, JJ; Munakomi, S (tháng 1 năm 2020). “Intramuscular Injection”. StatPearls. PMID 32310581. Chú thích journal cần
|journal=(trợ giúp) - ^ (Bản báo cáo).
|title=trống hay bị thiếu (trợ giúp) - ^ “COVID-19 Vaccine Janssen EPAR”. European Medicines Agency (EMA). 5 tháng 3 năm 2021. Lưu trữ bản gốc ngày 15 tháng 3 năm 2021. Truy cập ngày 16 tháng 3 năm 2021. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ “Information about the J&J/Janssen COVID-19 Vaccine”. U.S. Centers for Disease Control and Prevention (CDC). 31 tháng 3 năm 2021. Lưu trữ bản gốc ngày 7 tháng 4 năm 2021. Truy cập ngày 7 tháng 4 năm 2021.
 Bài viết này tích hợp văn bản từ nguồn này, vốn thuộc phạm vi công cộng.
Bài viết này tích hợp văn bản từ nguồn này, vốn thuộc phạm vi công cộng.
- ^ CDC COVID-19 Response Team, Food and Drug Administration (tháng 1 năm 2021). “Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Pfizer–BioNTech COVID-19 Vaccine – United States, December 14–23, 2020” (PDF). MMWR. Morbidity and Mortality Weekly Report. 70 (2): 46–51. doi:10.15585/mmwr.mm7002e1. PMC 7808711. PMID 33444297. Bản gốc (PDF) lưu trữ ngày 24 tháng 1 năm 2021. Truy cập ngày 2 tháng 2 năm 2021.
- ^ “COVID-19 vaccine safety update: Comirnaty” (PDF). European Medicines Agency. 28 tháng 1 năm 2021. Lưu trữ (PDF) bản gốc ngày 2 tháng 6 năm 2021. Truy cập ngày 30 tháng 1 năm 2021.
- ^ Hannah Devlin; Ian Sample (ngày 10 tháng 3 năm 2020). “Hopes rise over experimental drug's effectiveness against coronavirus”. The Guardian. Truy cập ngày 19 tháng 3 năm 2020.
- ^ Ritchie, Hannah; Mathieu, Edouard; Rodés-Guirao, Lucas; Appel, Cameron; Giattino, Charlie; Ortiz-Ospina, Esteban; Hasell, Joe; Macdonald, Bobbie; Beltekian, Diana; Dattani, Saloni; Roser, Max (2020–2021). “Coronavirus Pandemic (COVID-19)”. Our World in Data (bằng tiếng Anh). Truy cập ngày 3 tháng 2 năm 2025.
- ^ “Safety of COVID-19 Vaccines”. U.S. Centers for Disease Control and Prevention (CDC). 11 tháng 2 năm 2020. Truy cập ngày 13 tháng 7 năm 2021.
- ^ “Clinical Considerations: Myocarditis after mRNA COVID-19 Vaccines”. Centers for Disease Control and Prevention (CDC). Truy cập ngày 27 tháng 6 năm 2021.
 Bài viết này tích hợp văn bản từ nguồn này, vốn thuộc phạm vi công cộng.
Bài viết này tích hợp văn bản từ nguồn này, vốn thuộc phạm vi công cộng.
- ^ National Center for Immunization and Respiratory Diseases (23 tháng 6 năm 2021). “Myocarditis and Pericarditis Following mRNA COVID-19 Vaccination”. CDC.gov. Centers for Disease Control and Prevention. Truy cập ngày 2 tháng 7 năm 2021.
- ^ So AD, Woo J (tháng 12 năm 2020). “Reserving coronavirus disease 2019 vaccines for global access: cross sectional analysis”. BMJ. 371: m4750. doi:10.1136/bmj.m4750. PMC 7735431. PMID 33323376.
- ^ Adhanom Ghebreyesus T (18 tháng 1 năm 2021). “WHO Director-General's opening remarks at 148th session of the Executive Board”. World Health Organization (WHO). Truy cập ngày 25 tháng 1 năm 2021.
- ^ “U.S. pressured Brazil to ditch Russia's Sputnik V vaccine”. The Brazilian Report. 15 tháng 3 năm 2021. Truy cập ngày 21 tháng 3 năm 2021.
- ^ “Israel blocked Covid vaccines from entering Gaza, say Palestinians”. The Guardian. 16 tháng 2 năm 2021. Truy cập ngày 17 tháng 2 năm 2021.
- ^ “Israel's Vaccine Success Unleashes a Debate on Palestinian Inequities”. The New York Times. 4 tháng 2 năm 2021. Truy cập ngày 17 tháng 2 năm 2021.
- ^ Horton, Chris (17 tháng 2 năm 2021). “Taiwan Concerned China May Have Blocked Vaccine Purchase”. Bloomberg. Truy cập ngày 17 tháng 2 năm 2021.
- ^ Strazewski L (9 tháng 2 năm 2021). “Dr. Fauci: Variants reveal COVID-19 vaccination as global job”. American Medical Association. Truy cập ngày 4 tháng 3 năm 2021.
- ^ Bergmark E, Wierson A (26 tháng 2 năm 2021). “Opinion: Without a global vaccine plan, coronavirus variants could lead to untold number of deaths”. CNN. Truy cập ngày 4 tháng 3 năm 2021.
- ^ Blenkinsop P, Maclean W, Ellis A (10 tháng 3 năm 2021). “Rich, developing nations wrangle over COVID vaccine patents”. Reuters. Lưu trữ bản gốc ngày 11 tháng 3 năm 2021. Truy cập ngày 19 tháng 6 năm 2021.
- ^ Breuninger AM (5 tháng 5 năm 2021). “U.S. backs waiving patent protections for Covid vaccines, citing global health crisis”. CNBC. Truy cập ngày 5 tháng 5 năm 2021.
- ^ Sánchez Nicolás E (11 tháng 6 năm 2021). “Pressure builds on EU to back WTO vaccine-patent waiver”. EUobserver. Truy cập ngày 14 tháng 6 năm 2021.
- ^ “MEPs split over waiver for COVID-19 vaccine patents”. www.europarl.europa.eu. 19 tháng 5 năm 2021. Truy cập ngày 26 tháng 5 năm 2021.
- ^ “WHO says against proof of Covid-19 vaccination for international travel”. South China Morning Post. 20 tháng 4 năm 2021. Truy cập ngày 17 tháng 5 năm 2021.
- ^ Goodman, Peter S.; Mandavilli, Apoorva; Robbins, Rebecca; Stevis-Gridneff, Matina (15 tháng 5 năm 2021). “What Would It Take to Vaccinate the World Against Covid?”. The New York Times. ISSN 0362-4331. Truy cập ngày 17 tháng 5 năm 2021.
- ^ Muniz B, Fonseca B, Fernandes L, Pina R (15 tháng 3 năm 2021). “Brasil registra duas vezes mais pessoas brancas vacinadas que negras” [Brazil registers twice as many white people vaccinated as black people]. Agência Pública (bằng tiếng Bồ Đào Nha). Lưu trữ bản gốc ngày 15 tháng 3 năm 2021. Truy cập ngày 28 tháng 5 năm 2021.
- ^ Schnirring L (17 tháng 5 năm 2021). “UN agencies make urgent appeal for COVAX vaccine doses”. CIDRAP. Truy cập ngày 15 tháng 6 năm 2021.
- ^ “First Meeting of the Task Force on COVID-19 Vaccines, Therapeutics and Diagnostics for Developing Countries”. World Health Organization (WHO). 30 tháng 6 năm 2021. Truy cập ngày 5 tháng 7 năm 2021.
- ^ Tapper, James; McKie, Robin (3 tháng 7 năm 2021). “Vaccines 'outpaced by variants', WHO warns, as Delta now in 98 countries”. The Guardian. Truy cập ngày 5 tháng 7 năm 2021.
- ^ Mahase, Elisabeth (27 tháng 7 năm 2021). “Covid-19: Countries dump vaccines as demand slumps and sharing proves difficult”. The BMJ. 374: n1893. doi:10.1136/bmj.n1893. PMID 34315725. Bản gốc lưu trữ ngày 8 tháng 8 năm 2021. Truy cập ngày 10 tháng 8 năm 2021.
- ^ Levin, Dan (1 tháng 8 năm 2021). “The U.S. is wasting vaccine doses, even as cases rise and other countries suffer shortages”. The New York Times. Bản gốc lưu trữ ngày 9 tháng 8 năm 2021. Truy cập ngày 10 tháng 8 năm 2021.
- ^ Baraniuk, Chris (18 tháng 2 năm 2021). “Covid-19: How the UK vaccine rollout delivered success, so far”. BMJ (bằng tiếng Anh). 372: n421. doi:10.1136/bmj.n421. ISSN 1756-1833. PMID 33602672.
- ^ “Additional Dose of mRNA COVID-19 Vaccine for Patients Who Are Immunocompromised | CDC”. www.cdc.gov (bằng tiếng Anh). 13 tháng 8 năm 2021. Truy cập ngày 16 tháng 8 năm 2021.
- ^ “France plans rollout of Covid vaccine booster shots – but only for the vulnerable”. France 24 (bằng tiếng Anh). 4 tháng 8 năm 2021. Truy cập ngày 16 tháng 8 năm 2021.
- ^ “Israel to offer 3rd COVID booster shot to older citizens”. AP NEWS (bằng tiếng Anh). 29 tháng 7 năm 2021. Truy cập ngày 16 tháng 8 năm 2021.
- ^ Hunziker, Patrick (24 tháng 7 năm 2021). “Personalized-dose Covid-19 vaccination in a wave of virus Variants of Concern: Trading individual efficacy for societal benefit”. Precision Nanomedicine (bằng tiếng Anh). 4 (3): 805–820. doi:10.33218/001c.26101.
- ^ Thompson MG, Burgess JL, Naleway AL, Tyner HL, Yoon SK, Meece J, và đồng nghiệp (tháng 4 năm 2021). “Interim Estimates of Vaccine Effectiveness of BNT162b2 and mRNA-1273 COVID-19 Vaccines in Preventing SARS-CoV-2 Infection Among Health Care Personnel, First Responders, and Other Essential and Frontline Workers - Eight U.S. Locations, December 2020-March 2021” (PDF). MMWR Morb Mortal Wkly Rep. 70 (13): 495–500. doi:10.15585/mmwr.mm7013e3. PMC 8022879. PMID 33793460.
- ^ CDC (11 tháng 2 năm 2020). “When You've Been Fully Vaccinated”. Centers for Disease Control and Prevention (CDC). Truy cập ngày 29 tháng 4 năm 2021.
- ^ a b Azar A (4 tháng 2 năm 2020). “Notice of Declaration under the Public Readiness and Emergency Preparedness Act for medical countermeasures against COVID-19”. Lưu trữ bản gốc ngày 25 tháng 4 năm 2020. Truy cập ngày 22 tháng 4 năm 2020.
- ^ a b Lintern S (2 tháng 12 năm 2020). “Pfizer given protection from legal action over coronavirus vaccine by UK government”. The Independent. Truy cập ngày 8 tháng 5 năm 2021.
- ^ “Questions and Answers: Conditional Marketing Authorisation of COVID-19 Vaccines in the EU”. European Commission. 11 tháng 12 năm 2020. Question: What is the difference in liability between EU Conditional Marketing Authorisation vs Emergency Use Authorisations?. Truy cập ngày 29 tháng 12 năm 2020.
- ^ Haahr T (7 tháng 9 năm 2020). “COVID-19: MEPs want safe vaccines, full transparency and liability for companies”. European Parliament. Ms. Gallina stressed negotiations with companies had been difficult but underlined that those companies developing and manufacturing COVID-19 vaccines would indeed be liable according to current laws and if something goes wrong they could be taken to court. This also goes for compensation for hidden defects. Truy cập ngày 29 tháng 12 năm 2020.
- ^ “Investigation: Drugmaker 'bullied' Latin American nations”. Al Jazeera. 11 tháng 3 năm 2021. Truy cập ngày 15 tháng 6 năm 2021.
- ^ Barcellos, Renato (13 tháng 5 năm 2021). “Carlos Murillo diz que cláusulas criticadas pelo Brasil valem em 110 países” [Carlos Murillo says critical clauses for Brazil are valid in 110 countries]. CNN Brasil (bằng tiếng Bồ Đào Nha). Truy cập ngày 15 tháng 6 năm 2021.
- ^ Kertscher, Tom (ngày 23 tháng 1 năm 2020). “No, there is no vaccine for the Wuhan coronavirus”. PolitiFact. Poynter Institute. Lưu trữ bản gốc ngày 7 tháng 2 năm 2020. Truy cập ngày 7 tháng 2 năm 2020.
- ^ McDonald, Jessica (ngày 24 tháng 1 năm 2020). “Social Media Posts Spread Bogus Coronavirus Conspiracy Theory”. FactCheck.org. Annenberg Public Policy Center. Lưu trữ bản gốc ngày 6 tháng 2 năm 2020. Truy cập ngày 8 tháng 2 năm 2020.
Liên kết ngoài
[sửa | sửa mã nguồn]- DRAFT landscape of COVID-19 candidate vaccines – ngày 4 tháng 3 năm 2020
- COVID-19 Vaccine Tracker Jeff Craven 8/4/2020 Regulatory Affairs Professionals Society (RAPS)
Lỗi chú thích: Đã tìm thấy thẻ <ref> với tên nhóm “lower-alpha”, nhưng không tìm thấy thẻ tương ứng <references group="lower-alpha"/> tương ứng
 GIẢM
11%
GIẢM
11%
 GIẢM
47%
GIẢM
47%
 GIẢM
18%
GIẢM
18%
 GIẢM
17%
GIẢM
17%
 GIẢM
25%
GIẢM
25%




![[Tóm tắt và đánh giá] Bạn không thông minh lắm đâu | Cuốn sách tâm lý học thú vị bạn nên đọc vào năm 2024](https://down-bs-vn.img.susercontent.com/vn-11134201-23030-c1d4ivny4kov19.webp)



