Mangan heptoxide
| Mangan(VII) Oxide | |
|---|---|
 Cấu trúc 2D của mangan(VII) Oxide | |
 Cấu trúc 3D dạng đặc của mangan(VII) Oxide | |
 Cấu trúc 3D dạng rỗng của mangan(VII) Oxide | |
| Danh pháp IUPAC | Manganese(VII) oxide |
| Tên khác | Mangan heptOxide Đimangan heptOxide Pemanganic anhydride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | Mn2O7 |
| Khối lượng mol | 221,8718 g/mol |
| Bề ngoài | lỏng, đỏ đậm (nhiệt độ phòng), lục khi tiếp xúc với axit sunfuric |
| Khối lượng riêng | 2,79 g/cm³ |
| Điểm nóng chảy | 5,9 °C (279,0 K; 42,6 °F) |
| Điểm sôi | nổ khi đốt nóng , thăng hoa ở −10 °C (14 °F; 263 K) |
| Độ hòa tan trong nước | tan kèm phản ứng tạo axit permanganic, HMnO4 |
| Cấu trúc | |
| Cấu trúc tinh thể | Đơn nghiêng |
| Tọa độ | tứ diện kép |
| Các nguy hiểm | |
| Nguy hiểm chính | nguồn nổ mạnh, oxy hóa mạnh, ăn mòn rất mạnh |
| Các hợp chất liên quan | |
| Hợp chất liên quan | Re2O7 KMnO4 Tc2O7 |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Mangan(VII) Oxide là một hợp chất vô cơ với công thức hóa học Mn2O7. Chất lỏng dễ bay hơi này có tính phản ứng rất cao và được thảo luận nhiều hơn là điều chế. Nó là một chất oxy hóa nguy hiểm và lần đầu tiên được mô tả vào năm 1860. Chất này là Oxide axit của axit pemanganic.
Cấu trúc
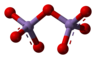
[sửa | sửa mã nguồn]Cấu trúc của phân tử mangan heptoxide bao gồm một cặp tứ diện có chung một đỉnh. Các đỉnh được chiếm bởi các nguyên tử oxy và tại trung tâm của tứ diện là trung tâm Mn(VII). Kết nối được biểu thị bằng công thức . Khoảng cách đầu cuối là 1,585 Å và oxy cầu nối là 1,77 Å so với hai nguyên tử Mn. Góc là 120,7°.
Pyrosulfat, pyrophosphat và dichromat có cấu trúc tương tự như cấu trúc của . Có lẽ các loài nhóm chính tương tự nhất là , dichlor heptoxide. Tập trung vào so sánh trong loạt kim loại chuyển tiếp, và có cấu trúc tương tự nhau nhưng góc là 180°. Rheni heptoxide, trong pha rắn không phải là phân tử mà bao gồm các trung tâm Re liên kết ngang với cả hai vị trí tứ diện và bát diện; trong pha hơi, nó là phân tử có cấu trúc tương tự .
Một số phản ứng hóa học
[sửa | sửa mã nguồn]Mangan heptoxide khi phản ứng với nước lạnh tạo ra acid permanganic:
Trường hợp dùng nhiều nước có thể tạo H3MnO5 (acid meso-permanganic). Dùng từ > 1 mol đến < 3 mol có thể tạo các acid giữa hai acid trên. HMnO4 không ổn định.
Axit pemanganic
[sửa | sửa mã nguồn]Acid permanganic là được tạo thành khi cho mangan(VII) Oxide phản ứng với nước lạnh:
 + +  2 2 
|
Là một axit mạnh, HMnO4 dễ bị mất liên kết để tạo thành thuốc tím có màu tím đậm. Kali permanganat, KMnO4, là một chất oxy hóa được sử dụng rộng rãi:
2  + 2 + 2 2 2 + + |
Dung dịch acid permanganic không ổn định, và dần dần phân hủy thành mangan dioxide, oxy và nước, với mangan(IV) oxide được hình thành ban đầu xúc tác cho sự phân hủy tiếp theo. Sự phân hủy được tăng tốc bởi nhiệt, ánh sáng và axit. Dung dịch đậm đặc phân hủy nhanh hơn pha loãng:
4  4 + 3 4 + 3
|
Acid meso-permanganic
[sửa | sửa mã nguồn]Acid meso-permanganic được tạo thành khi cho mangan heptoxide phản ứng với nước lạnh (khi dùng nhiều):
 + 3 + 3 2 2
|
Tham khảo
[sửa | sửa mã nguồn] GIẢM
26%
GIẢM
26%
 GIẢM
20%
GIẢM
20%
 GIẢM
38%
GIẢM
38%
 GIẢM
20%
GIẢM
20%
 GIẢM
48%
GIẢM
48%













![[Review sách] Đứa con đi hoang trở về: Khi tự do chỉ là lối thoát trong tâm tưởng](https://images.spiderum.com/sp-images/1721dda04fbe11ee89f5350a7d338c54.jpeg)

