Fulvestrant
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Faslodex, others |
| Đồng nghĩa | ICI-182780; ZD-182780; ZD-9238; 7α-[9-[(4,4,5,5,5-Pentafluoropentyl)-sulfinyl]nonyl]estra-1,3,5(10)-triene-3,17β-diol |
| AHFS/Drugs.com | Chuyên khảo |
| Giấy phép | |
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | Intramuscular injection |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Sinh khả dụng | Low[1] |
| Liên kết protein huyết tương | 99%[1] |
| Chuyển hóa dược phẩm | Hydroxylation, conjugation (glucuronidation, sulfation)[1] |
| Chu kỳ bán rã sinh học | IM: 40–50 days[1] |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| ECHA InfoCard | 100.170.955 |
| Dữ liệu hóa lý | |
| Công thức hóa học | C32H47F5O3S |
| Khối lượng phân tử | 606,78 g·mol−1 |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
Fulvestrant, được bán dưới tên thương hiệu Faslodex trong số những loại khác, là một loại thuốc dùng để điều trị ung thư vú di căn do thụ thể hoóc-môn (HR) ở phụ nữ sau mãn kinh tiến triển bệnh cũng như ung thư vú tiến triển âm tính HER2 dương tính kết hợp với palbociclib ở phụ nữ có tiến triển bệnh sau khi điều trị nội tiết.[2] Nó được đưa ra bằng cách tiêm bắp.[3]
Fulvestrant là một chất khử thụ thể estrogen chọn lọc (SERD) và là loại đầu tiên được chấp thuận.[4] Nó hoạt động bằng cách liên kết với thụ thể estrogen và làm mất ổn định nó, làm cho quá trình thoái hóa protein bình thường của tế bào phá hủy nó.
Fulvestrant đã được phê duyệt cho sử dụng y tế tại Hoa Kỳ vào năm 2002.[5]
Sử dụng trong y tế
[sửa | sửa mã nguồn]Ung thư vú
[sửa | sửa mã nguồn]Fulvestrant được sử dụng để điều trị ung thư vú di căn dương tính thụ thể hoóc môn hoặc bệnh không thể phát hiện tại địa phương ở phụ nữ sau mãn kinh; nó được tiêm bằng cách tiêm [3] Một đánh giá của Cochrane năm 2017 cho thấy nó an toàn và hiệu quả như liệu pháp nội tiết dòng đầu tiên hoặc dòng thứ hai.
Nó cũng được sử dụng để điều trị ung thư vú di căn hoặc HER2 âm tính tiến triển kết hợp với palbociclib ở phụ nữ tiến triển bệnh sau khi điều trị nội tiết tuyến đầu.[2]
Do thuốc có cấu trúc hóa học tương tự như estrogen, nó có thể tương tác với các xét nghiệm miễn dịch về nồng độ estradiol trong máu và cho thấy kết quả tăng giả.[6] Điều này có thể không đúng cách dẫn đến ngừng điều trị.
Dậy thì sớm
[sửa | sửa mã nguồn]Fulvestrant đã được sử dụng trong điều trị dậy thì sớm ngoại vi ở những bé gái mắc hội chứng McCune-Albright.[7][8][9]
Chống chỉ định
[sửa | sửa mã nguồn]Fulvestrant không nên được sử dụng ở phụ nữ bị suy thận hoặc đang mang thai.[2][10]
Tác dụng phụ
[sửa | sửa mã nguồn]Tác dụng phụ rất phổ biến (xảy ra ở hơn 10% số người) bao gồm buồn nôn, phản ứng tại chỗ tiêm, yếu và transaminase tăng cao. Các tác dụng phụ thường gặp (từ 1% đến 10%) bao gồm nhiễm trùng đường tiết niệu, phản ứng quá mẫn, chán ăn, đau đầu, đông máu trong tĩnh mạch, bốc hỏa, nôn mửa, tiêu chảy, tăng bilirubin, phát ban và đau lưng.[10]
Dược lý
[sửa | sửa mã nguồn]Dược lực học
[sửa | sửa mã nguồn]Fulvestrant là một chất chống ung thư hoạt động như một chất đối vận của thụ thể estrogen (ER) và cũng là một chất khử thụ thể estrogen chọn lọc (SERD).[4] Nó hoạt động bằng cách liên kết với thụ thể estrogen và làm cho nó kỵ nước hơn, làm cho thụ thể không ổn định và không phù hợp, từ đó dẫn đến các quá trình bình thường bên trong tế bào làm suy giảm nó.
Dược động học
[sửa | sửa mã nguồn]Fulvestrant được hấp thu chậm và nồng độ tối đa trong huyết tương (Cmax) đạt được sau khoảng 5 ngày và thời gian bán hủy cuối cùng là khoảng 50 ngày. Fulvestrant liên kết cao (99%) với protein huyết tương bao gồm lipoprotein mật độ rất thấp, lipoprotein mật độ thấp và lipoprotein mật độ cao. Nó dường như được chuyển hóa dọc theo con đường tương tự như steroid nội sinh; CYP3A4 có thể được tham gia, nhưng các tuyến đường không cytochrom dường như quan trọng hơn. Nó không ức chế bất kỳ enzyme CYP450. Loại bỏ gần như tất cả thông qua phân.[10]
Hóa học
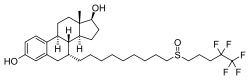
[sửa | sửa mã nguồn]Fulvestrant là một steroid estrane tổng hợp và là một dẫn xuất của estradiol. Một hợp chất alkyl - sulfinyl đã được thêm vào phối tử thụ thể estrogen nội sinh.[4]
Nó được phát hiện thông qua thiết kế thuốc hợp lý, nhưng đã được chọn để phát triển thêm thông qua sàng lọc kiểu hình.[11]
Lịch sử
[sửa | sửa mã nguồn]Fulvestrant là chất khử thụ thể estrogen chọn lọc đầu tiên được chấp thuận.[4] Nó đã được phê duyệt tại Hoa Kỳ vào năm 2002 [2] và ở Châu Âu vào năm 2004.[10]
Xã hội và văn hoá
[sửa | sửa mã nguồn]Đánh giá của NICE
[sửa | sửa mã nguồn]Viện Sức khỏe và Xuất sắc Lâm sàng Quốc gia Anh (NICE) cho biết vào năm 2011 rằng họ không tìm thấy bằng chứng nào Faslodex tốt hơn đáng kể so với các phương pháp điều trị hiện tại, vì vậy việc sử dụng rộng rãi sẽ không được sử dụng tốt cho Dịch vụ Y tế Quốc gia của đất nước. Điều trị Faslodex trong tháng đầu tiên, bắt đầu với liều tải, chi phí £ 1,044,82 ($ 1,666) và các lần điều trị tiếp theo có giá £ 522,41 mỗi tháng. Trong 12 tháng kết thúc vào tháng 6 năm 2015, giá Vương quốc Anh (không bao gồm VAT) của một tháng cung cấp anastrozole (Arimidex), không có bằng sáng chế, có giá 89 pence / ngày và letrozole (Femara) có giá 1,40 bảng / ngày.[12][13][14]
Gia hạn bằng sáng chế
[sửa | sửa mã nguồn]Bằng sáng chế gốc cho Faslodex đã hết hạn vào tháng 10 năm 2004. Các loại thuốc được xem xét theo quy định trước tiếp thị đủ điều kiện gia hạn bằng sáng chế và vì lý do này, AstraZeneca đã gia hạn bằng sáng chế đến tháng 12 năm 2011 [15][16] AstraZeneca đã nộp bằng sáng chế sau đó. Một phiên bản chung của Faslodex đã được FDA chấp thuận. Tuy nhiên, điều này không có nghĩa là sản phẩm sẽ nhất thiết phải có sẵn trên thị trường - có thể là do bằng sáng chế thuốc và/hoặc loại trừ thuốc.[17] Một bằng sáng chế sau đó cho Faslodex sẽ hết hạn vào tháng 1 năm 2021.[18] Atossa Genetics có một bằng sáng chế cho chính quyền của người đầu tiên vào vú thông qua một máy vi tính được phát minh bởi Susan Love.[19]
Nghiên cứu
[sửa | sửa mã nguồn]Fulvestrant được nghiên cứu về ung thư nội mạc tử cung nhưng kết quả không hứa hẹn và đến năm 2016 sự phát triển cho việc sử dụng này đã bị từ bỏ.[20]
Bởi vì chất đầu tư không thể được đưa ra bằng miệng, những nỗ lực đã được thực hiện để phát triển các thuốc SERD có thể uống bằng miệng, bao gồm cả brilanestrant và elacestrant.[4] Thành công lâm sàng của Fulvestrant cũng dẫn đến những nỗ lực khám phá và phát triển một nhóm thuốc song song của các chất thoái hóa thụ thể androgen chọn lọc (SARDs).
Tham khảo
[sửa | sửa mã nguồn]- ^ a b c d Florencio Zaragoza Dörwald (ngày 4 tháng 2 năm 2013). Lead Optimization for Medicinal Chemists: Pharmacokinetic Properties of Functional Groups and Organic Compounds. John Wiley & Sons. tr. 486–. ISBN 978-3-527-64565-7.
- ^ a b c d “US Label: Fulvestrant” (PDF). FDA. tháng 7 năm 2016.
- ^ a b Lee, CI; Goodwin, A; Wilcken, N (ngày 3 tháng 1 năm 2017). “Fulvestrant for hormone-sensitive metastatic breast cancer”. The Cochrane Database of Systematic Reviews. 1: CD011093. doi:10.1002/14651858.CD011093.pub2. PMID 28043088.
- ^ a b c d e Lai, AC; Crews, CM (ngày 25 tháng 11 năm 2016). “Induced protein degradation: an emerging drug discovery paradigm”. Nature Reviews. Drug Discovery. 16: 101–114. doi:10.1038/nrd.2016.211. PMC 5684876. PMID 27885283.
- ^ “Fulvestrant”. The American Society of Health-System Pharmacists. Truy cập ngày 8 tháng 1 năm 2017.
- ^ “Estradiol immunoassays – interference from the drug fulvestrant (Faslodex®) may cause falsely elevated estradiol results Medical safety alert - GOV.UK” (bằng tiếng Anh). UK Medicines and Healthcare products Regulatory Agency. ngày 24 tháng 3 năm 2016. Bản gốc lưu trữ ngày 19 tháng 7 năm 2017. Truy cập ngày 24 tháng 8 năm 2019.
- ^ Fuqua, John S. (2013). “Treatment and Outcomes of Precocious Puberty: An Update”. The Journal of Clinical Endocrinology & Metabolism. 98 (6): 2198–2207. doi:10.1210/jc.2013-1024. ISSN 0021-972X.
- ^ Zacharin, Margaret (2019). “Disorders of Puberty: Pharmacotherapeutic Strategies for Management”. doi:10.1007/164_2019_208. ISSN 0171-2004. Chú thích journal cần
|journal=(trợ giúp) - ^ Sims, Emily K; Garnett, Sally; Guzman, Franco; Paris, Françoise; Sultan, Charles; Eugster, Erica A (2012). “Fulvestrant treatment of precocious puberty in girls with McCune-Albright syndrome”. International Journal of Pediatric Endocrinology. 2012 (1). doi:10.1186/1687-9856-2012-26. ISSN 1687-9856. PMC 3488024.
- ^ a b c d “Faslodex 250 mg solution for injection - Summary of Product Characteristics”. UK Electronic Medicines Compendium. ngày 21 tháng 7 năm 2016.
- ^ Moffat, JG; Rudolph, J; Bailey, D (tháng 8 năm 2014). “Phenotypic screening in cancer drug discovery - past, present and future”. Nature Reviews. Drug Discovery. 13 (8): 588–602. doi:10.1038/nrd4366. PMID 25033736.
- ^ UK Department of Health Commercial Medicines Unit Electronic Medicines Information Tool, London, 2015
- ^ UK’s NICE says no to AstraZeneca breast cancer drug Faslodex Lưu trữ 2012-04-26 tại Wayback Machine, The Pharma Letter, ngày 10 tháng 11 năm 2011
- ^ National Institute for Health and Clinical Excellence Guidance Lưu trữ 2011-04-03 tại Wayback Machine Breast cancer (metastatic) - fulvestrant
- ^ Patent Term Extensions The United States Patent and Trademark Office.
- ^ Determination of Regulatory Review Period for Purposes of Patent Extension; FASLODEX A Notice by the Food and Drug Administration on 04/17/2003
- ^ Generic Faslodex Availability, Drugs.COM
- ^ Pink Ribbon Blues: How Breast Cancer Culture Undermines Women's Health By Gayle A. Sulik, Oxford University Press (Oct. 2010)
- ^ |U.S. Patent 6,638,727|[liên kết hỏng]
- ^ Battista, MJ; Schmidt, M (2016). “Fulvestrant for the treatment of endometrial cancer”. Expert Opinion on Investigational Drugs. 25 (4): 475–83. doi:10.1517/13543784.2016.1154532. PMID 26882357.
 GIẢM
44%
GIẢM
44%
 GIẢM
39%
GIẢM
39%
 GIẢM
-26%
GIẢM
-26%
 GIẢM
33%
GIẢM
33%
 GIẢM
15%
GIẢM
15%
 GIẢM
31%
GIẢM
31%



