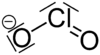
Natri chlorit
| Natri clorit | |||
|---|---|---|---|
| |||
 | |||
| Danh pháp IUPAC | Natri clorit | ||
| Tên khác | Muối natri của axit clorơ Textone | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| Số EINECS | |||
| KEGG | |||
| ChEBI | |||
| Số RTECS | VZ4800000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| ChemSpider | |||
| UNII | |||
| Thuộc tính | |||
| Công thức phân tử | NaClO2 | ||
| Khối lượng mol | 90,4405 g/mol | ||
| Bề ngoài | dạng rắn màu trắng | ||
| Khối lượng riêng | 2,5 g/cm³, rắn | ||
| Điểm nóng chảy | 180–200 °C (453–473 K; 356–392 °F) (phân hủy) | ||
| Điểm sôi | |||
| Độ hòa tan trong nước | 39 g/100 ml (17 ℃) | ||
| Cấu trúc | |||
| Các nguy hiểm | |||
| MSDS | ICSC 1045 | ||
| Chỉ mục EU | không có trong danh sách | ||
| NFPA 704 |
| ||
| Điểm bắt lửa | không cháy | ||
| Các hợp chất liên quan | |||
| Anion khác | Natri chloride Natri hypoclorit Natri clorat Natri perchlorat | ||
| Cation khác | Kali clorit Bari clorit | ||
| Hợp chất liên quan | Điôxit clo Axit clorơ | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Natri clorit (công thức hóa học NaClO2) là một hợp chất vô cơ dùng trong sản xuất giấy.
Sản xuất
[sửa | sửa mã nguồn]Axit clorơ tự do (HClO2) chỉ bền ở nồng độ thấp. Vì nó không thể cô đặc, nó không phải là một sản phẩm thương mại. Dù sao, muối của nó là natri clorit (NaClO2) thì bền và rẻ để có thể dùng trong thương mại. Các muối tương ứng của các kim loại nặng (Ag+, Hg+, Tl+, Pb2+, Cu2+ và NH4+) phân hủy mạnh dưới tác động của nhiệt độ hoặc khi va chạm mạnh.
Natri clorit được tìm thấy gián tiếp từ natri clorat, NaClO3. Đầu tiên, hợp chất dễ nổ, clo đioxit (nồng độ trên 10% ở áp suất khí quyển) được sản xuất bằng cách khử natri clorat trong dung dịch axit mạnh với xúc tác thích hợp (ví dụ, natri sunfit, lưu huỳnh dioxide, hay axit hypoclorơ). Sau đó clo đioxit được hấp thụ vào dung dịch kiềm rồi khử bằng hydro peroxide H2O2 thu được natri clorit.
Sử dụng
[sửa | sửa mã nguồn]Ứng dụng chính của natri clorit là sản xuất clo đioxit phục vụ cho việc tẩy rửa và tẩy màu trên vải dệt, bột giấy và giấy. Nó còn được dùng để khử trùng trong một vài nhà máy xử lý nước đô thị sau khi biến đổi thành clo đioxit. Việc này có một thuận lợi là khi so sánh với các hợp chất clo phổ biến hơn khác như trihalometan (hay còn gọi là chloroform), nó không được làm ra từ các hợp chất hữu cơ gây ô nhiễm. Natri clorit, NaClO2 còn có thành phần trong các thuốc chữa bệnh, thuốc nhuộm, nước súc miệng, kem đánh răng, gel, thuốc xịt, kẹo cao su, thuốc uống và có trong nước rửa kính dưới tên purite. Ngoài ra với tên Oxine nó còn dùng để làm vệ sinh ống thông khí, hệ thống HVAC/R, tường, sàn nhà và các bề mặt khác.
Trong tổng hợp hữu cơ, natri clorit thường được dùng để oxi hoá andehit thành các axit cacboxylic. Phản ứng thường có các dung dịch đệm (natri dihydrophotphat) dưới sự có mặt của chất hấp thụ clo (thường là 2-methyl-2-butene).
Ngày nay, natri clorit còn được dùng như một chất oxi hoá để chuyển hoá các alkyl furan thành các axit 4-oxo-2-alkenoic tương ứng bằng các quá trình tổng hợp đơn giản.[1]
An toàn
[sửa | sửa mã nguồn]Natri clorit, như nhiều chất oxy hóa khác, nên tránh bị vấy bẩn bởi các vật liệu hữu cơ để tránh hình thành những hợp chất dễ cháy nổ.
Độc tính
[sửa | sửa mã nguồn]Natri clorit là một chất oxy hóa mạnh và vì thế có thể cho rằng nó có thể gây ra một vài triệu chứng tương tự như natri clorat: chứng dư methemoglobin, xuất huyết, suy thận[2]. Một liều 10–15 gam natri clorat có thể làm chết người.[3]. Chứng dư methemoglobin đã được chứng minh ở chuột và mèo[4] và nghiên cứu mới đây của EMEA đã chỉ ra rằng những triệu chứng y khoa rất giống với triệu chứng gây ra bởi natri clorat ở chuột, chuột đồng, thỏ và khỉ xanh [5]
Mới chỉ có một trường hợp ngộ độc clorit được ghi nhận.[6]. Điều này cho thấy độc tính của natri clorit ngang bằng với natri clorat. Từ những phân tích với natri clorat, thậm chí chỉ với 1 lượng nhỏ khoảng 1 gam được dự đoán có thể gây buồn nôn, nôn mửa và có thể cả xuất huyết đe doạ tính mạng bởi sự thiếu hụt Glucose-6-Phosphate Dehydrogenase.
Tham khảo chung
[sửa | sửa mã nguồn]- "Chemistry of the Elements", N.N. Greenwood and A. Earnshaw, Pergamon Press, 1984.
- "Kirk-Othmer Concise Encyclopedia of Chemistry", Martin Grayson, Editor, John Wiley & Sons, Inc., 1985
Tham khảo
[sửa | sửa mã nguồn]- ^ Annangudi SP, Sun M, Salomon RG (2005). “Tổng hợp axit 4-oxo-2-alkenoic từ các 2-alkyl furan” (abstract). Synlett. 9: 1468. doi:10.1055/s-2005-869833.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Goldfrank's Toxicologic Emergencies, McGraw-Hill Professional; 8th edition (ngày 28 tháng 3 năm 2006), ISBN 9780071437639.
- ^ “Bản sao đã lưu trữ”. Bản gốc lưu trữ ngày 11 tháng 12 năm 2012. Truy cập ngày 3 tháng 8 năm 2010.
- ^ Clinical Toxicology of Commercial Products. Robert E. Gosselin, Roger P. Smith, Harold C. Hodge, Jeannet Braddock. Uitgever: Williams & Wilkins; 5 edition (September 1984) ISBN 978-0683036329
- ^ Sodium Chlorite - Summary Report of the Europena Agency for the Evaluation of Medicinal Products - Veterinary Medicines Evaluation Unit [1] Lưu trữ 2007-07-10 tại Wayback Machine
- ^ Ngộ độc natri clorit cấp tính liên quan với chứng suy thận. Lin JL, Lim PS. Ren Fail. 1993; 15 (5): 645–8. PMID 8290712
Liên kết ngoài
[sửa | sửa mã nguồn] GIẢM
30%
GIẢM
30%
 GIẢM
34%
GIẢM
34%
 GIẢM
17%
GIẢM
17%
 GIẢM
18%
GIẢM
18%
 GIẢM
24%
GIẢM
24%
 GIẢM
20%
GIẢM
20%